猪瘟病毒E2蛋白主要抗原区高效表达及间接ELISA抗体检测方法的建立和应用
2020-06-08陈九潘丽马中元崔燕
陈九,潘丽,马中元,崔燕*
(1. 甘肃农业大学,甘肃 兰州 730000; 2. 中国农业科学院兰州兽医研究所,甘肃 兰州 730000)
猪瘟病毒(classical swine fever virus)可感染所有品种不同年龄的猪和野猪[1]。猪瘟发病特征是实质器官出血、坏死与梗死;慢性发病常见纤维素性坏死性肠炎,曾被称为猪霍乱(hog cholera)[2-4]。猪瘟传播快、病死率高,在世界范围流行,是动物健康和生猪养殖业需要面对的巨大威胁,是猪最重要的病毒性传染病之一[5]。
猪瘟病毒是黄病毒科瘟病毒属成员,为单股正链RNA病毒,基因组大小约为12.3 kb,包含1个大的开放阅读框(ORF),侧翼是2个非翻译区(NTR)[6-8]。ORF编码大约3 900个氨基酸的多聚蛋白,由病毒和宿主细胞蛋白酶协同翻译和加工形成12种蛋白,核衣壳蛋白C和3种包膜糖蛋白E0、E1和E2构成病毒核酸外的蛋白质保护结构,此外还编码了8种非结构(NS)蛋白[9-10]。C、E0、E1、E2基因长度分别为297、681、585、1 119 nt,其中E2序列最长[11]。E2蛋白可分为A、B、C、D 4个抗原区,位于E2蛋白N端氨基酸残基690~866,是E2抗原性最强的部分[12]。A抗原区又分了3个亚区A1、A2、A3,A1亚区和B、C抗原区是中和抗原表位区[13]。猪自然感染猪瘟后,产生针对 E2蛋白的中和抗体,时间快,含量多,持续时间长。因此E2蛋白是猪瘟新型疫苗开发和临床检测的首选蛋白[14]。
大肠杆菌表达蛋白质的技术成熟、成本低、培养周期短、抗污染能力强,并且容易扩大生产,方便研究成果迅速转化产生实际价值。但大肠杆菌表达外源蛋白有时会出现表达量低甚至不表达的情况,这很有可能是因为这些外源基因使用的密码子是大肠杆菌非偏爱的密码子[15]。
本试验对E2蛋白主要抗原区稀有密码子进行同义替换以望提高表达量,并将重组蛋白作为抗原建立猪瘟病毒间接ELISA抗体检测方法。
1 材料与方法
1.1 质粒与感受态细胞
含有E2主要抗原区基因的重组质粒pET-30a(+)由南京金斯瑞生物科技有限公司合成,大肠杆菌BL21(DE3)菌种来自宝生物工程 (大连) 有限公司。
1.2 主要试剂及血清
兔抗猪IgG-HRP、蛋白质定量检测试剂盒购自天根生物技术有限公司;Ni-NTA柱购自GeneScript公司;猪瘟病毒、猪圆环病毒、猪蓝耳病病毒、伪狂犬病病毒、猪细小病毒、猪流行性腹泻病毒、口蹄疫病毒(O型)的抗体阳性血清来自兰州兽医研究所,由标准疫苗规范接种仔猪获得;阴性血清取自未接种疫苗的仔猪;其他试剂全为分析纯。
1.3 E2主要抗原区的密码子优化
根据研究显示,E2基因在表达时密码子选择有较高的偏爱性[16]。E2基因与大肠杆菌使用频率差异较大的密码子有33个,其中最突出的是GCG、AGA、AGG与CGC;E2基因中共有34个稀有密码子,其中存在AGGAGG、AGGAGA、CCCATA、AGAATA、CCCAGG、AGACCC、CTAATA这样稀有密码子成对出现的情况。在NCBI网站查阅猪瘟病毒全部序列(NC_002657.1),选择E2蛋白主要抗原区序列,根据大肠杆菌密码子偏好性对其进行稀有密码子同义替换和优化,主要方法是从猪瘟病毒全基因序列中获取 E2蛋白N端抗原区对应的编码序列,使用专业的计算机程序进行稀有密码子优化,优化后的序列由南京金斯瑞生物科技有限公司进行合成并直接插入pET-30a(+),重组质粒命名为pET-30a-E2。
1.4 E2原核表达及纯化
将pET-30a-E2转化宿主菌BL21 (DE3),涂布于含卡那霉素的LB平板选择培养,挑取单个白色菌落放入培养管,加入少量LB液体培养基于37 ℃培养2 h,将培养物按照1∶1 000比例接种在含有50 mg/L卡那霉素的LB液体培养基中于37 ℃、220 r/min扩增培养,直至OD600达到0.6~0.8,加入终浓度为1 mmol/L的IPTG进行诱导表达,继续培养6 h。
收集菌液以8 000 r/min离心5 min,弃去上清液收集菌体沉淀,菌体用PBS(pH=7) 缓冲液混合均匀,置于冰上用超声波破碎菌体,于4℃以10 000 r/min离心15 min,收集上清液和沉淀进行SDS-PAGE确定目的蛋白,包涵体用8 mol/L尿素溶解,离心收集上清液,微孔滤膜过滤去除杂质,按照说明书使用Ni-NTA柱进行过柱纯化重组蛋白。
1.5 重组蛋白Western blot测试抗原性
目的蛋白溶解在变性剂中,使用分步透析法[17]于4 ℃逐步去除变性剂根据说明书使用蛋白质定量检测试剂盒对溶液进行蛋白含量检测;纯化后的蛋白进行Western blot试验检测与猪瘟病毒血清抗体的结合能力。
1.6 优化间接ELISA反应条件
将纯化的重组蛋白用作包被抗原,进行方阵滴定确定合适的抗原包被量以及血清稀释度等,用pH=9.6的碳酸盐缓冲液稀释重组蛋白以25、50、100和200 ng/孔包被于酶标板,于4 ℃过夜,5 g/L的牛血清白蛋白试剂作为封闭液进行封闭,PBST洗涤3次,血清以1∶10、1∶20、1∶40、1∶80稀释,每孔100 μL转移至酶标板,于37 ℃孵育30 min,PBST洗涤3次,加入100 μL适合稀释度的兔抗猪IgG-HRP,于37 ℃孵育30 min,PBST洗涤3次,加入TMB底物,于37 ℃显色10 min,加50 μL终止液测量OD450值。确定检测的条件后,检测已知状态的血清样品,再使用MedCalc软件绘制血清检测特征曲线(receiver operating characteristic,ROC),对统计数据进行图像化便于直观感受和分析,选择正确率较高的临界值确定为猪瘟病毒间接ELISA抗体检测方法的临床检测临界值。
1.7 间接ELISA重复性检测
使用建立的间接ELISA方法在同一检测板和不同检测板进行8次进行重复检测,统计批内变异系数和批间变异系数,测试间接ELISA的重复性。
1.8 间接ELISA特异性检测
使用建立的间接ELISA方法对多种常见猪病毒抗体阳性血清进行检测,包括猪圆环病毒、猪蓝耳病病毒、伪狂犬病病毒、猪细小病毒、猪流行性腹泻病毒、口蹄疫病毒、猪瘟病毒的抗体阳性血清。为了使检测数据更具有适用性,统计时用“平均值±标准差”表示,以此测试间接ELISA的特异性。
1.9 间接ELISA临床检测
使用建立的间接ELISA检测566份临床血清,与爱德仕生产的猪瘟阻断ELISA试剂盒进行比较,统计符合率。
2 结果与分析
2.1 E2基因主要抗原区序列优化
原始序列对大肠杆菌的密码子适应指数为0.37,优化后的密码子适应指数为0.83;原始序列CG含量为49.81%,优化后CG含量为50.95%;优化后的核酸序列使用DNAMAN软件与原序列进行对比,相似度为72.92%,氨基酸序列不变。密码子优化后原序列中大肠杆菌使用频率低于10%的密码子全部被替换,序列中密码子偏好性普遍上升(见图1、图2)。
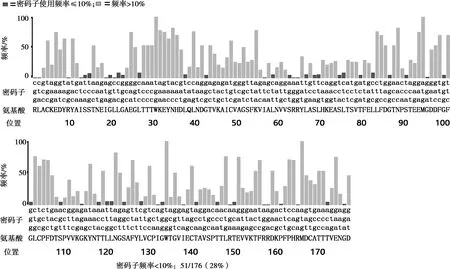
图 1 密码子优化前
2.2 重组蛋白的表达
重组蛋白的分子量约为30 ku,预期位置出现明显的条带,目的蛋白被成功诱导表达,占总蛋白的41%,表达产物主要分布在细菌的包涵体沉淀中(见图3)。
2.3 重组蛋白的纯化
将表达产物经Ni-NTA亲和纯化柱纯化,SDS-PAGE(见图4)显示只出现1条与目的蛋白分子质量一致的条带,证明重组蛋白已经被纯化。
2.4 重组蛋白Western blot试验
复性后的重组蛋白与猪瘟病毒阳性血清进行Western blot试验(见图5)。重组蛋白能与猪瘟病毒抗体发生特异性反应,在相应位置出现明显条带,表明重组蛋白与猪瘟病毒抗体结合能力强,可以用于检测猪瘟病毒抗体。
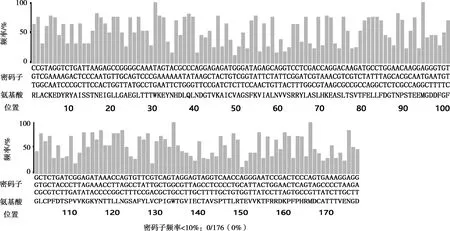
图 2 密码子优化后

M.蛋白 Marker;1~2. 上清;3~4. 包涵体
图3 E2重组蛋白的可溶性SDS-PAGE分析

M.蛋白 Marker;1. E2纯化蛋白
图4 E2重组蛋白纯化SDS-PAGE分析

M.蛋白 Marker; 1~2.E2蛋白
图5 E2重组蛋白的Western blot检测
2.5 重组蛋白浓度检测
根据说明书使用蛋白定量检测试剂盒进行重组蛋白浓度检测,显示纯化复性后溶液中蛋白质的含量约为1.5 mg/mL,纯化过程损失部分重组蛋白。
2.6 间接ELISA条件的优化
使用方阵滴定法确定最适抗原包被量和血清稀释度(见表1)。选择阳性血清OD450接近1且P/N较大的条件即抗原包被量为100 ng/孔,血清稀释度为1∶40。使用不同稀释度的酶标二抗进行血清样品检测,统计P/N值(见表2)。选择P/N值比较高的1∶20 000作为酶标二抗的工作浓度。
表1 选择最适抗原包被量和血清稀释度
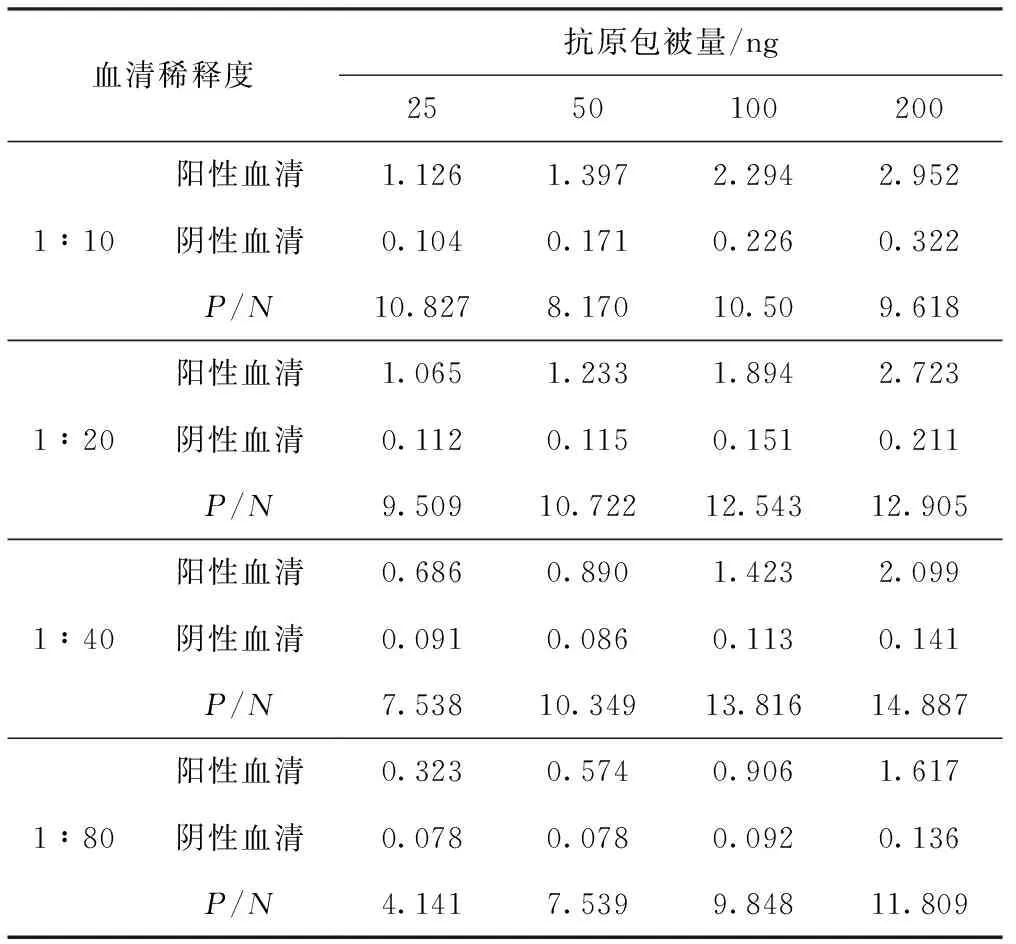
血清稀释度抗原包被量/ng25501002001∶10阳性血清1.1261.3972.2942.952阴性血清0.1040.1710.2260.322P/N10.8278.17010.509.6181∶20阳性血清1.0651.2331.8942.723阴性血清0.1120.1150.1510.211P/N9.50910.72212.54312.9051∶40阳性血清0.6860.8901.4232.099阴性血清0.0910.0860.1130.141P/N7.53810.34913.81614.8871∶80阳性血清0.3230.5740.9061.617阴性血清0.0780.0780.0920.136P/N4.1417.5399.84811.809
表2 不同稀释度的酶标二抗P/N值
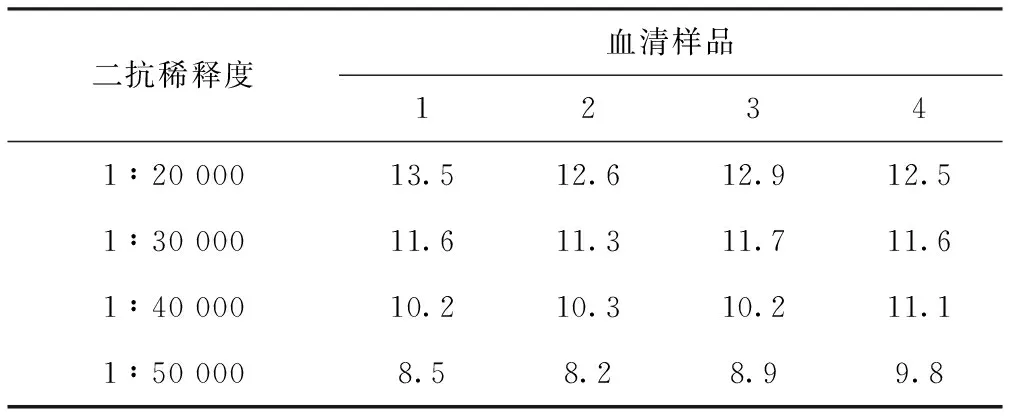
二抗稀释度血清样品12341∶20 00013.512.612.912.51∶30 00011.611.311.711.61∶40 00010.210.310.211.11∶50 0008.58.28.99.8
2.7 间接ELISA的临界值确定
确定间接ELISA反应条件之后,用间接ELISA检测164份阴性血清和402份阳性血清,统计检测数据,制作血清检测数据统计(见图6),并绘制ROC曲线(见图7)进行数据分析。当OD450取值大于0.23则百分之百阳性,当OD450取值小于0.13则百分之百阴性,在两者之间存在少量交叉。综合数据确定间接ELISA临床检测最佳临界值为OD450=0.18,此时约登指数为0.866 4。

图6 血清检测数据统计

图7 血清检测ROC曲线确定临界值
2.8 间接ELISA重复性试验
使用建立的间接ELISA方法在同一检测板和不同检测板上进行8次重复检测,结果显示批内变异系数为3.72%,批间变异系数为4.75%。重复检测变异系数均低于5%,说明建立的间接ELISA有良好的稳定性。
2.9 间接ELISA特异性测试
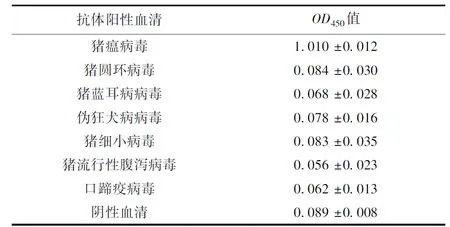
使用建立的间接ELISA检测多种常见猪病毒抗体阳性血清,阴性血清作为对照,统计检测结果(见表3)。除猪瘟病毒阳性血清,其他血清OD450值均没有到达间接ELISA临界值甚至远低于临界值,这表明建立的猪瘟病毒间接ELISA抗体检测方法与上述常见猪病毒抗体无交叉反应,特异性强有实用价值。
表3 间接ELISA特异性试验
2.10 间接ELISA临床检测
使用建立的猪瘟病毒间接ELISA抗体检测方法和爱德仕猪瘟阻断ELISA试剂盒对566份来自养殖站的临床血清样品进行检测,比较2种方法的符合性(见表4)。猪瘟病毒间接ELISA抗体检测方法的样本阳性率为65.37%,IDEXX试剂盒检测样本阳性率为71.02%,与爱德仕的阳性符合率为90.80%,阴性符合率为93.29%,总符合率为91.52%。本试验建立的间接ELISA与爱德仕生产的检测试剂盒符合率高。
表4 临床血清样品检测结果

检测方法爱德仕 ELISA+-合计间接ELISA+36511376-37153190合计402164566
注:“+”表示检测结果阳性;“-”表示检测结果阴性。
3 讨论
控制猪瘟的策略主要包括不接种疫苗的扑杀政策和系统性疫苗接种预防措施[18]。执行不接种疫苗政策的高密度养殖地区一旦猪瘟暴发会造成巨大的经济损失[19]。中国目前执行的猪瘟强制免疫措施要求猪群在一年中任何时间都要保持免疫率在90%以上[20]。为了控制和消除猪瘟,需要快速准确的实验室诊断方法。全病毒抗原的生产难度高,但通过重组DNA技术获得猪瘟病毒E2蛋白可以替代全病毒抗原[21]。大肠杆菌表达系统已成为生产重组蛋白的有力系统,由Studier等[22]研究的T7启动子驱动系统仍是最成功的系统之一。本试验选择带有强启动子T7和His标签蛋白的pET-30a(+)作为基因载体,宿主菌选择与之相配合的BL21(DE3),建立一个高表达的原核系统条件。
有证据显示物种间的密码子使用偏好并不相同,据Zhang等[23]的研究,大肠杆菌至少有8个稀有密码子,稀有密码子与表达量呈负相关关系,如果稀有密码子串联成簇出现则对表达的抑制作用更加显著。猪瘟病毒对原核表达系统的密码子适应指数偏低,E2基因中存在多个大肠杆菌稀有密码子,并且存在稀有密码子串联出现的情况;利用计算机程序对E2主要抗原区序列进行稀有密码子同义替换,不改变对应的氨基酸不影响蛋白质结构和活性[24]。生物密码子使用偏好的差异导致了异源基因表达的各种问题,但可以通过合理的基因设计和合成克服。全基因表达对宿主菌负担较大,本试验只表达E2蛋白主要抗原区保留免疫原性[25]。在相关报道中不乏有人实现部分或全长序列的表达但表达量普遍偏低。本试验成功表达E2主要抗原区,表达量占菌体总蛋白的41%,比张永国等[26]研究的表达量高10%,获得的重组蛋白含量是Wong等[27]的40倍,基本实现高表达。
E2蛋白在原核表达中以积聚体存在形成包涵体,有利于大肠杆菌大量表达外源蛋白,这虽然不是自然构象,但只需要通过细菌破碎离心就能进行收集达到初步纯化的效果,而且有证据表明大肠杆菌表达系统表达的截短E2蛋白不会改变抗原特性,不影响与对应抗体的特异性结合[27]。
很多猪瘟病毒抗体检测技术以全病毒为基础,但猪瘟病毒难以培养纯化且有散毒风险。本试验构建的间接ELISA使用纯化重组蛋白作为抗原提高了检测质量,可以通过光度定量对单个批次的抗原进行标准化,还可以排除杂蛋白引起的可能的非特异性反应。与仅检测所使用指示抗体单一结合位点的抗体阻断ELISA不同,间接ELISA检测与包被抗原结合的所有抗体。在正向间接血凝试验 (IHA)、间接ELISA、Dot-ELISA、胶体金免疫层析试纸条 (GICA) 4种检测猪瘟病毒抗体的方法中,间接ELISA具有最高的灵敏性;与阻断ELISA相比,间接ELISA操作更迅速、制备更简单。有研究者通过大量的田间试验数据研究后认为,在目前中国的猪瘟强制免疫政策下,猪瘟病毒间接ELISA抗体试剂盒更适合中国国情[28-29]。由于E2蛋白在猪瘟病毒中高度保守的抗原结构域,因此任何猪瘟病毒毒株(包括新出现的)所产生的抗体都有可能与其结合而被检测到,这更有利于流行病学调查。本试验构建的间接ELISA通过ROC曲线判断临界值,相比使用平均值作为临界值则ROC曲线不易受极端值的影响,更能反映数据的特异性和敏感性,提高检测准确性。另外本试验建立的间接ELISA与进口阻断ELISA试剂盒相比在阳性符合率、阴性符合率、总符合率方面均超过90%,在国内类似研究中处于较好水平。这可能与包被蛋白的抗原性和判断标准的选择有关[30]。
本试验重组E2蛋白由大肠杆菌生产,因此可能缺乏自然状态下的糖基化等修饰。虽有研究认为其对抗原性影响不大但还是存在差异,有可能影响正确指数,而且间接ELISA包被抗原的纯净度对检测效果有非常重要的影响。因此对重组蛋白的纯化要求比较高,间接ELISA的高灵敏性对血清样品的质量要求也较高,取得样品后要避免污染和及时检测,避免样品发生溶血导致非特异反应。由于牛病毒性腹泻病毒与猪瘟病毒的相似性以及自然状态下的血清学交叉反应,虽然本试验截取了E2蛋白抗原性最强的部分表达以削弱牛病毒性腹泻病毒抗体对猪瘟病毒抗体检测的影响,而且在标准化封闭养殖场猪感染牛病毒性腹泻病毒的可能性很小,但在临床怀疑存在牛病毒性腹泻病毒时建议搭配RT-PCR检测进一步确诊。
综上,本试验优化了E2主要抗原区密码子提高了表达量,重组蛋白与猪瘟抗体特异性结合强,构建的猪瘟病毒间接ELISA抗体检测方法与爱德仕生产的试剂盒总符合率达到91.52%,临床检测结果理想,可以进一步开发应用。
