利福昔明和精油对金黄色葡萄球菌生物被膜形成的抑制作用
2020-06-08蒋湘媛杨大伟张立强郭凡溪李颖余祖功
蒋湘媛,杨大伟,张立强,郭凡溪, 李颖, 余祖功*
(1. 南京农业大学动物医学院,江苏 南京 210095;2. 中国兽医药品监察所,北京 100081;3. 宁夏农垦贺兰山奶业有限公司,宁夏 银川 750001)
奶牛乳房炎是乳业生产中最常见的疾病之一,会致牛奶产量和品质下降,造成巨大的经济损失[1]。细菌感染是主要病因之一,其中约30%的乳房炎与金黄色葡萄球菌(金葡菌)感染有关[2]。防治以乳房注入抗菌药物为主。其中干奶期预防,每乳区注入1~2次,维持整个干奶期(60~65 d);泌乳期治疗,疗程往往3~6 d或更长,弃奶期常需4~9 d,仍难以有效清除病原菌[3]。有研究显示金葡菌能够形成生物被膜,可逃逸抗菌药物的抑杀[1]。
金葡菌生物被膜是由金葡菌和其产生的胞外基质形成的复杂结构,胞外基质包括多糖细胞间黏附素(polysaccharide intracellular adhesin, PIA)、细胞外DNA(extracellular DNA,eDNA)和蛋白质,可黏附于生物和非生物表面,一方面保护细菌免受抗生素杀灭,产生耐药性,另一方面又相当于“细菌库”长期不断释放细菌,致感染迁延为慢性[1]。有研究表明,亚抑菌浓度抗菌药物与细菌长期接触,能够促进或抑制生物被膜形成,如β-内酰胺类、氨基糖苷类、喹诺酮类等[4]。利福昔明属于利福霉素类抗生素,抗菌谱广,抗菌作用强,已批准于干奶期应用防治奶牛乳房炎[5]。利福昔明乳房注入后,长期存留于乳区中,存在以亚抑菌浓度与细菌长期接触的可能,是否对病原菌生物被膜的形成有促进或抑制作用,尚未见报道,值得研究。
植物精油是由植物的挥发性次代谢物和芳香物质等组成的多组分天然混合物,具有抗菌、抗病毒、抗氧化、或免疫调节等多种生物活性[6]。Hemaiswarya等[7]发现植物精油与氨苄西林、红霉素、诺氟沙星等多种抗菌药物有协同杀菌作用。食品工业与医药临床均发现精油有阻抑细菌生物被膜形成的作用[8-9]。因此,本试验测定了利福昔明与精油单独、联合对金葡菌的抑菌活性,并初步研究了两者单独和联合对强成膜菌株生物被膜形成的作用。
1 材料与方法
1.1 材料
利福昔明对照品,购自中国食品药品检定研究院,批号为130542-200601;3种精油:薄荷油、桉叶油和鱼腥草油,购自吉水华源香精有限公司;水解酪蛋白(MH)肉汤培养基,胰蛋白胨大豆肉汤(TSB)培养基,琼脂糖购自青岛高科园海博生物技术有限公司;结晶紫、甲醇、冰醋酸、PBS、葡萄糖等试剂均为分析纯。
1.2 菌株
金葡菌ATCC29213;9株金葡菌临床分离株,由南京农业大学兽医药理学和毒理学实验室从乳房炎患牛乳汁中分离、鉴定并保存。
1.3 药品贮备液的制备
利福昔明溶液的配制:精密称取利福昔明适量,用甲醇溶解,配成25 mL浓度为1 280 μg·mL-1的药液,过滤分装,保存于-20 ℃冰箱。
精油溶液的配制:精油、乙醇和吐温-80以体积比例2∶1∶1配比溶解,配置得到50%的精油溶液,过滤分装,常温保存。
1.4 菌液制备
将冻存的菌株接种于5 mL TSB培养基复苏后,接种划线于胰蛋白胨大豆固体(TSA)培养基,置37 ℃过夜培养;挑取平板上的单菌落接种于3 mL TSB培养基中,置37 ℃摇床震荡孵育10~12 h,用MH肉汤稀释菌液使其OD595 nm约为0.1,即菌液浓度为1×108CFU/mL,再用MH肉汤或TSB-g培养基(添加1%葡萄糖的TSB)倍比稀释菌液至得所需浓度。
1.5 利福昔明和精油对金葡菌最低抑菌浓度(MIC)的测定
用MH肉汤将药液稀释至所需浓度,加200 μL至第1列,无菌96孔板第2~11列加入MH肉汤100 μL,逐次倍比稀释得系列梯度浓度药液;将菌液用MH肉汤稀释100倍,第1~11列加入稀释完成的菌液100 μL;第12列前4孔每孔加入200 μL MH肉汤为阴性对照,后4孔每孔加入200 μL菌液为阳性对照。每个菌设置2个平行。培养板置于37 ℃培养18~22 h,观察结果。阴性对照孔无菌生长,阳性对照孔生长良好,试验有效;试验孔中细菌生长程度与阳性对照孔进行对比,能够明显抑制细菌生长的最小药物浓度定为MIC。试验重复3次。
1.6 利福昔明和精油联合的药敏试验
将利福昔明和精油用MH肉汤稀释至8倍MIC(8 MIC),并分别在2块96孔板中倍比稀释得到8、4、2、1、1/2、1/4 MIC的药液。取其中1块96孔板,第1~6排的第1加入50 μL的8、4、2、1、1/2、1/4 MIC的利福昔明,第1~6列的1~6孔加入50 μL的8、4、2、1、1/2、1/4 MIC的精油;将菌液用MH肉汤稀释100倍,第1~6列加入稀释完成的菌液100 μL;最终药液浓度梯度为2、1、1/2、1/4、1/8、1/16 MIC;第7行每孔加入200 μL灭菌MH肉汤为阴性对照,第8行每孔加入200 μL菌液为阳性对照。每个菌设置3个平行。培养板置于37 ℃培养18~22 h,观察结果,并计算联合抑菌指数(FICI)。精油联合MIC为精油与利福昔明联合时精油的MIC值,利福昔明联合MIC亦是。FICI =精油联合MIC/单独MIC + 利福昔明联合MIC/单独MIC。结果判断: FICI≤0.5为协同;0.5
1.7 利福昔明和精油对金葡菌的最低抑膜浓度(MBIC)测定
无菌96孔板最外围加入灭菌的TSB-g培养基200 μL封闭。用灭菌的TSB-g培养基将药液稀释至所需浓度,加200 μL至第2列,无菌96孔板第2~9列加入TSB-g培养基100 μL,逐次倍比稀释得系列梯度浓度药液;将菌液用TSB-g培养基稀释10倍,第2~9列加入稀释完成的菌液100 μL;第10列每孔加入200 μL灭菌TSB-g培养基为阴性对照,第11列每孔加入200 μL菌液为阳性对照。每个菌设置3个平行。培养板置于37 ℃培养48 h。
弃去悬浮液,PBS轻柔地洗2次,加入200 μL甲醇将被膜固定10 min。弃去甲醇,干燥,加入200 μL 0.1%的结晶紫染色5 min,弃去染色液,PBS轻柔地洗2次,干燥。加入200 μL 33%乙酸,振摇10 min,测定OD595 nm。试验孔中OD595 nm值与阴性对照孔OD595 nm值一致的最低药物浓度定为MBIC。试验重复3次。
1.8 利福昔明和薄荷油单独应用对生物被膜形成的影响
因薄荷油的抑菌效果和与利福昔明的联合效果最好,故采用薄荷油与利福昔明进行生物被膜的抑制试验。结晶紫染色试验显示,菌株S.a-2的OD595 nm大于其他菌株,且大于阴性对照OD595 nm的4倍,判定为强成膜株,故选其进行生物被膜影响试验。
无菌96孔板最外围加入TSB-g培养基200 μL封闭。将精油用灭菌的TSB-g培养基稀释至MIC,加100 μL至第2列,无菌96孔板第2~5列加入TSB-g培养基100 μL,逐次倍比稀释的系列梯度浓度药液;第6列加入1 MIC利福昔明100 μL;将菌液用灭菌的TSB-g培养基稀释10倍,第2~6列加入稀释完成的菌液100 μL;第7列每孔加入200 μL TSB-g培养基为阴性对照,第8列每孔加入200 μL菌液为无药对照。每个菌株各3个平行。培养板置于37 ℃培养48 h,结晶紫染色观察结果。设置3个复孔,试验重复3次。抑制率=(试验组OD-阴性对照组OD)/(无药对照组OD-阴性对照组OD)×100%。
1.9 利福昔明和薄荷油联合应用对生物被膜形成的影响
无菌96孔板最外围加入灭菌的TSB-g培养基200 μL封闭。将精油用灭菌的TSB-g培养基稀释至4 MIC,加200 μL至第2列,无菌96孔板第2~5列加入TSB-g培养基50 μL,逐次倍比稀释的系列梯度浓度药液;第2~5列加入2 MIC利福昔明50 μL;将菌液用灭菌的TSB-g培养基稀释10倍,第2~5列加入稀释完成的菌液100 μL;第7列每孔加入200 μL TSB-g培养基为阴性对照,第8列每孔加入200 μL菌液为无药对照。培养板置于37 ℃培养48 h,结晶紫染色观察结果。设置3个复孔,试验重复3次。
1.10 数据分析
数据分析由SPSS 19.0进行,采用单因素方差分析(ANOVA)检验差异。数据用“平均数±标准差”形式表示。
2 结果与分析
2.1 利福昔明和精油对浮游菌的抑制作用
利福昔明和精油对9株金葡菌的MIC见表1,利福昔明和精油的联合抑菌作用见表2。桉叶油对金葡菌的MIC为0.63%~5.00%。鱼腥草油对菌株S.a-3的MIC大于5.00%,对其他金葡菌的MIC为1.25%~5.00%。薄荷油对金葡菌的MIC为0.16%~2.50%。利福昔明对金葡菌的MIC为0.016~4.00 μg·mL-1。薄荷油和利福昔明联合显示相加作用,桉叶油和鱼腥草油与利福昔明显示无关联作用。3种精油中薄荷油的抑菌效果最强,且和利福昔明联合效果最好。
表1 利福昔明和精油对金葡菌MIC的测定结果
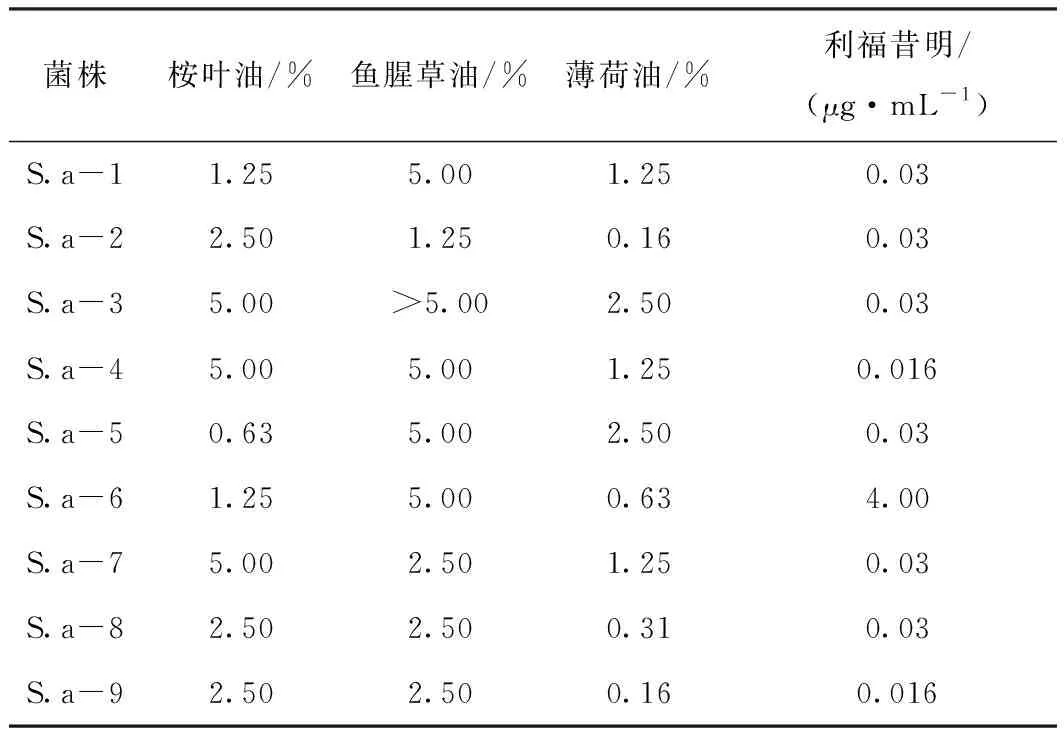
菌株桉叶油/%鱼腥草油/%薄荷油/%利福昔明/(μg·mL-1)S.a-11.255.001.250.03S.a-22.501.250.160.03S.a-35.00>5.002.500.03S.a-45.005.001.250.016S.a-50.635.002.500.03S.a-61.255.000.634.00S.a-75.002.501.250.03S.a-82.502.500.310.03S.a-92.502.500.160.016
2.2 薄荷油与利福昔明对金葡菌的MBIC
MBIC结果见表3,桉叶油和鱼腥草油的抑膜效果较差,桉叶油5株对金葡菌的MBIC高于5.00%,鱼腥草油对9株金葡菌的MBIC均大于等于5.00%。薄荷油对于生物被膜的抑制作用较好,MBIC为0.31%~5.00%,4~8号菌株的MBIC/MIC值均为1,而其他精油对于这5株菌的部分MBIC/MIC值可达2~4倍。利福昔明对金葡菌的MBIC为0.06~8.00 μg·mL-1,利福昔明对菌株的MBIC/MIC值多为2或4。利福昔明和薄荷油对菌株S.a-9的MBIC/MIC值最高,均为8。
表2 利福昔明和精油对金葡菌菌株S.a-2号的联合药敏试验结果

A药单独MIC/(μg·mL-1)联合MIC/(μg·mL-1)倍数B药单独MIC/%联合MIC/%倍数FICI作用利福昔明0.0310.0311桉叶油2.501.250.51.50无关0.0080.25鱼腥草油1.251.2511.25无关0.0080.25薄荷油0.160.080.50.75相加
注:联合MIC指A药与B药联合用药的MIC;倍数=联合MIC/单独MIC。
表3 利福昔明和精油对金葡菌MBIC的测定结果
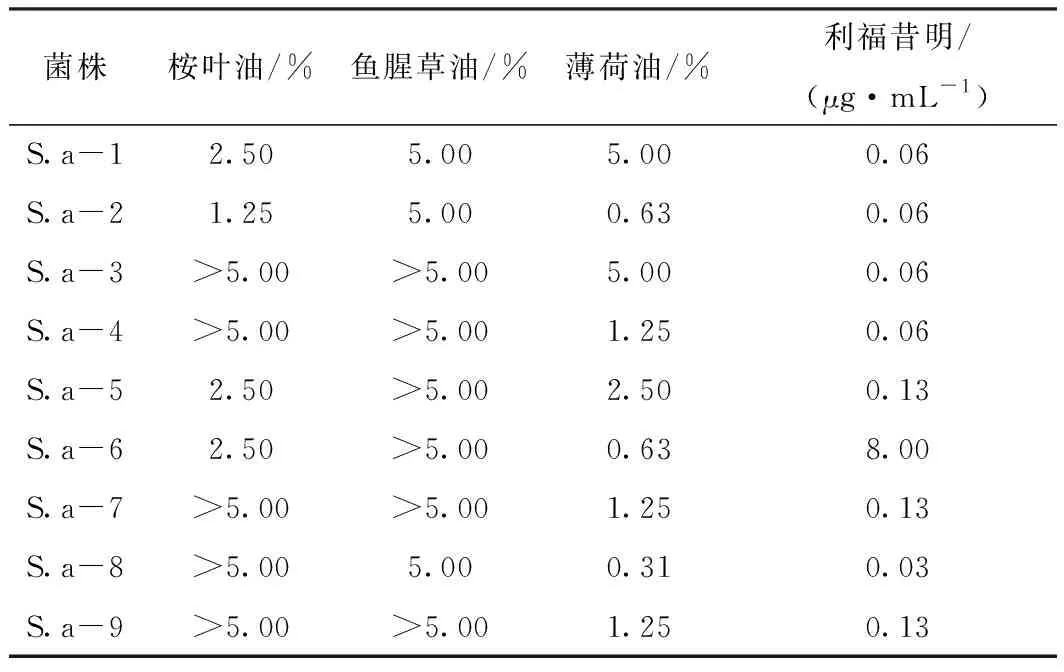
菌株桉叶油/%鱼腥草油/%薄荷油/%利福昔明/(μg·mL-1)S.a-12.505.005.000.06S.a-21.255.000.630.06S.a-3>5.00>5.005.000.06S.a-4>5.00>5.001.250.06S.a-52.50>5.002.500.13S.a-62.50>5.000.638.00S.a-7>5.00>5.001.250.13S.a-8>5.005.000.310.03S.a-9>5.00>5.001.250.13
2.3 薄荷油与利福昔明单独和联合对生物被膜形成的影响
亚抑菌浓度的薄荷油与1/2 MIC的利福昔明单独和联合对菌株S.a-2被膜形成的影响通过结晶紫染色测定,结果如图1。结果显示,与无药对照组相比,利福昔明与薄荷油单独和联合作用时对被膜形成的抑制作用均显示差异极显著(P<0.01)。1/2 MIC利福昔明对生物被膜的抑制率为40%;1/2 MIC、1/4 MIC、1/8 MIC、1/16 MIC的薄荷油对于生物被膜的抑制率分别为61%、53%、37%、41%。
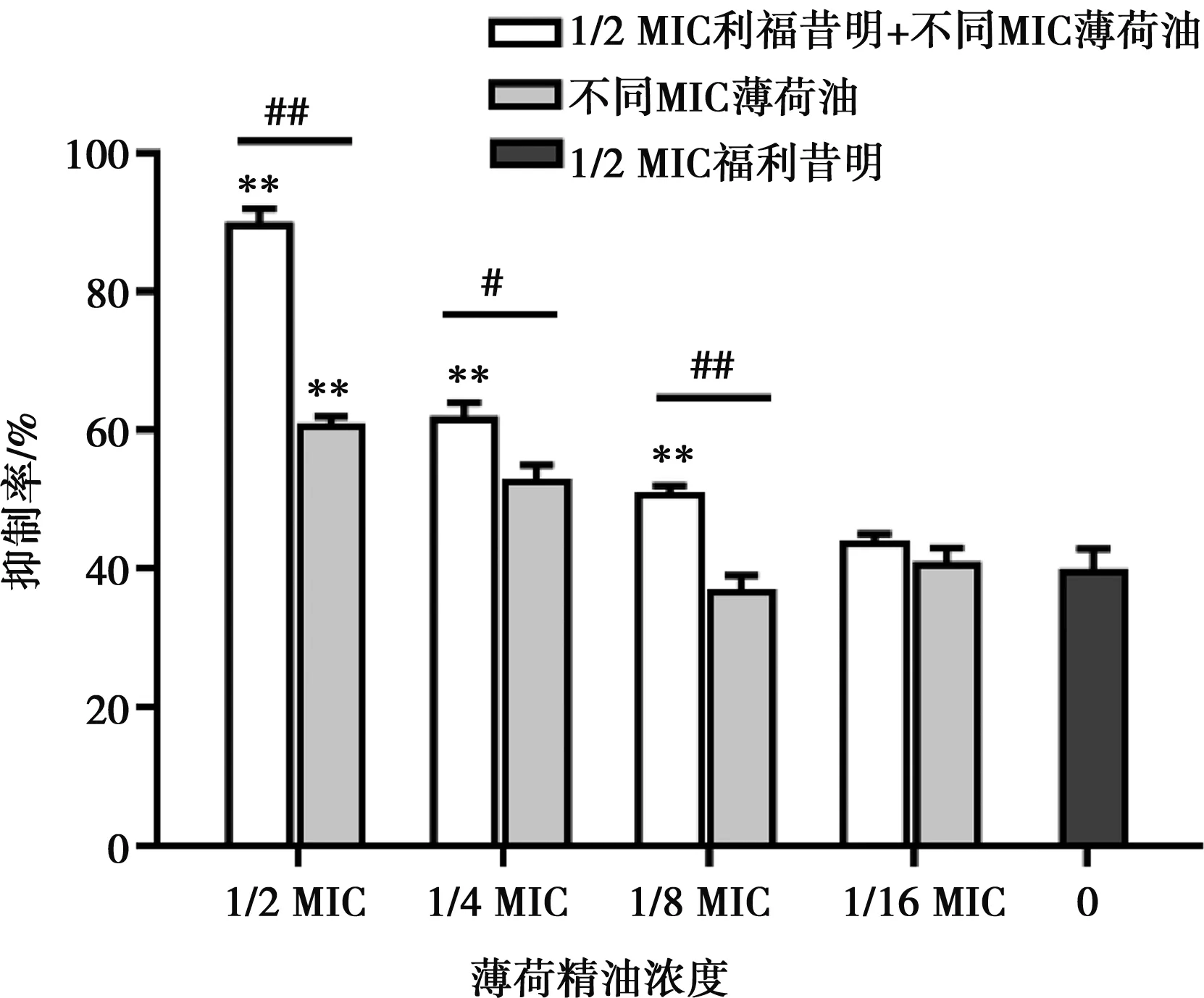
无药对照组的抑制率为0。**表示与1/2 MIC利福昔明组相比差异极显著(P<0.01);#表示与同浓度薄荷油组相比差异显著(P<0.05),##表示差异极显著(P<0.01)
图1 利福昔明与薄荷油单独和联合对金葡菌生物被膜形成的影响
1/2 MIC、1/8 MIC的薄荷油与利福昔明联合对菌株S.a-2生物被膜形成的抑制率为90%和51%,极显著高于1/2 MIC、1/8 MIC薄荷油组及利福昔明组(P<0.01)。1/4 MIC薄荷油与利福昔明联合的抑制率为62%,极显著高于利福昔明组(P<0.01),显著高于1/4 MIC薄荷油组(P<0.05);1/16 MIC的薄荷油与利福昔明联合的抑制率为44%,与1/16 MIC薄荷油组及利福昔明组差异不显著(P>0.05)。
3 讨论
利福昔明作用机制为不可逆与RNA聚合酶β-亚单位结合,抑制细菌RNA合成,达到杀菌目的[10]。本试验中,利福昔明对大部分奶牛乳房炎源金葡菌的MIC与其对标准株的MIC相近,仅对6号菌除外,其MIC达4.00 μg·mL-1,表明利福昔明对乳房炎源金葡菌有较强的体外抗菌活性。
精油具有强疏水性,可作用于细菌的细胞膜或线粒体膜结构的脂质成分,改变膜渗透性,导致细胞内物质的漏出,是其抗菌机制之一[6]。李凤清[11]报道桉叶油和薄荷油对金葡菌MIC范围为1.49%和2.97%。Hacioglu等[12]发现薄荷草药对耐甲氧西林金葡菌的MIC为0.62%。对于本试验中乳房炎源临床分离株而言,薄荷油作用强于桉叶油和鱼腥草油,MIC范围分别为0.16%~2.50%、0.63%~5.00%和1.25%~5.00%。
Kifer等[13]研究显示,薄荷油与莫匹罗星联合对金葡菌有相加作用。本试验中,薄荷油和利福昔明联合对金葡菌也有相加作用,但桉叶油、鱼腥草油与利福昔明联合表现为无关作用,推测可能由于不同精油有多种不同成分,并且其抗菌作用往往涉及不同机制或靶点[14]。因薄荷油单独及联合利福昔明抑菌作用最好,故采用薄荷油与利福昔明进行后续生物被膜的抑制试验。
生物被膜是一种高度组织化的多细胞聚合物,菌体封闭其中能避免与抗菌药物接触[1]。本文利福昔明和精油对大部分金葡菌的MBIC大于MIC,最大可达8倍。有报道,抗生素可对生物被膜有抑制或诱导作用。Liu等[15]发现金葡菌临床分离株用1/4 MIC的氨苄西林处理后,生物被膜形成量显著增加。Silva等[16]发现用1/2 MIC的庆大霉素处理乳房炎源大肠杆菌,被膜形成量显著升高。Kamaruzzaman 等[17]发现15 μg/mL的恩诺沙星能使金葡菌强成膜株的被膜形成量降低10%~27%。本试验中,1/2 MIC的利福昔明能抑制40%的金葡菌生物被膜形成。
精油的抑膜效果与其成分组成和成分的正辛醇-水分配系数有关,例如薄荷油的成分主要包括百里酚、薄荷醇和1,8-桉树脑,百里酚和薄荷醇的正辛醇-水分配系数大于3,具有较高的细胞膜穿透力[13]。Poli等[18]检测了12种EOs对生物被膜的影响,发现薄荷油对生物被膜形成的抑制作用最强,且抑制过程受群体感应信号系统调控。本试验中,薄荷油在各亚抑菌浓度(1/2 MIC~1/16 MIC)都显示对金葡菌生物被膜有明显抑制作用。本试验研究也发现利福昔明联合薄荷油对菌株生物被膜形成的抑制作用,较利福昔明单独作用时明显增强,当精油以1/2 MIC浓度联合时作用最强,可抑制90%的生物被膜形成,且抑制效果均强于两者单独组,但当薄荷油的浓度降低为1/16 MIC时,与单独组无显著差异,提示两者联合的抑膜效果与薄荷油浓度相关。
本试验发现薄荷油、利福昔明单独和联合应用对金葡菌生物被膜形成有抑制作用,为后续探讨二者对生物被膜形成的抑制作用机理奠定了基础。
