海南地区油茶未成熟胚分生结节的植株再生
2020-06-04侯辛辛陈健妙高兴赖杭桂王健胡新文吴友根
侯辛辛 陈健妙 高兴 赖杭桂 王健 胡新文 吴友根


摘要:【目的】建立海南地區油茶未成熟胚再生体系,为油茶组培快繁和遗传转化研究提供技术支持。【方法】以海南本地油茶合子胚为外植体,对其进行初代诱导、分化和增殖培养,筛选出最适于诱导分化的外植体胚发育时期,明确植株再生途径,从而建立分生结节组织植株再生体系。【结果】(1)盛花期后240~300 d的油茶幼胚在改良MS+激动素(KT)2.0 mg/L+萘乙酸(NAA)0.2 mg/L+玉米素(ZT)5.0 mg/L培养基上,初代诱导率在90.0%以上,以分生结节组织为主;(2)分生结节组织的适宜增殖培养基为改良MS+KT 1.0~2.0 mg/L+NAA 0.2 mg/L,增殖系数约4.6;(3)未成熟胚分生结节组织的分化培养基为改良MS+6-苄氨基嘌呤(6-BA)2.0 mg/L+NAA 0.2 mg/L+吲哚-3-乙酸(IAA)0.2 mg/L+ZT 5.0 mg/L+酸水解酪蛋白(CH)400.0 mg/L,平均每块分生结节组织诱导不定芽11.3个,不定芽以无糖暴露培养生根方式生根,移栽成活率为91.6%;(4)分生结节组织在改良MS+6-BA 2.0 mg/L+NAA 0.2 mg/L+ZT 5.0 mg/L+CH 400.0 mg/L上以分化体细胞胚状体为主,每块分生结节分化6.5个体细胞胚状体,具双子叶的体细胞胚状体在改良MS+6-BA 0.2 mg/L+IAA 2.0 mg/L+赤霉酸(GA3)0.5 mg/L+CH 200.0 mg/L培养基上有效成熟和萌发,萌发率为72.1%,胚芽和胚根有效伸长形成体胚再生植株,移栽成活率为94.7%。【结论】以油茶未成熟合子胚为外植体,通过分生结节组织方式增殖,可经体细胞胚状体发生和不定芽发生两种途径成功建立海南油茶未成熟胚分生结节植株再生体系。
关键词: 油茶;未成熟胚;分生结节组织;不定芽;体细胞胚状体;海南
Abstract:【Objective】To establish immature zygotic embryos regeneration system of Camellia vietnamensis, which provided technical support for the research on rapid propagation and genetic transformation of C.vietnamensis. 【Method】 Hainan native C. vietnamensis zygotic embryos were used as explants, zygotic embryos were induced to differentiate and proliferate to select the most suitable stage for inducing differentiation. Meanwhile, and the proliferation and plant regene-ration pathways were determined, so as to establish the regeneration system of meristematic nodules induced from immature zygotic embryos of C. vietnamensis. 【Result】(1)When the immature embryo at 240-300 d after full flowering stage cultured at the modified MS+kinetin(KT)2.0 mg/L+naphthaleneacetic acid(NAA) 0.2 mg/L+zeatin(ZT)5.0 mg/L me-dium, the initial induction rate of the immature embryo was more than 90.0% and the meristematic nodules were majority. (2)The suitable medium for the proliferation of meristematic nodule tissues was the modified MS+1.0-2.0 mg/L KT+0.2 mg/L NAA, and the proliferation coefficient was approximately 4.6. (3)The differentiation medium for immature embryo meristematic nodules was modified MS + 2.0 mg/L 6-benzyl adenine(6-BA)+0.2 mg/L NAA+0.2 mg/L indole-3-acetic acid(IAA)+ZT 5.0 mg/L and the average adventitious bud number was 11.3. Adventitious shoots rooted by sugar-free exposed cultivation, and plant transplant survival rate was 91.6%. (4)The meristematic nodule cultured at the modified MS+2.0 mg/L 6-BA+0.2 mg/L NAA+ZT 5.0 mg/L mainly differentiated into somatic embryo with the average somatic embryo number of 6.5. Somatic embryos with dicotyledonate were effectively germinated and developed into plantlets on modified MS+0.5 mg/L 6-BA+2.0 mg/L IAA+0.5 mg/L gibberellic acid(GA3)+CH 200.0 mg/L medium. The germination rate was 72.1%, the germ and the radicle were effectively extended to form a somatic embryo regeneration plant and plant transplant survival rate was 94.7%. 【Conclusion】With the immature zygotic embryos as explants, two regeneration systems of meristematic nodules in Hainan native C. vietnamensis are established through somatic embryogenesis and bud generation pathways respectively after proliferation of meristematic nodules.
0 引言
【研究意义】油茶(Camellia oleifera)是山茶科(Theaceae)山茶属(Camellia)植物中油脂含量较高的植物总称,生长在我国南方地区的高山及丘陵地带,是我国特有的一种纯天然高级油料,与橄榄、油棕和椰子并称为世界四大木本油料植物(庄瑞林,2008;杨枝林等,2017;龚洪恩等,2019)。海南省油茶资源丰富,栽培历史悠久,但其科研及产业发展相对滞后,尚未被列入国家发布的《全国油茶发展规划(2009—2020年)》,一定程度上限制了海南油茶产业的发展(郑道君等,2016)。当前,制约海南油茶优良品种推广种植、产业健康平稳发展的关键因素是缺乏本土油茶良种种苗,因此,亟待建立高效、稳定的海南本土油茶植株再生体系,为海南本地油茶良种壮苗繁育及品种遗传改良等提供技术保障。【前人研究进展】国内外针对油茶的研究从未停止,但各有侧重。国外的研究主要集中在茶皂素、皂苷及茶油抗氧化活性等领域(周增亮等,2019),也有针对油茶副产品的研发,如油茶果壳的循环利用等(Xie et al.,2018)。国内则更重视对不同产地油茶的种植和嫁接育苗技术,有关油茶组织培养与遗传转化的研究相对薄弱(Song et al.,2014;Yu et al.,2018)。组织培养是油茶离体保存、良种快繁及遗传改良等的技术保障,对促进油茶产业可持续健康发展具有重要意义(周开兵等,2016;周广振等,2018)。当前,我国用于造林的油茶物种主要有中果(普通)油茶(C. oleifera Abel.)、小果油茶(C. meiocarpa Hu.)和大果(越南、高州和陆川)油茶(C. vietnamensis T. C. Huang ex Hu)等(姚小华,2016)。中果油茶是我国油茶的主栽物种,以不同外植体建立的植株再生体系已有报道,如湘林、岑软及三华(华硕、华金和华鑫)等系列油茶,主要以顶芽、含腋芽茎段或子叶为外植体,通过器官发生途径形成再生植株,但不同品种或同一品种不同生长期所用基本培养基及植物生长调节剂种类与配比等存在明显差异(张智俊等,2005;王以红等,2011;李泽等,2014)。华鑫和长林等系列油茶是以幼胚为外植体,通过体细胞胚发生途径形成再生植株(范晓明等,2011;胡玉玲等,2014)。其中,华鑫油茶以10月果实的合子胚子叶为外植体,胚性愈伤组织的最佳诱导培养基为WPM+6-苄氨基嘌呤(6-BA)1.0 mg/L+萘乙酸(NAA)0.5 mg/L,诱导率为76.67%,胚状体最适分化培养基为MS+6-BA 2.0 mg/L+NAA 0.01 mg/L;以长林4号、长林53号和长林166号的合子胚为外植体,不同品种间的胚性愈伤组织诱导率和体胚植株再生频率差异显著,影响胚性愈伤组织诱导和体胚植株再生的关键因素依次为植物生长调节剂、胚龄和基本培养基;长林53号以7月幼果的合子胚为外植体,胚性愈伤组织的最佳诱导培养基为MS+2,4-二氯苯氧乙酸(2,4-D)0.5 mg/L+激动素(KT)0.5 mg/L+噻苯隆(TDZ)0.05 mg/L+甘氨酸(Gly)500 mg/L,诱导率为89.64%,胚状体萌发和组培苗生长最佳配方为MS+吲哚-3-乙酸(IAA)2.0 mg/L+6-BA 0.5 mg/L+TDZ 0.5 mg/L+酸水解酪蛋白(CH)500 mg/L。综上所述,以不同品种或同一品种不同外植体建立植株再生体系所需的基本培养基、植物生长调节剂种类与配比及培养条件存在明显差异。【本研究切入点】越南油茶是海南地区的油茶主栽物种,已适应热带季风海洋性气候并形成特殊的地理油茶小种——山柚(袁军等,2014),但有关其组织培养的研究鲜见报道。【拟解决的关键问题】探讨海南油茶的分生结节发生和植株再生过程及其影响因素,建立未成熟胚分生结节的植株再生体系,为油茶组培快繁和遗传转化研究提供技术支持。
1 材料与方法
1. 1 试验材料
试验材料为海南省琼海市会山镇中酒村油茶优株——油茶王,以盛花期后4个不同时期(表1)的油茶果实合子胚(图1)为外植体。采集的果实立即用冰盒保鲜并带回实验室,避免果实水分散失,保持活性。
1. 2 试验方法
1. 2. 1 外植体消毒 在超净工作台上,用70%酒精浸泡油茶果实1 min,无菌水冲洗1遍,然后以0.1% HgCl2消毒10 min,无菌水冲洗5遍。解剖刀切开果实,切取幼嫩种子及幼胚,接种在初代诱导培养基上,培养温度(25±2)℃,每天光照14 h,光照强度1500~2000 lx,空气相对湿度(70±5)%。
1. 2. 2 合子胚发育时期筛选 将4个不同生长时期(幼果、小青果、中青果和大黄褐果)未成熟胚接种于预试验筛选出的诱导培养基上进行培养。幼果以幼嫩种子为外植体;小青果、中青果和大黄褐果切掉大部分子叶后,余下子叶与胚芽、胚轴和胚根一起作为外植体。每种外植体接种20个,3次重复。培养35 d后统计萌发率及诱导生长情况,再过15 d后统计诱导结果,筛选出适宜的合子胚发育时期。诱导成效以诱导率(%)和诱导分化结果类型进行评价,其中,诱导率(%)=诱导出新组织或器官的外植体数目(包含诱导出愈伤组织、不定芽、分生结节组织及体细胞胚状体等)/接种外植体总数×100;诱导分化结果分为4种类型:I为愈伤组织,II为分生结节组织,III为不定芽,IV为合子胚萌发。初代诱导培养基以改良MS为基本培养基,添加KT 2.0 mg/L、NAA 0.2 mg/L和玉米素(ZT)5.0 mg/L,并添加椰汁(CW)5%、蔗糖30.0 g/L、植物凝胶2.2 g/L,pH 5.5。其中,改良MS为将MS培养基中大量元素含量减至2/3,并将有机成份改成B5(甘博格,Gamborg)培养基中的有机成份。培养温度(25±2)℃,空气相对湿度(70±5)%,自然散射光照培养。
1. 2. 3 分生结节组织增殖 将中青果合子胚诱导出的分生结节组织,以单粒结节组织、2~3粒结节连块或大粒切片的形式接种在添加不同种类、浓度和配比植物生长调节剂的增殖培养基上,筛选出适宜的分生结节组织增殖培养基。分生结节组织的增殖效果以增殖系数和结节组织生长情况为考核指标。增殖培养基以改良MS为基本培养基,添加不同浓度和配比的細胞分裂素(KT和6-BA)及一定浓度的生长素(NAA)、CW 10%、蔗糖30.0 g/L、植物凝胶2.2 g/L,pH 5.5。培养温度(25±2)℃,空气相对湿度(70±5)%,自然散射光照培养。25 d后统计增殖情况,增殖系数=分生结节总个数/原接种分生结节个数。
1. 2. 4 分生结节组织再分化 将增殖到一定量的分生结节组织以小单粒(直径≤5.0 mm)、2~3个丛生结节组织或大粒切片(长5.0 mm×宽5.0 mm×厚1.0 mm)的形式转接至再分化诱导培养基上,每瓶接种5块。每25 d继代转接一次,诱导培养60 d后,可观察到分生结节组织块再分化出不定芽和体细胞胚状体。再分化效果以分化率(%)、不定芽数/块和子叶形体细胞胚状体数/块进行综合评价,其中,总分化率(%)=再分化出体细胞胚状体或不定芽的分生结节块数/接种分生结节总块数×100;不定芽分化率(%)=分化出不定芽为主的结节块数/接种分生结节总块数×100;体细胞胚状体分化率(%)=总分化率(%)-不定芽分化率(%);不定芽数/块=诱导再分化不定芽总数/接种分生结节块数;体细胞胚状体数/块=再分化子叶形体细胞胚状体数/接种分生结节块数。每处理3次重复。分生结节再分化诱导培养基以改良MS为基本培养基,并添加不同浓度和配比的细胞分裂素(KT、6-BA和ZT)、生长素(NAA和IAA)、CW 10%、CH 400.0 mg/L、蔗糖50.0 g/L、活性炭0.1%及植物凝胶2.2 g/L,pH 5.5。培养温度(25±2)℃,空气相对湿度(70±5)%,自然散射光照培养。
1. 2. 5 分生结节组培芽生根和植株再生 待分生结节组织上的再分化芽长至3.0~4.0 cm时,在超净工作台内将单个小芽从丛芽基部切下,转接到生根培养基上诱导生根,共进行8个处理(表2)。
生根基本培养基为1/2改良MS(大量元素含量减半,但KH2PO4依然维持170.0 mg/L),根据各处理要求添加植物生长调节剂[吲哚丁酸(IBA)和NAA],其中①~⑥处理添加活性炭0.1%,蔗糖30.0 g/L,植物凝胶2.3 g/L,pH 5.5,121 ℃灭菌20 min;⑦和⑧处理不添加蔗糖、活性炭和植物凝胶,pH 5.5,用灭菌液体培养基将蛭石拌匀至不滴水,分装到12孔带盖育苗盒中,待接种用。常规组培生根每瓶接种10株,培养温度(25±2)℃;空气相对湿度(70±5)%;光照培养,光强2000 lx,每天光照12 h,无糖蛭石暴露培养生根每孔接一株,接完后盖好瓶盖并置于苗圃自然散射光下进行培养。每周观察、拍照记录。35 d后统计生根率(%)、生根数(条/株)、根长(cm)和根粗(mm),并观察根系和小苗生长状况以综合评价生根效果。其中,生根率(%)=生根的组培芽数/接种组培芽总数×100,根粗(mm)以电动游标卡尺测量,根长(cm)以直尺测量。每处理10瓶或10盒,每瓶(盒)10~12株,3次重复。
1. 2. 6 分生结节体细胞胚状体萌发和植株再生
将双子叶体细胞胚状体从丛状胚状体中单独剔剥下来,接种到体细胞胚状体萌发培养基上,诱导体细胞胚状体的胚芽萌发和胚根伸长,以形成具有完整主根和茎叶的体细胞胚状体再生植株。前期预试验结果表明,分化出的双子叶分生结节体细胞胚在原体胚诱导培养基6-BA 2.0 mg/L+NAA 0.2 mg/L+ZT 5.0 mg/L或不添加植物生长调节剂的空白培养基上,只有少部分能分化出胚根和胚芽,而在6-BA 1.0 mg/L+IAA 2.0 mg/L+赤霉素(GA3)0.5 mg/L的培养基上,大多数体胚能正常萌发,但植株相对瘦弱或褐死。为提高分生结节体胚植株再生频率,体胚诱导萌发培养基以改良MS为基本培养基,在添加植物生长调节剂IAA 2.0 mg/L和GA3 0.5 mg/L的基础上,添加6-BA 0.2~1.0 mg/L、CH 200.0 mg/L、蔗糖30.0 g/L、活性炭0.1%及植物凝膠2.4 g/L,pH 5.5。培养条件同1.2.4。培养30~40 d后,观察记录体细胞胚状体萌发和植株再生情况,以体细胞胚萌发率(%)及体胚再生植株生长情况作为萌发效果指标。其中,体细胞胚萌发率(%)=胚芽萌发大于1 cm和胚根伸长长于1.5 cm的体细胞胚状体数/接种体细胞胚状体总数×100,植株再生率(%)=形态完整的体胚苗/接种成熟体细胞胚状体数×100。
1. 2. 7 分生结节组织再生植株移栽 将瓶苗置于自然散射光下炼苗1周后,用镊子取出,洗净小苗基部培养基,在50%多菌灵可湿性粉剂800倍液中浸泡片刻,然后将小苗移栽到放置于苗圃内可降解营养钵(宽12.5 cm×高12.5 cm)中。基质体积混合比例为砖红壤土(8)∶蚯蚓土(1)∶椰糠(1)。另外,胚植株小苗移栽时进行断根处理;无糖蛭石暴露培养生根组培苗移栽时,将小苗从培养盒穴孔中轻挖出,无需清洗根部蛭石,直接移栽到无坊布育苗袋(宽12.0 cm×高13.0 cm),袋中混合的基质为蛭石(8)∶蚯蚓土(1)∶椰糠(1),移栽好的小苗置于温室中培养,1周后揭去薄膜,喷水以保持移栽环境相对湿度在80%以上,移栽30 d后统计成活率、新叶数及观察生长情况,综合评价移栽生长情况。移栽成活率(%)=长新根出新叶的苗数/移栽总数×100。
1. 3 统计分析
使用SPSS 22.0对试验数据进行统计分析。
2 结果与分析
2. 1 不同胚龄合子胚对初代诱导培养的影响
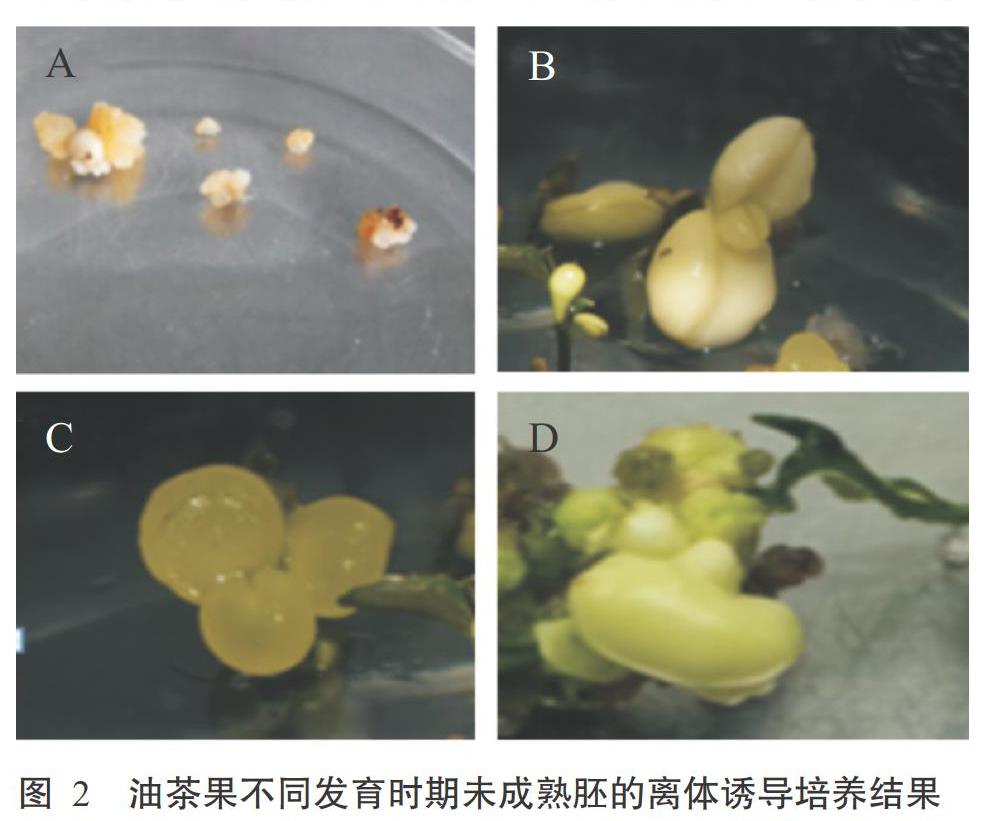
未成熟合子胚分化诱导的成效与胚龄有密切关系。如表3所示,从幼果至大黄褐果的发育期间,随着胚龄的增长,合子胚诱导率逐渐上升,幼果期和小青果期的合子胚诱导率显著低于中青果期和大黄褐果期的合子胚诱导率(P<0.05,下同),且后两者间无显著差异(P>0.05,下同)。各阶段的诱导类型也各不相同。以幼果期的幼嫩种子为外植体时,仅诱导出少量疏松的愈伤组织(图2-A),后期未见再分化;小青果未成熟胚以诱导质地致密的分生结节组织为主(图2-B),生长较慢;中青果未成熟胚以诱导质地脆嫩的分生结节组织为主(图2-C),生长较快;大黄褐果未成熟胚则以萌发成胚苗为主(图2-D),分化少量的致密分生结节组织和不定芽。因此,选用小青果和中青果未成熟胚作为外植体较优,尤其以中青果未成熟胚为外植体可诱导出大粒、均匀、生长旺盛、饱满且利于后期再分化的分生结节组织,最适宜作为海南地区油茶未成熟胚分生结节组织诱导的外植体。
2. 2 不同浓度和配比植物生长调节剂对分生结节组织增殖的影响
在不同类型植物分生结节发生增殖过程中起主导作用的植物生长调节剂也各不相同。将中青果未成熟胚(图3-A)诱导出的分生结节组织接种在添加不同浓度KT、6-BA和NAA的增殖培养基上,置于自然散射光下培养。每隔20~25 d继代1次,经2次继代后,其增殖系数为3.1~5.0(表4)。当NAA为0.2 mg/L时,分别添加不同浓度的KT或6-BA对增殖系数影响不显著,低浓度的细胞分裂素有利于诱导大粒、质地致密的结节组织,但随着浓度的增加,诱导出的结节组织质地脆嫩,且结节组织粒趋小。以KT与NAA组合时,分生结节生长旺盛有活力,增殖同步性好,未见分化;以6-BA与NAA组合时分生结节较早出现褐变坏死,组织趋于分化。未添加NAA时,复合添加1.0 mg/L 6-BA和1.0 mg/L KT,其增殖系数与添加KT和NAA或6-BA和NAA的差异不显著,但结节粒生长扁平不一且有褐变坏死;复合添加2.0 mg/L以上的KT和6-BA时,增殖系数呈下降趋势,且结节组织出现玻璃化致畸及褐变坏死。可见,改良MS+KT 1.0~2.0 mg/L+NAA 0.2 mg/L是适宜的分生结节组织增殖培养基,其培养获得的分生结节组织粒生长大小均匀、形状规则且有活力(图3-B),未见有提前分化。
2. 3 不同浓度和配比植物生长調节剂对分生结节再分化的影响
植物生长调节剂的种类、浓度和配比对组织再分化诱导至关重要,不同植物生长调节剂对不同植物种类的影响存在明显差异。中青果未成熟胚诱导的分生结节组织在增殖一定量后,选取生长饱满健壮、同步性好的分生结节块分别接种至6种分化培养基上诱导再分化。如表5所示,分生结节组织在6种培养基上培养40~60 d后,均能不同程度地启动再分化,培养材料同时存在正常增殖的分生结节组织、致密将分化的分生结节组织、已分化的不定芽、已分化的成熟体细胞胚状体,甚至存在再脱分化形成的愈伤组织等(图4)。分生结节组织在①~④号培养基上的分化效果明显优于⑤号和⑥号培养基,其中,②号培养基对不定芽分化率影响不明显,但体细胞胚状体分化率、每块结节不定芽分化数和每块结节体细胞胚状体分化数分别较①号培养基显著增加24.6%、86.0%和233.3%;③号培养基的不定芽分化率、分化数与②号培养基差异不显著,但与①号培养基相比体细胞胚状体分化率显著提高92.5%、每块结节的体细胞胚状体分化数显著增加将近10.0倍;④号培养基较①号培养基其不定芽分化率显著提高29.9%,每块结节不定芽分化数显著增加162.8%,而体细胞胚状体分化数较③号培养基略有上升,但每块结节体细胞胚状体分化率显著下降。综上所述,在6种分化培养基中,分生结节分化主要以不定芽为主,其中在④号培养基中不定芽分化率达56.0%,每块结节分化不定芽11.3个,最适合结节分化不定芽;③号培养基则更适合体细胞胚状体的分化,体细胞胚状体分化率达48.5%,每块结节分化体细胞胚状体6.5个,但按分化总组培芽苗数(不定芽+体细胞胚状体)计算,④号培养基分化的组培芽苗总数显著高于③号培养基。因此,可根据生产需要选择相应的分生结节分化途径,进一步优化利用。
2. 4 分生结节再分化芽的生根及植株再生情况
将分生结节再分化芽接种到8种培养基或培养基质上,30 d后统计生根情况。如表6和图5所示,以常规组培瓶内生根的方式,单独添加0.5 mg/L IBA(①处理)和5.0 mg/L IBA(②处理)均无法诱导分生结节再生芽生根,苗基部无明显变化或呈基部膨大,但添加IBA 0.5 mg/L+NAA 0.5 mg/L(③处理)或IBA 5.0 mg/L+NAA 5.0 mg/L(④处理)能诱导生根,生根率分别为4.3%和3.6%,除了④处理的根粗较③处理显著增大外,二者的根数和根长均无显著差异;组培苗基部浸泡200.0 mg/L NAA的⑤处理无明显促进生根,但浸泡200.0 mg/L IBA的⑥处理显著促进组培芽生根,生根率提高了31.7倍,达65.3%,生根数最多,每株组培苗约有6.7条白色不定根,是其他处理的1.8~5.2倍,不定根被有根毛,侧根少,根质地呈轻松泡状。以无糖蛭石暴露培养生根时,促进生根的效果较以200.0 mg/L IBA浸泡组培苗后常规瓶内生根的效果更明显,添加IBA 0.5 mg/L+NAA 0.5 mg/L(⑦处理)和IBA 5.0 mg/L+NAA 5.0 mg/L(⑧处理)的生根率分别较200.0 mg/L IBA浸泡处理(⑥处理)的瓶内生根显著提高19.1%和21.0%,三者间的根长差异不显著,但2种无糖[]石暴露培养生根苗的根粗较以200.0 mg/L IBA浸泡(⑥处理)的瓶内生根均显著增加25.0%,且无糖蛭石暴露培养生根苗的白绿色不定根侧根增多、被根毛且根的质地坚实柔韧,增大整个根的表面积,促使根部吸水效率更高,故无糖蛭石暴露培养生根苗是分生结节再生芽生根的最适方式,无糖培养基添加IBA 0.5 mg/L+NAA 0.5 mg/L的生根效率最高。
2. 5 分生结节再分化体细胞胚状体的萌发及植株再生情况
预试验结果显示,分生结节体细胞胚在原体胚分化培养基或未添加植物生长调节剂的常规体胚分化培养基上无法萌发成苗,在改良MS+IAA 2.0 mg/L+GA3 0.5 mg/L+6-BA 1.0 mg/L的条件下虽然能分化出胚芽和胚根,但体细胞胚状体再生小苗细瘦、真叶展开慢、主根短。为此,本研究适当降低6-BA用量,结果显示在IAA 2.0 mg/L+GA3 0.5 mg/L的条件下,随着6-BA浓度的减少,植株再生率呈递增趋势(表7),相对于1.0 mg/L的用量,仅添加0.2和0.5 mg/L 6-BA时的体细胞胚状体萌发率分别显著提高8.6%和11.9%,植株再生率分别显著提高36.7%和22.1%;且0.2 mg/L 6-BA处理的根芽更健壮,后期真叶抽生较快(图6)。因此,分生结节体细胞胚状体萌发小苗时以改良MS+IAA 2.0 mg/L+GA3 0.5 mg/L+6-BA 0.2 mg/L更适合。
2. 6 未成熟胚分生结节组织再生植株的移栽效果
如表8所示,与常规组培生根芽生小苗的移栽成活率相比,常规组培体细胞胚状体再生根小苗的移栽成活率显著提高27.6%,无糖暴露生根芽生小苗的移栽成活率显著提高23.5%,且二者间无显著差异。依据移栽小苗新叶和新根长出的时间,缓苗期最短的是无糖暴露生根芽生小苗,仅需1周左右,其次是常规组培体细胞胚状体再生小苗,缓苗时间最长的是常规组培生根芽生小苗,较无糖暴露生根芽生小苗约推迟9 d。移栽30 d后观测移栽小苗的长势(图7)发现,以常规组培体细胞胚状体再生小苗缓苗适应最好,长新叶快,2~3片,叶片平展、深绿色,缓苗期间未见明显的黄叶或落叶;其次是无糖暴露生根芽生小苗,新叶生长正常,1~2片,叶片平展宽大、深绿色,缓苗期间少有黄叶或落叶;而常规组培生根芽生小苗的新叶生长慢,叶片绿色,部分小苗叶片不够平整,部分植株有黄叶或落叶。
3 讨论
3. 1 适合海南地区油茶合子胚诱导分生结节组织的最佳发育期
选择合适外植体是组织培养成功的关键(王睿辉等,2002)。本研究发现,盛花期后240~300 d的中青果未成熟合子胚在改良MS+KT 2.0 mg/L+NAA 0.2 mg/L+ZT 5.0 mg/L的培养基上培养,其分生结节组织诱导率接近90.0%,分生结节细胞生长旺盛,未见褐死现象;在改良MS+KT 1.0~2.0 mg/L+NAA 0.2 mg/L培养基上增殖的分生结节组织粒大小均匀、形状规则、有活力且同步性状未见有提前分化,后续在合适的分化培养基上总分化诱导率约90.0%。说明中青果未成熟合子胚是适宜海南地区油茶诱导分生结节的适宜外植体,与胡玉玲等(2014)报道普通油茶长林53号以果实迅速膨大期的子叶为最佳体细胞胚状体诱导外植体的结论一致,即此时期油茶幼胚中相对高含量的可溶性蛋白、相对低含量的可溶性糖及高比例的ABA/ZR均可促进外植体的器官分化。未成熟胚发育处于胚发育旺盛时期,幼嫩的生殖器官胚性细胞活力强,更有利于直接分化胚性明显的分生结节组织、体细胞胚状体等(丛建民等,2012)。蔡玲等(2012)以岑软3号油茶成熟胚子叶为外植体,愈伤组织诱导率为30.0%,分化率仅为11.1%,分化结果均为不定芽,未见有体细胞胚状体发生。本研究以盛花期后300~370 d的大黃褐果合子胚为外植体,其诱导结果以胚芽萌发成苗为主,而鲜见胚性愈伤组织、分生结节或体细胞胚状体等其他器官和组织。
3. 2 油茶未成熟胚再生植株的初代诱导、增殖与分化
植物离体培养产生再生植株的途径通常分为器官发生途径和体细胞胚状体发生途径,除此之外,近年来研究较多的是分生结节植株再生途径,且证实在啤酒花(Humulus lupulus Linn.)、朝鲜白头翁(Pulsatilla koreana)及牡丹(Paeonia sect. Moutan)等植物中均存在分生结节组织同时分化多种组织和器官的现象(钟原等,2011;廉玉姬,2013)。长林53号油茶未成熟胚子叶在MS+2,4-D 0.5 mg/L+KT 0.5 mg/L+TDZ 0.05 mg/L+Gly 500 mg/L上培养120 d,体细胞胚状体诱导率为83.0%,体细胞胚状体在MS+IAA 2.0 mg/L+6-BA 0.5 mg/L+TDZ 0.5 mg/L+CH 500.0 mg/L上诱导萌发40 d,体细胞胚状体萌发率为73.0%,历时约165 d,按幼胚子叶诱导胚性愈伤组织→胚性愈伤组织增殖→胚性愈伤组织体细胞胚状体发生→体细胞胚状体萌发的过程完成分化,以体细胞胚状体发生途径进行植株再生(胡玉玲等,2014)。湘林4号油茶的幼胚和子叶在MS+2,4-D 2.0 mg/L+KT 1.0 mg/L上培养25 d后愈伤组织诱导率分别为78.0%和73.0%,部分愈伤组织继代2次约50 d可诱导出不定芽,幼胚和子叶的愈伤组织在MS+6-BA 3.0 mg/L+NAA 0.05 mg/L培养基上芽诱导率分别为95.0%和100.0%,再继代3次可获得丛生芽,有类似胚状体的细胞团但最终未能分化为完整植株,历时约165 d ,按芽幼胚组织诱导愈伤组织→愈伤组织分化不定芽→不定芽增殖的过程完成分化,以器官发生途径进行植株再生(毕方铖等,2004)。本研究中,中青果未成熟合子胚在改良MS+KT 2.0 mg/L+NAA 0.2 mg/L+ZT 5.0 mg/L+CW 5%培养基上诱导45 d,诱导率约90.0%,以直接分化分生结节组织为主,有少量幼胚萌发成苗,分生结节在改良MS+KT 1.0~2.0 mg/L+NAA 0.2 mg/L+CW 10%上培养25 d,其增殖系数为4.6~4.7,增殖后的分生结节经分化培养60 d,在改良MS+6-BA 2.0 mg/L+NAA 0.2 mg/L+ZT 5.0 mg/L+CW 10%+CH 400.0 mg/L+AC 0.1%上的体细胞胚状体分化率为48.5%,每块分生结节分化6.5个体细胞胚状体,不定芽分化率为41.5%,每块分生结节分化9.0个不定芽,在改良MS+6-BA 2.0 mg/L+NAA 0.2 mg/L+IAA 0.2 mg/L+ZT 5.0 mg/L+CW 10%+CH 400.0 mg/L+AC 0.1%上的不定芽分化率为56.0%,每块分生结节分化11.3个不定芽,体细胞胚状体分化率为32.3%,每块分生结节分化6.7个体细胞胚状体,体细胞胚状体在改良MS+IAA 2.0 mg/L+GA3 0.5 mg/L+6-BA 0.2 mg/L+CH 200.0 mg/L+AC 0.1%上进行30~40 d诱导萌发,萌发率为72.1%,按幼胚诱导直接分化分生结节→分生结节增殖→分生结节再分化体细胞胚状体和不定芽的过程完成启动诱导、增殖和器官分化(历时160~170 d),以分生结节发生途径进行植株再生。
可见,不同品种油茶的幼胚组织外植体在不同适宜条件下历时160~170 d完成幼胚组织的启动诱导、增殖和分化,经体胚发生、器官(不定芽)发生或分生结节发生途径进行分化,在相同时间内,根据外植体启动(愈伤组织或分生结节)诱导率、(愈伤组织、芽或分生结节)增殖系数、器官(不定芽或体细胞胚状体)分化率及体细胞胚状体萌发率等指标计算分化器官的总数,分生结节途径植株再生方式通过分生结节的迅速、稳定增殖,在较短时间内能有效扩大器官分化材料基数,再分化出体细胞胚状体和不定芽,相对于体细胞胚状体发生途径和不定芽发生途径,该途径对提高后续植株再生频率的潜力更大。海南本土油茶在改良MS+6-BA 2.0 mg/L+NAA 0.2 mg/L+ZT 5.0 mg/L+CW 10%+CH 400.0 mg/L+AC 0.1%的培养基上以分化体细胞胚状体为主,该结论也为其他外植体通过分生结节植株再生途径提供了借鉴经验。
3. 3 分生结节再生植株的生根和移栽
以湘林4号油茶幼胚和幼胚子叶为外植体,经愈伤组织诱导获得的不定芽用MS培养基添加NAA和IBA进行培养,其生根效果均较好,以NAA 7.0 mg/L的生根最佳,生根率达93.3%,根系粗壮,不定根上无侧根生长,被有白色根毛,不定根细弱,易折断,可能与油茶的遗传特性有关;当NAA和IBA添加浓度大于7.0 mg/L时则抑制生根,并出现叶片发黄枯死现象(毕方铖等,2004);以湘林4号油茶萌发膨大的子叶为外植体诱导愈伤组织则先分化出体细胞胚,再经体细胞胚状体分化不定芽,将不定芽丛生芽以2~3个小芽同愈伤组织一起切下进行生根培养,其生根结果良好。本研究的预试验发现以MS+IBA 5.0 mg/L或MS+NAA 5.0 mg/L均未能诱导生根,但改良MS+IBA 0.5 mg/L+NAA 0.5 mg/L或IBA 5.0 mg/L+NAA 5.0 mg/L能少部分诱导生根,且二者差异不明显;以200.0 mg/L NAA或IBA浸芽基部后在改良MS+IBA 0.5 mg/L+NAA 0.5 mg/L上培养,发现NAA浸芽处理依然未能明显促进不定芽生根,而IBA浸芽处理显著提高不定芽生根率至65.3%,平均每株生根6.7条,平均根长3.2 cm,平均根粗1.6 mm,移栽成活率74.2%。袁德义等(2013)研究表明,华鑫油茶叶片诱导的不定芽,经1000 mg/L IBA浸芽基部处理5 s转入1/2MS空白培养基培养50 d后,其生根率高达88.3%,平均根长3.72 cm,每株平均根数8条,移栽成活率可达82.5%。可見,利用合适植物生长调节剂浸芽处理能显著提高不定芽的生根效果,但存在操作繁琐、易污染及根形态欠佳等缺陷。
为进一步提高不定芽生根效果,本研究将分生结节不定芽接种在1/2改良MS+IBA 0.5 mg/L+NAA 0.5 mg/L无糖蛭石暴露培养,其生根率显著增加至77.8%,根的形态也得到明显改善,白绿色不定根的根粗明显增加,侧根增多,可有效增加根吸收面积,根的质地坚实柔韧不易断,且缩短成苗时间和提高炼苗效率,移栽成活率达91.6%,较IBA浸芽处理的瓶内生根操作更方便,是适合分生结节小苗的最佳生根方法。今后,可通过添加ABT(王以红等,2011;吴幼媚等,2012)等辅助生根剂、优化筛选IBA+NAA复合添加浓度等进一步改良优化以提高生根效率。袁德义等(2013)研究表明,在相同的植物生长调节剂条件下,瓶内生根苗移栽效率高于用扦插专用基质进行瓶外生根。但本研究结果表明,在IBA 0.5 mg/L+NAA 0.5 mg/L条件下,无糖暴露培养生根效果明显优于瓶内生根,主要是瓶内生根的不定根多由植株茎上表皮诱导而来,此时培养基碳源是植株根系碳同化物的主要来源,根系与茎的联系较弱,水分及养分供给不足,故移栽成活率相对较低;而利用组培芽扦插进行无糖暴露试管外假植生根,主要通过内源激素的作用诱导出形态优良的不定根,由组培芽光合作用提供碳源,并通过茎运输到根系,增强根系与茎的联系,不断增强根的适应性,根系活力相对高,移栽成活率明显提高(郭成等,2017)。体细胞胚状体再生组培苗通过主根断根处理,移栽成活高,且新叶长出时间早、新根发根数量多,再次佐证体细胞胚状体发生再生植株的优越性(Ardiyani,2015;Klubicová et al.,2017),今后可进一步改良芽分化培养基,有效提高分生结节途径植株再生效率。
4 结论
以油茶未成熟合子胚为外植体,通过分生结节组织方式增殖,可经体细胞胚状体发生和不定芽发生两种途径成功建立海南油茶未成熟胚分生结节植株再生体系。
参考文献:
毕方铖,谭晓风,张智俊,陈永忠,杨伟. 2004. 油茶离体培养诱导再生植株的研究[J]. 经济林研究,22(2):5-9. [Bi F C,Tan X F,Zhang Z J,Chen Y Z,Yang W. 2004. Study on organogenesis and induction of regeneration plant of Camellia oleifera[J]. Non-wood Forest Research,22(2):5-9.]
蔡玲,王以红,吴幼媚,陈博雯,唐雾. 2012. 油茶胚组织离体培养实验[J]. 西部林业科学,41(3):66-69. [Cai L,Wang Y H,Wu Y M,Chen B W,Tang W. 2012. Study on embryo in-vitro culture of Camellia oleifera[J]. Journal of West China Forestry Science,41(3):66-69.]
丛建民,沈海龙,李玉花,张鹏,杨玲,黄剑. 2012. 水曲柳体胚发生过程中不同状态类型外植体的生理生化状态[J]. 华南农业大学学报,33(1):48-52. [Cong J M,Shen H L,Li Y H,Zhang P,Yang L,Huang J. 2012. Physiological and biochemical status of different-types of explants in somatic embryogenesis of Fraxinus mandshurica[J]. Journal of South China Agricultural University,33(1):48-52.]
龚洪恩,姚小华,吴鹏飞,王开良,叶思诚,程贵文. 2019. LED不同光强对油茶苗生理生化特性的影响[J]. 广西植物, 39(12):1599-1604. [Gong H E,Yao X H,Wu P F,Wang K L,Ye S C,Cheng G W. 2019. Effects of different LED intensities on the physiological and biochemical characteristics of oil-tea camellia seedlings[J]. Guihaia,3(12):1599-1604.]
范曉明,袁德义,谭晓风,曾艳玲,姜志娜. 2011. 油茶优良无性系幼胚和子叶高效再生体系的建立[J]. 湖北农业科学,50(6):1201-1204. [Fan X M,Yuan D Y,Tan X F,Zeng Y L,Jiang Z N. 2011. Establishment of the high effi-ciency regeneration system of Camellia oleifera cotyledon and young embryo[J]. Hubei Agricultural Sciences,50(6):1201-1204.]
郭成,葛红娟,赵玲玲,王成荣,束怀瑞,沙广利,张世忠. 2017. 苹果砧木组培苗生根诱导技术研究[J]. 山东农业科学,49(2):72-75. [Guo C,Ge H J,Zhao L L,Wang C R,Shu H R,Sha G L,Zhang S Z. 2017. Rooting induction technique of apple stock tissue culture plantlets[J]. Shandong Agricultural Sciences,49(2):72-75.]
胡玉玲,姚小华,任华东,王开良,龙伟. 2014. 普通油茶体胚再生体系研究[J]. 南京林业大学学报(自然科学版),38(6):160-164. [Hu Y L,Yao X H,Ren H D,Wang K L,Long W. 2014. Study on somatic embryo genesis regenera-tion system in Camellia oleifera[J]. Journal of Nanjing Forestry University(Natural Sciences Edition),38(6):160-164.]
廉玉姬,林光哲,赵小梅. 2013. 朝鲜白头翁分生结节的诱导与组织解剖学观察[J]. 植物学报,48(5):540-549. [Lian Y J,Lin G Z,Zhao X M. 2013. Histology and development analysis of meristematic nodules from cultured Pu-lsatilla koreana[J]. Chinese Bulletin of Botany,48(5):540-549.]
李泽,谭晓风,袁军,卢锟,张琳,林青,吕佳斌. 2014. 油茶良种‘华硕的组织培养及高效生根[J]. 植物生理学报,50(11):1721-1726. [Li Z,Tan X F,Yuan J,Lu K,Zhang L,Lin Q,Lü J B. 2014. Tissue culture and highly efficient rooting of Camellia oleifera‘Huashuo[J]. Plant Physiology Journa,50(11):1721-1726.]
王睿辉,陈耀锋,梁虹,任惠莉,李春莲. 2002. 胚龄和基因型对小麦幼胚体细胞胚性无性系的诱导[J]. 西北农林科技大学学报(自然科学版),30(4):17-20. [Wang R H,Chen Y F,Liang H,Ren H L,Li C L. 2002. Effect of age of immature embryos and genotypes of donor plant on the high frequency of somaclones induction in wheat (Triticum aestivum L.)[J]. Journal of Northwest SciTech University of Agriculture and Forestry(Natural Science Edition),30(4):17-20.]
王以红,吴幼媚,蔡玲,陈博雯,黄金使. 2011. 油茶岑软3号芽器官离体培养再生植株的研究[J]. 西部林业科学,40(4):1-4. [Wang Y H,Wu Y M,Cai L,Chen B W,Huang J S. 2011. Study on sprout culture in vitro of Camellia oleifera Cenruan 3[J]. Journal of West China Fore-stry Science,40(4):1-4.]
吴幼媚,王以红,蔡玲,陈博雯,陈晓明. 2012. 油茶单芽组培生根研究[J]. 西部林业科学,41(4):25-28. [Wu Y M,Wang Y H,Cai L,Chen B W,Chen X M. 2012. Study on rooting of single buds of Camellia oleifera[J]. Journal of West China Forestry Science,41(4):25-28.]
杨枝林,任华东,曾祥全,陈飞飞. 2017. 海南岛油茶资源果实经济性状评价[J]. 经济林研究,35(4):226-230. [Yang Z L,Ren H D,Zeng X Q,Chen F F. 2017. Friut economic characteristics evaluation of Camellia oleifera resources in Hainan Island[J]. Non-wood Forest Research,35(4):226-230.]
姚小华. 2016. 中国油茶品种志[M]. 北京:中国林业出版社:31-32. [Yao X H. 2016. Oil-tea Camellia cultivars in China[M]. Beijing:China Forestry Publishing House:31-32.]
袁德义,范晓明,谭晓风,曾艳玲,唐静,杨亚. 2013. 油茶带芽茎段及叶片离体培养再生体系的建立[J]. 南京林业大学学报(自然科学版),37(5):35-39. [Yuan D Y,Fan X M,Tan X F,Zeng Y L,Tang J,Yang Y. 2013. Culture in vitro and rapid propagation techniques of buds and leafs in Camellia oleifera[J]. Journal of Nanjing Forestry University (Natural Science Edition),37(5):35-39.]
袁軍,韩志强,贺舍予,黄丽媛,周乃富. 2014. 海南省油茶资源主要形态和经济性状及聚类分析[J]. 植物遗传资源学报,15(6):1380-1384. [Yuan J,Han Z Q,He S Y,Huang L Y,Zhou N F. 2014. Investigation and cluster analysis of main morphological and economical characters for oil tea resource in Hainan Province[J]. Journal of Plant Genetic Resources,15(6):1380-1384.]
张智俊,罗淑萍,李亚玲,毕方铖,谭晓风. 2005. 油茶优良无性系子叶体细胞胚植株再生[J]. 植物学通报,22(S1):43-49. [Zhang Z J,Luo S P,Li Y L,Bi F C,Tan X F. 2005. Plant regeneration through somatic embryogenesis formation from cotyledons of Camellia oleifera clone[J]. Chinese Bulletin of Botany,22(S1):43-49.]
郑道君,潘孝忠,张冬明,谢良商,曾建华,张治礼,叶航. 2016. 海南油茶资源调查与分析[J]. 西北林学院学报,31(1):130-135. [Zheng D J,Pan X Z,Zhang D M,Xie L S,Zeng J H,Zhang Z L,Ye H. 2016. Survey and analy-sis on tea-oil camellia resource in Hainan[J]. Journal of Northwest Forestry University,31(1):130-135.]
钟原,成仿云,秦磊. 2011. 分生结节:一种有价值的植株再生途径[J]. 植物学报,46(3):350-360. [Zhong Y,Cheng F Y,Qin L. 2011. Meristematic nodule:A valuable developmental pathway for plant regeneration[J]. Chinese Bulletin of Botany,46(3):350-360.]
周广振,栾林莉,宋玉凤,吴友根,胡新文,何朝族,陈健妙. 2018. 海南白花油茶花药再生体系的初步建立[J]. 经济林研究,36(1):49-56. [Zhou G Z,Luan L L,Song Y F,Wu Y G,Hu X W,He C Z,Chen J M. 2018. Preliminary establishment of anther regeneration system of white flower Camellia oleifera in Hainan[J]. Non-wood Forest Research,36(1):49-56.]
周开兵,吴友根,符碧海,戴俊,于靖,胡新文. 2016. 越南油茶“琼海优”品系实生选种研究初报[J]. 热带生物学报,7(3):353-357. [Zhou K B,Wu Y G,Fu B H,Dai J,Yu J,Hu X W. 2016. Selection of clones Qinghaiyou series from seedling individuals of Camellia vietnamensis T. C. Huang ex Hu[J]. Journal of Tropical Biology,7(3):353-357.]
周增亮,胡冬南,刘爽,刘娟. 2019. 油茶研究文献计量分析[J]. 经济林研究,37(2):204-214. [Zhou Z L,Hu D N,Liu S,Liu J. 2019. Bibliometric analysis on Camellia oleifera literature[J]. Non-wood Forest Research,37(2):204-214.]
庄瑞林. 2008. 中国油茶[M]. 北京:中国林业出版社:9-11. [Zhuang R L. 2008. Chinese Camellia[M]. Beijing:China Forestry Publishing House:9-11.]
Ardiyani F. 2015. Morphological characterization and identification of Coffea liberica callus of somatic embryogenesis propagation[J]. Pelita Perkebunan,31(2):81-89.
Klubicová K,Uvácková L,Danchenko M,Nemecek P,Skultéty L,Salaj J,Salaj T. 2017. Insights into the early stage of Pinus nigra Arn. somatic embryo genesis using discovery proteomics[J]. Journal of Proteomics,169:99-111.
Song D P,Feng L,Rana M M,Gao M J,Wei S. 2014. Effects of catechins on Agrobacterium-mediated genetic transformation of Camellia sinensis[J]. Plant Cell,Tissue and Organ Culture,119(1):27-37.
Xie Y Z,Ge S B,Jiang S C,Liu Z L,Chen L,Wang L S,Chen J T,Qin L C,Peng W X. 2018. Study on biomolecules in extractives of Camellia oleifera fruit shell by GC-MS[J]. Saudi Journal of Biological Sciences,25(2):234-236.
Yu J X,Wu Y,He Z,Li M,Zhu K M,Gao B D. 2018. Diversity and antifungal activity of endophytic fungi associa-ted with Camellia oleifera[J]. Mycobiology,46(2):85-91.
(責任编辑 兰宗宝)
