不同细胞数的卵裂期胚胎囊胚培养及冻融后单囊胚移植结局
2020-06-03戢开丽黎淑贞娄娟李云郭江华
戢开丽 黎淑贞 娄娟 李云 郭江华

【摘 要】 目的:探索卵裂期胚胎細胞数对囊胚发育的影响,以及对冻融后单囊胚移植结局的影响。方法:回顾性选择D3胚胎评分A和B级5754枚行囊胚培养的胚胎,分为三组:A组7~9细胞;B组≥10细胞;C组4~6细胞。比较三组的囊胚培养情况。选择177个单囊胚解冻移植周期,按照囊胚来源的D3胚胎评分A和B级分为两组:A组7~9细胞和B组≥10细胞,比较冻融后单囊胚移植的结局。结果:三组胚胎囊胚培养结局比较,囊胚形成率、优质囊胚率、D5囊胚形成率和D5优质囊胚率差异极显著(P<0.01),但B组与A组比较,囊胚形成率、优质囊胚率差异不显著(P>0.05),D5囊胚形成率差异极显著(P<0.01),D5优质囊胚率差异显著(P<0.05)。冻融后单囊胚移植,两组D5囊胚比率和临床妊娠率差异不显著(P>0.05),但两组女方年龄差异极显著(P<0.01)。结论:在排除碎片的影响后,囊胚发育与D3胚胎细胞数有关,4~6细胞的囊胚形成率最低,而≥10细胞与7~9细胞相比则无差异;冻融后单囊胚移植虽然≥10细胞与7~9细胞比较临床妊娠率无显著差别,但未排除女方年龄的差异。
【关键词】 体外受精;囊胚培养;D3胚胎评分;细胞数;单囊胚移植
Blastocyst culture of different cell number from cleavage embryos and pregnancy outcome of their single frozen-thawed blastocyst
Ji Kaili, Li Shuzhen, Lou Juan, Li Yun, Guo Jianghua
Center for Assisted Reproduction, Jiangmen Central Hospital, Jiangmen, Guangdong 529030
[Abstract] Objective:To investigate the influence of cell number from cleavage embryos for blastocyst development, and to know pregnancy outcome of their single frozen-thawed blastocyst. Methods: This study retrospectively analyzed 5754 embryos for blastocyst culture were classified into three groups from cell number of day 3 (D3) cleavage embryo scoring grade A and grade B:7~9 cells in A group; ≥10 cells in B group; 4~6 cell in C group. Then blastula formation was compared among the three groups. And according to cell number of D3 cleavage embryo, 177 cycles frozen embryo transfer(FET) of single blastocyst from were classified two groups: 7~9 cells in A group and ≥10 cells in B group. Then pregnancy outcome was compared between the two groups. Results: There was extremely significant difference in blastocyst formation rate, high-quality blastocyst rate, day 5 (D5) blastocyst formation rate, and D5 high-quality blastocyst rate among three groups (P<0.01), but no difference in blastocyst formation rate and high-quality blastocyst rate, and greater difference in D5 blastocyst formation rate and significant difference in D5 high-quality blastocyst rate between B group and A group. Moreover, clinical pregnancy and D5 blastocyst rate of single blastocyst on FET had no difference between A group and B group, but female age was greater different. Conclusion: Minimizing the impact of embryonic fragmentation, there was some correlation between blastocyst development and cell number of D3 embryo, blastocyst formation rate was lowest from 4~6 cells. There was no difference in blastocyst formation rate between ≥10 cells and 7~9 cells. Clinical pregnancy of single blastocyst on FET had no significant difference between ≥10 cells and 7~9 cells, but no excluding female age factor.
[Key words]In Vitro Fertilization; Blastocyst culture; D3 embryo scoring; Cell number; Single blastocyst transfer
2011年Istanbul共识[1]和2018年中华医学会生殖医学会《胚胎实验室关键指标质控专家共识》[2]指出,D3优质胚胎定义为来源于正常受精卵,且受精后第3天胚胎细胞数为7~9个、细胞大小符合发育阶段、碎片程度小于10%、无多核化的胚胎。胚胎发育过快过慢都可能导致胚胎染色体异常发生率增加[3]。但一些报道显示[4],D3胚胎细胞数越多,胚胎发育速度越快,优质囊胚形成率越高。
本中心的D3胚胎评分是依据胚胎的对称性、无核碎片的比例,将胚胎评级为:A(等大,碎片≤5%)、B(不等大、无碎片或等大、碎片≤25%)、C(等大或不等大、碎片≤50%)、D(碎片>50%),同时记录胚胎的卵裂球细胞数。其中7~9细胞A和B级为优质胚胎,D级和≤5细胞数C级胚胎为不可用胚胎。由于少量的碎片不影响发育,可能裂解或吸收,在发育中消失掉[5]。而当卵裂球胚胎碎片>25%时,很少有胚胎发育到囊胚[6]。尹太郎等[7]认为碎片率、卵裂球细胞数与囊胚培养的结局密切相关,在影响囊胚形成的作用上,当碎片率<20%时,卵裂球细胞数效应相对较大,而当碎片率>20%时,碎片的影响效应可能更大。故本文选择D3评分为A、B级(碎片≤25%)胚胎,尽量消除碎片影响,从而了解不同细胞数卵裂期胚胎的囊胚培养情况,以及不同细胞数卵裂其胚胎来源的单囊胚解冻后移植结局。
1 资料与方法
1.1 对象与分组
选择江门市中心医院生殖中心2016年1月至2018年12月女方年龄≤38岁、进行囊胚培养的784对辅助生殖治疗不孕夫妇。按照D3胚胎评分分为三组:A组7~9细胞A和B级胚胎共3723枚;B组≥10细胞A和B级胚胎共954枚;C组4~6细胞A和B级胚胎共1077枚。其中C和D级以及融合(Compact)胚胎未纳入。
选择2017年1月至2018年11月女方年龄≤38岁177个单囊胚解冻后移植周期。按照囊胚来源的D3胚胎评分分为两组:A组7~9细胞A和B级胚胎134周期;B组≥10细胞A和B级胚胎43周期。4~6细胞A和B级胚胎只有12周期,未纳入分析。
1.2 方法
1)体外受精和胚胎培养促排卵采用短效长方案、卵泡期长方案、拮抗剂方案等,卵泡发育成熟后,注射HCG 5000~10000IU,于35~36h在超声引导下经阴道穿刺取卵。
禁欲2~7d,手淫法获取精液,采用梯度离心后上游或直接离心后上游方法处理后行常规体外受精(IVF)或胞浆内单精子注射(ICSI)。IVF 3~4h去除颗粒细胞或ICSI结束转移到平衡好的卵裂期胚胎培养液中,置于6%CO2、5%O2、37℃培养箱培养;D3移植或冷冻2枚卵裂期胚胎后剩余胚胎行囊胚培养,转移到过夜平衡的囊胚液中。试剂采用Quinns Advantage序贯培养基(SAGE,美国),卵裂期胚胎培养液为1026,囊胚期胚胎培养液为1029。
2)胚胎评分D3卵裂期胚胎根据卵裂球大小均匀及碎片等情况评估胚胎质量:A(等大,碎片≤5%)、B(不等大、无碎片或等大、碎片≤25%)、C(等大或不等大、碎片≤50%)、D(碎片>50%),同时记录胚胎的卵裂球细胞数,如8A,表示卵裂球细胞数为8个,等大且碎片≤5%。其中7~9细胞A和B级为优质胚胎,D级和≤5细胞数C级胚胎为不可用胚胎。
D5/D6囊胚期胚胎评分采用Gandner评分法,根据囊胚发育阶段、内细胞团和滋养层细胞的数量及排列的综合情况来对囊胚的质量进行评定。按照囊胚腔的扩张程度分为1~6期,将2期及2期以上囊胚纳入囊胚形成率的计算;按照内细胞团大小分A、B、C级;按照滋养层细胞数量的多少分为A、B、C级。如4AA表示扩张期囊胚,内细胞团数目多,排列紧密,滋养层细胞数目较多,结构致密。其中D5和D6 3BC或3CB以上的囊胚为可用囊胚,D5 3BB以上或D6 4BB以上的囊胚为优质囊胚。囊胚形成率为D5和D6形成的2期以上囊胚总数与培养卵裂期胚胎数之比,优质囊胚率=优质囊胚数/形成的囊胚总数。
3)冻融后单囊胚移植囊胚冻融按照加藤试剂(Kitazato,日本)说明书操作,采用玻璃化冷冻技术:冷冻时在ES液平衡12~15min后,转VS液于60s内装入载杆投到液氮中;解冻时从液氮中取出迅速投到TS液,1min后转入DS液,3min后转入WS1和WS2分别3min和1min,解凍结束后放在平衡好的1029中培养2h再移植。
胚胎移植后10d查血β-HCG,4~5周后B超检查,见孕囊和胎心,且胎心有博动的为临床妊娠。
1.3 统计学方法
用SPSS 19.0软件对数据进行χ2检验和t检验,P<0.05表示差异显著,有统计学意义。
2 结果
2.1 不同细胞数卵裂期胚胎囊胚培养情况比较
从表1可以看出三组不同细胞数卵裂期胚胎行囊胚培养在囊胚形成率(78.8%,77.3%和46.1%)、优质囊胚率(44.8%,44.8%和26.0%)、D5囊胚形成率(51.2%,58.8%和17.7%)、D5优质囊胚率(45.4%,50.8%和27.7%)差异都极显著(P<0.01),其中C组4~6细胞卵裂期囊胚培养情况最差,囊胚形成率、优质囊胚率、D5囊胚形成率和D5优质囊胚率都明显低于A组7~9细胞和B组≥10细胞。
B组与A组比较,其囊胚形成率(77.3% vs 78.8%)和优质囊胚率(44.8% vs 44.8%)差异不显著(P>0.05),而D5囊胚形成率(58.8% vs 51.2%)差异极显著(P<0.01),D5优质囊胚率(50.8% vs 45.4%)差异显著(P<0.05),B组D5囊胚形成率和D5优质囊胚率均比A组高,说明B组胚胎发育快,在D5更快形成囊胚以及更容易形成优质囊胚。
C组与A组比较,囊胚形成率、优质囊胚率、D5囊胚形成率和D5优质囊胚率都差异极显著(P<0.01)。
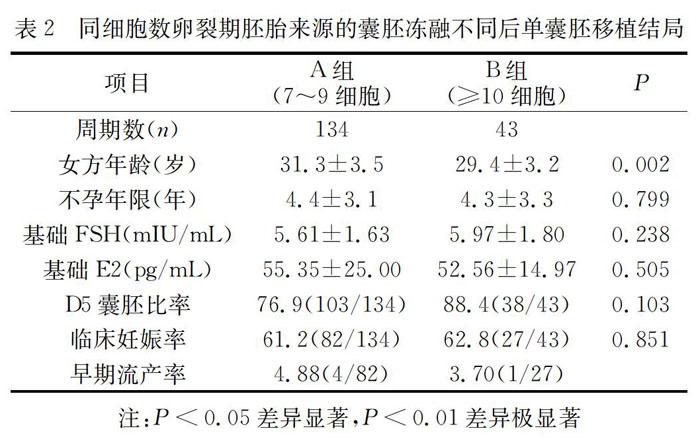
2.2 不同细胞数卵裂球胚胎来源的囊胚冻融不同后单囊胚移植结局
从表2可以看出A组7~9细胞和B组≥10细胞的不孕年限、基础FSH和基础E2差异不显著(P>0.05),但两组的女方年龄差异极显著(P<0.01)。两组D5囊胚比率(76.9% vs 88.4%)和临床妊娠率(61.2% vs 62.8%)差异也不显著(P>0.05)。由于未能排除女方年龄因素的影响,不能确定是否两组临床结局是否一致。
另外因为数据来源截至2018年11月,有些早期流產情况还可能发生,故两组的早期流产未做比较,仅供参考。
3 讨论
在辅助生殖助孕治疗中,囊胚更适合子宫环境,移植囊胚可获得更高的妊娠率,而且囊胚培养能够实现对胚胎的进一步筛选和修复,其非整倍体率明显下降,有利于挑选更具发育潜力的胚胎。影响囊胚形成的因素很多,如患者年龄[8]、原核数目情况[9-10]、卵裂期胚胎质量[11-12]、不同的授精方式[12-13]和囊胚培养体系等。目前仍没有准确的指标预测囊胚培养的结局[14],囊胚形成率从0%~100%都有可能。D3胚胎质量与囊胚形成的关系不是绝对相吻合的,Istanbul共识[1]和中华医学会生殖医学会专家共识[2]将D3优质胚胎定义为D3胚胎细胞数为7~9个。因为如Magli等[3]研究的结果显示,D3胚胎7~8细胞染色体异常率50%最低,与5~6细胞73%、≥9细胞78%比较差异显著,胚胎发育过慢或过快,染色体异常率都高于卵裂球细胞数8个的胚胎,染色体异常率高会影响囊胚形成。另外碎片也影响胚胎染色体,随着碎片含量的增加,染色体异常率也增加。Hardy等[6]认为当D3胚胎碎片>25%,就很少有胚胎能发育到囊胚。故本文选择D3评分碎片≤25%的A和B级胚胎,尽可能消除碎片对囊胚发育的影响,找出D3胚胎细胞数对囊胚发育的差别。
本文研究结果显示,排除碎片的影响后,D3胚胎细胞数不同对囊胚形成有影响,囊胚形成率4~6细胞46.1%最低,与另外两组比较差异极显著。但与7~9细胞的囊胚形成率78.8%和优质囊胚率44.8%比较,≥10细胞分别是77.3%和44.8%,差异不显著。而D5囊胚形成率和D5优质囊胚率,≥10细胞比7~9细胞更高,分别是58.8%和51.2%,50.8%和45.4%。≥10细胞胚胎发育快,在D5更快形成囊胚以及更容易形成优质囊胚。这个结果与多篇报道类似。Wang等[15]认为D3胚胎的囊胚形成率7~9卵裂球显著高于≤6卵裂球,与≥10卵裂球差异不显著。Langley等[16]研究发现囊胚形成率与D3胚胎细胞数有一定的关系,在自体IVF周期中6细胞和8细胞的囊胚形成率分别是54.1%和75.6%,差异显著;≥10细胞的囊胚形成率是69.5%与8细胞比较,差异不显著。来自供体IVF周期,6细胞和8细胞的囊胚形成率同样差异显著,≥10细胞与8细胞几乎差不多分别是89.2%和89.5%。尹太郎等[7]认为当碎片率≤20%时,卵裂球细胞数效应相对囊胚形成影响较大,碎片率<5%时,>8细胞胚胎与8细胞囊胚形成率及优质囊胚率无显著差异;6%≤碎片率≤20%时,>8细胞胚胎囊胚形成率和优质囊胚率显著高于与8细胞。严凤英等[17]研究结果显示,D3≥10个细胞的优质囊胚形成率为38.9%,7~9个细胞43.1%,比较无显著差异(P>0.05);7~9个细胞的优质囊胚形成率为43.1%,显著高于4~6个细胞10.2%。
为进一步验证D3不同细胞数来源的单囊胚移植的临床结局是否有差异,本文还选取了冻融后单囊胚移植比较囊胚来源D3 7~9细胞和≥10细胞的临床结局,结果显示≥10细胞的临床妊娠率62.8%与7~9细胞61.2%差异不显著,但是受到样本数的影响,≥10细胞仅43周期,未能排除女方年龄差异的因素[≥10细胞(29.4±3.2)岁] vs [7~9细胞(31.3±3.5)岁](P<0.01)。因此不足以说明7~9细胞和≥10细胞来源的冻融后单囊胚临床结局一致,但≥10细胞单囊胚移植的临床妊娠率达到62.8%,也说明≥10细胞的D3胚胎临床价值较高。
综上所述,在降低碎片的影响后,可见囊胚形成与D3胚胎细胞数有很大的关系,细胞数低(4~6细胞)囊胚形成率最低,但7~9细胞与≥10细胞却无差异,甚至≥10细胞的D5囊胚形成情况更好。从冻融后单囊胚的结局看,≥10细胞的临床妊娠率与7~9细胞也差异不显著,虽然没有排除年龄差异的影响,但是≥10细胞单囊胚移植(平均年龄29.4岁)的临床妊娠率62.8%也是较高水平。另外随着冻融单囊胚移植周期的增加,还需进一步分析其流产率、活产率等妊娠结局,以确定≥10细胞低碎片的胚胎的价值是否与7~9细胞优质胚胎相当。故建议D3胚胎评分时进一步细化细胞数,或放宽优质胚胎仅限定于7~9细胞,能够更加合理地选择移植或冷冻的胚胎,防止在临床应用时受冷冻费带来经济原因限制而丢弃了价值较高的≥10细胞低碎片的胚胎。
参考文献
[1] Alpha Scientists in Reproductive Medicine and ESHRE Special Interest Group of Embryology.Anonymous.The Istanbul consensus workshop on embryo assessment:proceedings of an expert meeting[J].Hum Reprod,2011,26(06):1270-1283.
[2] 中华医学会生殖医学分会第四届委员会.胚胎实验室关键指标质控专家共识[J].生殖医学杂志,2018,27(09):836-851.
[3] Magli M C,Gianaroli L,Ferraretti A P,et al.Embryo morphology and development are dependent on the chromosomal complement[J].Fertil Steril,2007,87(03):534-541.
[4] Racowsky C,Jackson K V,Cekleniak NA,et al.The number of 8-cell embryos is a key determinant for selecting day 3 or day 5 transfer[J].Fertil Steril,2000,(73):558-564.
[5] 孙正怡,甄璟然,王雪,等.囊胚培养的利与弊[J].发育医学电子杂志,2015,(01):14-17.
[6] Hardy K,Stark J,Winston RM.Maintenance of the inner cell mass in human blastocysts from fragmented embryos[J].Biol Reprod,2003,68(04):1165-1169.
[7] 尹太郎,丁锦丽,兖娜娜,等.胚胎碎片对囊胚形成结局的影响[J].医学分子生物学杂志,2017,14(06):332-336.
[8] Yin H,Jiang H,He R,et al.The effects of fertilization mode,embryo morphology at day 3,and female age on blastocyst formation and the clinical outcomes[J].Syst Biol Reprod Med,2015,61(01):50-56.
[9] 尹太郎,丁錦丽,兖娜娜,等.姐妹胚胎单囊胚结局的影响因素分析[J].医学分子生物学杂志,2017,14(05):263-267.
[10]徐士儒,李观贵,熊风,等.授精方式对不同原核数目及D3评级胚胎继续发育能力的影响[J].生殖医学杂志,2018,27(08):750-756.
[11]Fisch J D,Rodriguez H,Ross R,et al.The Graduated Embryo Score(GES)predicts blastocyst formation and pregnancy rate from cleavage-stage embryos[J].Hum Reprod,2001,16(09):1970-1975.
[12]Neuber E,Rinaudo P,Trimarchi JR,et al.Sequential assessment of individually cultured human embryos as an indicator of subsequent good embryo quality blastocyst development[J].Hum Reprod,2003,(18):1307-1312.
[13]薛侠,张四林,施文浩,等.不同授精方式的选择性单囊胚移植的妊娠结局分析[J].生殖医学杂志,2014,23(09):760-762.
[14]Practice Committee of the American Society for Reproductive Medicine.Blastocyst culture and transfer in clinically assisted reproduction:a committee opinion[J].Fertil Steril,2018,110(07):1246-1252.
[15]Wang F,Kong H J,Kan Q C,et al.Analysis of blastocyst culture of discarded embryos and its significance for establishing human embryonic stem cell lines[J].J Cell Biochem,2012,113(12):3835-3842.
[16]Langley M T,Marek D M,Gardner DK,et al.Extended embryo culture in human assisted reproduction treatments[J].Hum Reprod,2001,16.
[17]严凤英,李晓洁,吕群,等.体外受精优质囊胚培养与D2D3胚胎卵裂球数及碎片评级的相关性[J].实用临床医药杂志,2014,(17):70-72.
