精子形态联合精子核DNA在试管婴儿周期治疗中的预测价值
2022-07-15张杰夏乐莎胡红林彭璇吴成亮陈亚强李霞
张杰 夏乐莎 胡红林 彭璇 吴成亮 陈亚强 李霞

[摘要] 目的 探讨精子形态联合精子DNA碎片率(DFI)對体外受精-胚胎移植临床结局的影响。方法 选取2020年1月~2021年8月在江西省九江市妇幼保健院生殖中心实施IVF-ET治疗的231例IVF新鲜治疗周期,取卵当日对精液标本进行精子形态及DNA完整性检测。依据精子形态分为正常组164例及畸形精子组67例,纳入精子DFI后分为A组(MNS≥4%且DFI<30%)、B组(MNS≥4%且DFI≥30%)、C组(MNS<4%且DFI<30%)和D组(MNS<4%且DFI≥30%),对比各组间受精率、2PN卵裂率、优胚率、临床妊娠率、早期流产率的差异;比较DFI与男方年龄、精液参数间的相关性。结果 正常形态组总受精率、2PN受精率显著高于畸形精子组(P<0.001),2PN卵裂率、优胚率、临床妊娠率、早期流产率在不同形态组间比较,差异均无统计学意义(均P>0.05);纳入精子DFI后,C、D两组的总受精率、2PN受精率显著低于A、B两组,D组2PN卵裂率显著低于A、C两组,B组、D组优质胚胎率显著低于A组、C组,B组临床妊娠率明显低于A组(P<0.0083);DFI与年龄及其他精液参数的相关性分析中,DFI与男性年龄呈显著正相关,与前向运动精子率呈显著负相关(P=0.002,0.001)。 结论 精子核DNA联合精子形态评估能为IVF-ET的治疗结局带来更为高效准确的预测价值,值得在临床上推广应用;同时在IVF-ET的治疗中,也要关切男方年龄,避免高龄带来的诸多不利影响。
[关键词] 精子形态;精子DNA;体外受精-胚胎移植;预测价值
[中图分类号] R714.8 [文献标识码] A [文章编号] 1673-9701(2022)16-0015-07
Predictive value of sperm morphology combined with sperm nuclear DNA in IVF cycle therapy
ZHANG Jie1 XIA Lesha1 HU Honglin2 Peng Xuan1 WU Chengliang1 CHEN Yaqiang1 LI Xia1
1.Department of Assisted Reproduction,Jiujiang Maternal and Child Health Care in Jiangxi Province,Jiujiang 332000,China;2.Department of Urology Surgery, the Second Affiliated Hospital of Nachang University, Nanchang 330000, China
[Abstract] Objective To investigate the effect of sperm morphology combined with sperm DNA fragmentation index (sperm DNA fragmentation index,DFI) on clinical outcomes of in vitro fertilization and embryo transfer (in vitro fertilization and embryo transfe,IVF-ET). Methods A total of 231 IVF fresh cycles were selected from January 2020 to August 2021 in the reproductive center of our hospital, the sperm morphology and the integrity of sperm nuclear DNA were detected on the day of egg collection. According to the normal morphology sperm percentage is divided into 164 cases of normal group and teratozoospermia group, after the inclusion of sperm DFI, they were divided into group A(MNS≥4%且DFI<30%),group B(MNS≥4%且DFI≥30%), group C(MNS<4%且DFI<30%), group D(MNS<4%且DFI≥30%). The differences of fertilization rates,zygote transgene rates, optimal embryo rates,clinical pregnancy rate, early abortion rate among the groups were compared. To compare the correlation of DFI with male and semen parameters. Results The total fertilization rate and two pronuclei (two pronucle,2PN) fertilization rate in normal sperm morphology group were significantly higher than those in teratozoospermia group (all P<0.001). There were no statistical differences in zygote transgene rates, optimal embryo rates, clinical pregnancy rate and early abortion rate between two groups (P>0.05). After the inclusion of sperm DFI, the fertilization rate and 2PN fertilization rate in group C and D were significantly lower than those in group A and B, the zygote transgene rate in group D was significantly lower than that in group A and C, the optimal embryo rates in group B and D was significantly lower than that in group A and C,and the clinical pregnancy rate in group B was significantly lower than that in group A (P<0.0083). In the correlation analysis of DFI with age and the other semen parameters, DFI was significantly positively correlated with male age, and significantly negatively correlated with forward motility sperm rate(P=0.002,0.001). Conclusion Sperm DNA combined with sperm morphology assessment can bring more efficient and accurate predictive value for the treatment outcome of IVF-ET,which is worthy of clinical promotion and application.At the same time,in the treatment of IVF,we should concern about the age of the man, to avoid the many adverse effects of advanced age.
[Key words] Sperm morphology; Sperm DNA; In vitro fertilization-embryo transfer; Predictive value
目前全球不孕人群约占15%~20%,男性不育症的发生率每年增加0.291%[1~3]。在中国,随着生活节奏的加快和生育年龄推迟等因素的影响,不孕不育的发生率已接近25%[4]。在不孕症高发的背景下,越来越多的人选择体外受精-胚胎移植(in vitro fertilization and embryo transfer,IVF-ET)术。虽然IVF-ET治疗的平均成功率已达40%~50%,但仍有不少夫妇在治疗中出现妊娠失败、胎停等不良妊娠结局[5,6]。考虑到IVF-ET治疗成本较高及治疗失败产生的负面影响,研究IVF-ET治疗结局的相关影响因素是必要的。
精子质量在IVF-ET中起到关键作用,过去常认为严格的精子形态是预测IVF治疗结局的良好因子[7~9],但近年来许多研究[10~12]对此观点提出挑战。随着精子DNA碎片率(DNA fragmentation index,DFI)对生殖中的作用愈发被重视,越来越多的研究表明DFI在胚胎发育及妊娠结局有更好的预测价值[13~15]。本研究旨在探讨精子形态联合精子核DNA对IVF-ET治疗结局的影响,评估两者联用的价值,现报道如下。
1 资料与方法
1.1 一般资料
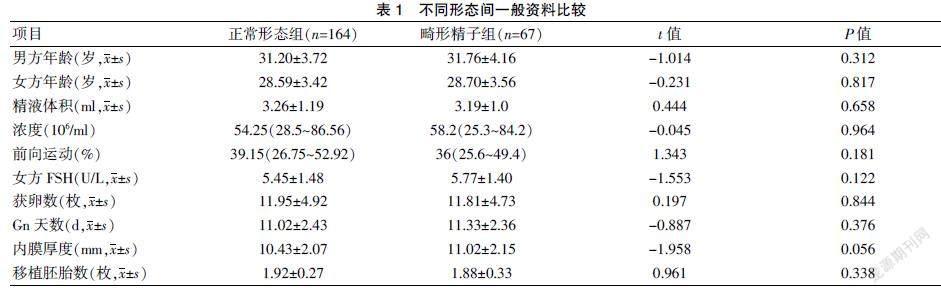
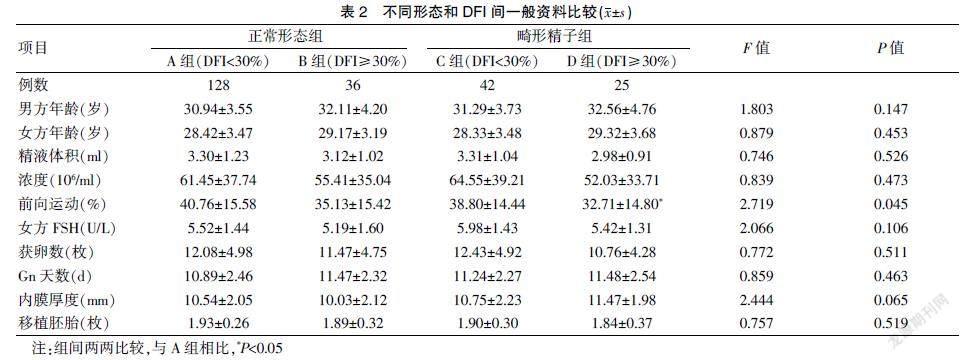
选取2020年1月~2021年8月在江西省九江市妇幼保健院生殖中心实施IVF-ET治疗的354例新鲜周期,其中123例因女方临床因素(如预防卵巢过度刺激综合征、无可移植胚胎、内膜异常、扳机日孕酮水平升高等)及其他因素取消移植。根据《WHO人类精液检查与处理实验室手册》第5版及相关染色法的诊断标准,将正常形态精子数<4%定义为畸形精子症,精子DNA碎片指数≥30%为精子DNA损伤。纳入标准:①移植胚胎数≥1枚;②女方≤35岁,卵巢功能正常,获卵数≥5个;③取卵当日精液标本完整且体积≥1.5 ml。排除标准:①女方生殖内分泌代谢疾病、内膜异位症等;②男方代谢性疾病,内分泌异常,严重少弱精或无精子症;③ 双方染色体异常等;④因女方临床因素或其他因素放弃移植胚胎者。术中所有耗材均来自相同的供应商,资质合格。患者均签署IVF-ET相关治疗的知情同意书。共计231例周期符合入选条件和排除标准,按正常形态精子(normal morphology sperm,MNS)百分率分为精子形态正常组164例(MNS≥4%)及畸形精子组67例(MNS<4%);在精子形态队列中依据不同精子DNA碎片指数分为A组(MNS≥4%且DFI<30%)128例、B组(MNS≥4%且DFI≥30%)36例、C组(MNS<4%且DFI<30%)42例及D组(MNS<4%且DFI≥30%)25例。不同形态组间在精液参数、年龄、女性FSH、获卵数等基础资料上的分布比较,差异无统计学意义(P>0.05),具有可比性;纳入DFI后,D组的平均前向运动精子百分率(32.71±14.80)%显著低于A组(40.76±15.58)%(P=0.045),其余项目比较,差异无统计学意义(P>0.05)。见表1~2。
1.2 方法
1.2.1 精液常規检测 按《WHO人类精液检查与处理实验室手册》第五版标准对精液体积、精子浓度、前向运动精子率等参数进行检测。
1.2.2 精子形态检测 精子形态检测采用Diff-Quick法,试剂盒由天津瑞爱金生物科技有限公司生产。方法如下:①取5~20 μl精液于玻片上,推片制成薄片;②甲醇缓冲液覆盖组织玻片固定15 s,伊红和天蓝染液分别染色15 s,再用流水轻轻浸洗组织玻片10~15次待其干燥;③ 将精子顶体区、尾部染成不同颜色后进行结果判读,连续计数大于200个精子。
1.2.3 精子DFI检测 精子DNA碎片指数检测采用精子染色质扩散法(sperm chromatin dispersion,SCD),试剂盒由深圳华康生物医学工程有限公司生产。方法如下:①将含有琼脂糖凝胶的琼脂糖管放入90~100℃水中溶解后置于37℃待用,提取60 μl的精液标本与溶解后的琼脂糖凝胶均匀混合;②取30 μl上述混悬液覆盖于载玻片后置于冰箱冷藏4 min,将标本浸入浓缩变性液中反应7 min,放入裂解液中反应20 min;③ 洗涤后依次放入70%、90%、无水乙醇溶液中脱水2 min,用配置好的染液进行染色,最后在200倍光镜下观察记录。
1.2.4 控制性超排卵与获卵 促排卵采用垂体降调节方案,月经周期第2天皮下注射亮丙瑞林(丽珠制药有限公司,国药准字H20093852,规格:3.75 mg)3.75 mg,28~30 d返院达到降调节标准后予果纳芬(默克雪兰诺公司,注册证号:S20080030,规格:75 IU)、普丽康(默沙东公司,注册证号S20181012,规格:100 IU)等促排卵药物诱导卵泡发育。当1~2个主导卵泡直径达到18~20 mm或2~3个卵泡直径达到17 mm以上,予注射用绒促性素(丽珠制药有限公司,国药准字H44020673,规格:2000 U)6000~10 000 IU肌注,36~37 h后在超声引导下经阴道穿刺取卵。
1.2.5 体外授精与胚胎评估 取卵后2~4 h将卵冠丘复合体加入含精子浓度为50 000条/ml的受精滴中,培养14~18 h观察受精情况,受精后第3天根据卵裂球数目、形态、空泡及碎片多少对胚胎等级进行评分,其中发育6细胞以上的1级和2级胚胎为优质胚胎[16,17]。
1.2.6 胚胎移植及随访 取卵后3 d行卵裂胚胎移植,每周期移植胚胎≤2个,移植后给予地屈孕酮片(荷兰苏威制药有限公司,注册证号:H20170221,规格10 mg)40 mg/d进行黄体支持。移植14 d后测血清绒毛膜促性腺激素(serum chorionic gonadotropin,HCG),阳性者为生化妊娠;移植后28 d行B超检查,见孕囊及胎心搏动为临床妊娠;12周之前经B超证实妊娠丢失为早期流产。
1.3 观察指标
受精率=受精卵子数/获卵数×100%;卵裂率=2PN卵裂数/受精卵数×100%;优胚率=优质胚胎数/2PN卵裂数×100%;临床妊娠率=临床妊娠数/移植周期数×100%;早期流产率=早期流产数/临床妊娠数×100%。
1.4 统计学方法
本研究采用SPSS 25.0统计学软件进行分析,计量资料符合正态分布用(x±s)表示,若不符合用中位数表示,两组变量对比采用独立样本t检验,多组间变量对比用单因素方差分析α为0.05;计数资料用[n(%)]表示,采用χ2检验,检验水准α为0.05,组间多重比较采用χ2检验后的Bonferroni校正法,校正后的检验水准为0.0083。精子DFI与男方年龄及其他精液参数间的相关性采用多元线性回归分析。
2 结果
2.1 受精、胚胎情况比较
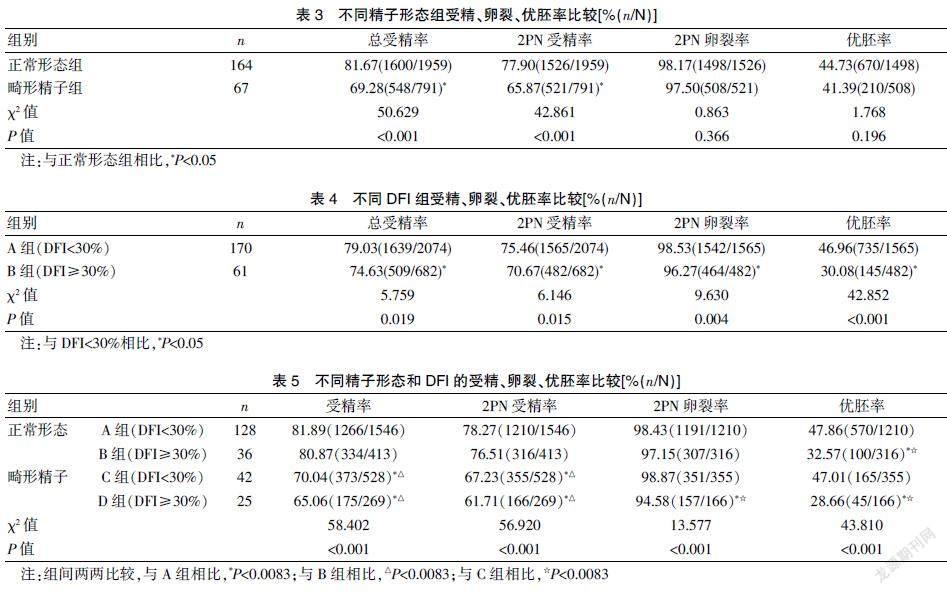
不同形态组间的总受精率与两原核(two pronuclei,2PN)受精率比较,差异有统计学意义(P<0.001),2PN卵裂率、优胚率间比较,差异无统计学意义(P>0.05);与DFI<30%相比,DFI≥30%组的受精率、2PN卵裂率及优胚率均显著降低;纳入DFI后,C、D组的总受精率、2PN受精率显著低于A、B组(均P<0.0083),D组2PN卵裂率(94.58%)显著低于A组(98.43%)、C组(98.87%),B、D组的优质胚胎率(32.57%、28.66%)显著低于A、C组(47.86%,47.01%),差异有统计学意义(均P<0.0083)。见表3~5。
2.3 妊娠结局比较
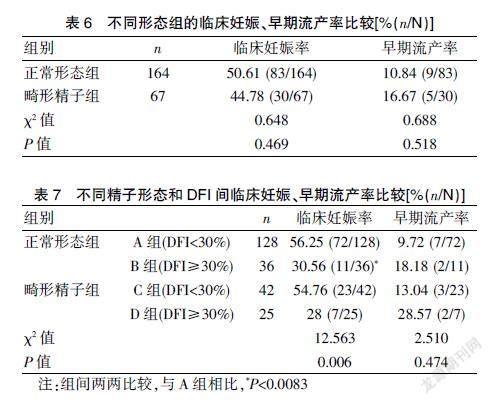
正常形态组临床妊娠率、早期流产率分别为50.61%,10.84%,畸形精子组分别为44.78%,16.67%,临床妊娠率、早期流产率在不同形态组间比较,差异无统计学意义(P>0.05);纳入DFI后临床妊娠率在各组间比较,差异有统计学意义(P=0.006),组间两两对比发现B组临床妊娠率(32.57%)明显低于A组(56.25%)(P=0.008);早期流产率方面,尽管D组流产率最高,但由于样本量小,组间比较,差异无统计学意义(P=0.474)。见表6~7。
2.4 精子DFI与年龄及精液参数的多元线性回归分析
DFI与男性年龄呈显著正相关(t=3.087,P=0.002),与前向运动精子呈显著负相关(t=-5.319,P=0.001),与精液体积、精子浓度、正常精子形态无关(均P>0.05)。见表8、图1。
3 讨论
精子形态在自然妊娠及辅助生殖技术(assisted reproductive technology,ART)治疗中起着十分重要的作用,在精子生成与成熟的诸多程序中如果发生异常有可能产生大量的畸形精子,这些畸形精子可能存在某些结构或超微结构的异常而导致精子功能缺陷。卵子受精前,精子需要与卵子透明带进行识别固定,卵细胞透明带上存在着透明带区糖蛋白3(zona pellucida glycoproten 3,ZP3),而精子头部膜表面有着与其相应的结合蛋白受体mZP3,头部形态异常可能使mZP3的功能结构发生改变,从而影响精卵识别而导致卵子不受精[18,19]。此外,精子顶体覆盖于细胞核前,内部含有多种特殊的溶酶体,在精子穿越卵细胞表面的颗粒层、透明带及卵细胞膜中发挥重要作用,而拥有正常形态的顶体是发生顶体反应和受精的重要前提[20,21]。
虽然精子形态对受精有很强的预测作用,但对随后的妊娠结局影响有限。近年来,精子DNA完整性在生殖中的影响愈发受到重视。在受孕过程中,精子细胞核作为一种载体将父系的遗传信息转移入卵母细胞中,配子DNA通过整合重组传给子代。胚胎的持续发育依赖于遗传物质的完整性,精子核DNA损伤会使遗传物质在重组过程中发生密码子的错误读取而致基因突变,从而增加胚胎染色体的异常率,最终造成不良的妊娠结局。精子DNA的损伤贯穿于精子发生、成熟及随后的整个过程,理化、生物等因素可造成精子核DNA单链、双链断裂和染色体结构发生改变,使DNA完整性受損,精子本身并不具备修复损伤的能力,任何形式的DNA损伤都可能影响遗传物质的重组及相关基因、蛋白的正确表达而改变表观遗传,从而影响胚胎的发育潜能。
本研究显示,在不同形态组中,畸形精子组的总受精率与2PN受精率显著低于正常形态组,畸形精子与异常受精的增加有关。畸形精子对受精的不利影响早已获得临床共识[8,9,12,22,23],受精中,精子形态上的缺陷会产生某些结构或超微结构的异常,这些异常会导致精子与卵子间相关蛋白、受体表达失常,从而使受精发生障碍。纳入DFI后发现,虽然C、D组的总受精率、2PN受精率显著低于A、B组,但在不同形态组中,随着DFI的增高并不会显著降低总受精率及正常受精率。这与Green等[24,25]研究一致,他们认为精子DNA损伤并非意味着与受精功能相关的基因、蛋白转录表达一定存在异常,且卵子受精阶段主要受母源基因组的调控,父系DNA表达在胚胎发育阶段才开始呈现。不过,关于“精子DNA损伤在体外受精治疗中是否对受精率有影响”仍存在争议。有学者认为精子DNA损伤会导致相应蛋白的转录与合成障碍,从而降低精子顶体酶活性及精子穿越卵透明带与卵黄膜融合的能力而发生受精障碍[26~28]。对不同结论的争议可能与实验研究对象的入选标准、DFI阈值界定、检测方法及卵子对精子DNA损伤的修复能力不同有关。本研究数据还显示不同精子形态组间的2PN卵裂率、优胚率无显著性差异,纳入DFI后显示D组2PN卵裂率显著低于A组和C组,B、D组的优胚率显著低于A、C组。有研究[29]表明无论是IVF还是卵细胞浆内单精子注射(intracytoplasmic sperm injection,ICSI),不同形态组的卵裂率及优胚率比较,差异均无统计学意义(均P>0.05);马媛等[30]研究发现精子形态与优胚率、囊胚形成率及胚胎染色体非整倍体率均无关。多数学者[9,31]认为虽然畸形精子的结构缺陷会在受精阶段影响相关蛋白、受体的正常表达而导致受精障碍,但并不参与受精卵后续的发育进程,胚胎的持续发育更依赖于染色质的完整。虽然精子形态没有显示出与胚胎质量间的相关性,但本研究发现在不同形态组中,过高的DFI会显著降低卵裂率及优胚率。
精子质量在妊娠结局中扮演非常重要的角色,有学者认为畸形精子症会显著增加胚胎的非整倍体率,降低种植率及临床妊娠率[32]。而更多研究[12,33]认为虽然正常精子形态率<4%时会显著降低IVF总受精率,但并不影响妊娠及新生儿出生后的结局,不同形态组的临床妊娠率、流产率、活产率及新生儿性别、早产、出生体重、出生缺陷率等均无统计学差异。本研究虽然并未显示出精子形态对妊娠结局的显著影响,但相比畸形精子组,正常精子形态组患者通过更高的受精率可获得更多的优质胚胎数[正常组(4.56±2.34)枚,畸形组(3.13±2.06)枚]。由于每次移植胚胎数为两枚,优胚数量的不同可能对本次移植后的临床妊娠率影响不大,但对移植妊娠失败的患者来说,正常形态组拥有更多的优质胚胎能够进行第2次甚至第3次移植,从而获得更高的累积妊娠率。在相同精子形态组中,随着DFI的增高,其临床妊娠率会显著降低,但早期流产率在各组间比较,差异无统计学意义(P=0.474),这可能与早期流产相关的样本量较少有关。目前,大量研究[13,14,26,34,35]已证实精子DNA损伤对IVF/ICSI的妊娠结局有显著的负面影响,精子DNA在父系遗传信息的传递过程中发挥重要作用,它的完整性影响着胚胎形成及后续的持续发育,从而可能造成妊娠失败或妊娠丢失增加。最近的几项meta分析[15,36]也表明在IVF及ICSI的治疗中,精子DFI对胚胎质量、临床妊娠率及流产率有良好的预测作用。
通过相关性分析,本研究进一步发现DFI与男方年龄呈显著正相关,与前向运动精子呈显著负相关(P=0.002,0.001)。父系高龄生育可影响子代的健康,增加子代患病及出生缺陷的风险。这是因为随着男性年龄的增加,曲细精管逐渐硬化,微循环发生障碍,血清性激素水平下降,生殖细胞增殖减少,这些因素可降低精子染色质成熟度,增加新生精子的基因突變,精子DNA完整性与精液质量下降。国外研究已证实DFI与年龄之间的关系,尤其在不育不孕人群中,随着男性年龄的增长,精子DFI显著增高[37,38]。因此,在试管治疗中,不仅要关注女性年龄,也不能忽视父系高龄带来的诸多不利影响。DFI与精液参数之间的关系存在一定争议,一些学者认为精子DFI与精子浓度、活力及形态等密切相关,精子DNA损伤与氧化应激、环境、遗传等因素有关,而这些因素也会作用于精子的生成与成熟,从而对精液参数产生影响[39~42]。另有研究[43]认为精子DFI仅与精子活动率、前向运动精子率相关,与精子浓度等无关。对此,Alargkof等[44]进一步研究发现在生育人群中,精子DNA损伤与各精液参数间没有相关性,而在不育人群中,DFI与前向运动精子率及正常形态率间呈显著负相关。精子DFI与精液参数有非常复杂的关联,这种关联在正常生育男性与不育男性中的表现可能并不一致,此外DFI与精液其他参数的作用机制尚不明,需要继续研究与探索。
本研究认为精子DFI对胚胎质量及妊娠结局有着良好的预测作用,同时精子形态对受精有着极强的预测能力,是获取更多优质胚胎的关键,对累积妊娠率有显著影响,两者联合评估可弥补单独使用精子形态对胚胎发育、妊娠结局的预测不足,从而建立一个更为高效准确的预测体系,有很高的应用价值。此外,作为一项回顾性研究,缺乏对活产率及新生儿相关结局的随访与统计,且在妊娠结局方面,早期流产相关病例数较少,这可能对研究造成一定的偏倚与局限性,需要今后进一步研究。
[参考文献]
[1] Gerrits T, Van Rooij F, Esho T, et al. Infertility in the Global South: Raising awareness and generating insights for policy and practice[J].Facts Views Vis Obgyn, 2017, 9(1): 39-44.
[2] Kurabayashi T, Mizunuma H, Kubota T, et al. Ovarian infertility is associated with cardiovascular disease risk factors in later life: A Japanese cross-sectional study[J].Maturitas, 2016, 83: 33-39.
[3] Sun H, Gong TT, Jiang YT, et al. Global, regional, and national prevalence and disability-adjusted life-years for infertility in 195 countries and territories, 1990-2017: Results from a global burden of disease study, 2017[J].Aging (Albany NY),2019,11(23):10952-10991.
[4] Zhou Z, Zheng D, Wu H, et al. Epidemiology of infertility in China: A population-based study [J].BJOG, 2018, 125(4): 432-441.
[5] 王静,李瑞岐,欧阳能勇,等.玻璃化冷冻胚胎和新鲜胚胎移植的临床结局比较[J].中华流行病学杂志, 2015,36(2):176-180.
[6] Lin J, Wang N, Huang J, et al. Pregnancy and neonatal outcomes of hMG stimulation with or without letrozole in endometrial preparation for frozen-thawed embryo transfer in ovulatory women: A large retrospective cohort study [J].Drug Des Devel Ther, 2019, 13: 3867-3877.
[7] Coetzee K, Kruge TF, Lombard CJ. Predictive value of normal sperm morphology: A structured literature review[J].Hum Reprod Update, 1998, 4(1): 73-82.
[8] Coban O, Serdarogullari M, Onar-Sekerci Z, et al. Evaluation of the impact of sperm morphology on embryo aneuploidy rates in a donor oocyte program[J].Syst Biol Reprod Med, 2018, 64(3): 169-173.
[9] Gatimel N, Moreau J, Parinaud J, et al. Sperm morphology: Assessment, pathophysiology, clinical relevance, and state of the art in 2017[J].Andrology, 2017, 5(5): 845-862.
[10] van-den-Hoven L, Hendriks JC, Verbeet JG, et al. Status of sperm morphology assessment: An evaluation of methodology and clinical value[J].Fertil Steril, 2015, 103(1): 53-58.
[11] Danis RB, Samplaski MK. Sperm morphology: History, challenges, and impact on natural and assisted fertility [J].Curr Urol Rep,2019,20(8): 43-48.
[12] Chen L, Li D, Ni X, et al. Effects of the normal sperm morphology rate on the clinical and neonatal outcomes of conventional IVF cycles[J].Andrologia,2020,52(5):1356-1367.
[13] Zarén P, Alson S, Henic E, et al. Interaction between serum levels of anti-mullerian hormone and the degree of sperm DNA fragmentation measured by sperm chromatin structure assay can be a predictor for the outcome of standard in vitro fertilization[J].PLoS One, 2019, 14(8): 132-143.
[14] Nicopoullos J, Vicens-Morton A, Lewis S, et al. Novel use of COMET parameters of sperm DNA damage may increase its utility to diagnose male infertility and predict live births following both IVF and ICSI[J].Hum Reprod, 2019, 34(10): 1915-1923.
[15] Simon L, Emery B, Carrell DT. Sperm DNA fragmentation: Consequences for reproduction[J].Adv Exp Med Biol, 2019, 1166: 87-100.
[16] 莊广伦.现代辅助生殖技术[M]. 北京:人民卫生出版社,2005: 238-239.
[17] 熊巍, 廖莉婷, 周远征, 等. 超长方案中不同启动策略对多囊卵巢综合征患者IVF结局的影响[J].生殖医学杂志,2021,30(6): 715-720.
[18] 戢开丽, 郭江华, 梁辉洪, 等. 精子形态可否预测精子其他参数和受精结局[J].中国男科学杂志,2016,30(1): 38-42.
[19] Paul F, Obajimi GO, Kolade CO. Is semen analysis without strict criteria misleading decisions in IVF? A prospective systematic study[J].Int J Reprod Biomed (Yazd), 2018, 16(7): 459-462.
[20] Wainer R, Albert M, Dorion A, et al. Influence of the number of motile spermatozoa inseminated and of their morphology on the success of intrauterine insemination[J].Hum Reprod, 2004, 19(9): 2060-2065.
[21] 钱宪明, 匡延平, 吴乾渝, 等. 精子形态、顶体反应与卵子受精率的相关性研究[J].同济大学学报(医学版),2005,26(5): 10-12,16.
[22] He B, Cheng JP, Pan Q, et al. Normal sperm morphology and the outcomes of routine in vitro fertilization[J].Zhonghua Nan Ke Xue, 2016, 22(1): 32-36.
[23] Zahiri Z, Ghasemian F. Is it necessary to focus on morphologically normal acrosome of sperm during intracytoplasmic sperm injection[J].Indian J Med Res,2019,150(5): 477-485.
[24] Green KA, Patounakis G, Dougherty MP, et al. Sperm DNA fragmentation on the day of fertilization is not associated with embryologic or clinical outcomes after IVF/ICSI[J].J Assist Reprod Genet, 2020, 37(1): 71-76.
[25] Yang H, Li G, Jin H, et al. The effect of sperm DNA fragmentation index on assisted reproductive technology outcomes and its relationship with semen parameters and lifestyle[J].Transl Androl Urol,2019,8(4): 356-365.
[26] Oleszczuk K, Giwercman A, Bungum M. Sperm chromatin structure assay in prediction of in vitro fertilization outcome[J].Andrology, 2016, 4(2): 290-296.
[27] 鄭九嘉, 杨旭, 张李雅,等. 精子DNA损伤、核蛋白组型转换与顶体酶活性及精液参数的相关性分析[J].中华男科学杂志,2012,18(10): 925-929.
[28] Tarozzi N, Nadalini M, Borini A. Effect on sperm DNA quality following sperm selection for ART: New insights [J].Adv Exp Med Biol,2019,1166: 169-187.
[29] Li M, Ma C, Xue X, et al. Effect of normal sperm morphology rate (NSMR) on clinical outcomes and fertilization methods selection in the ultra-short-term GnRH-a protocol[J].Gynecol Endocrinol, 2016, 32(2): 120-123.
[30] 马媛,海溧,陈书强,等.男方畸形精子症对胚胎植入前遗传学筛查患者胚胎非整倍体及胚胎发育指标的影响[J].中国妇产科临床杂志,2018,19(6): 516-520.
[31] Shabtaie SA, Gerkowicz SA, Kohn TP, et al. Role of abnormal sperm morphology in predicting pregnancy outcomes[J].Curr Urol Rep,2016,17(9): 67-73.
[32] Dubey A, Dayal MB, Frankfurter D, et al. The influence of sperm morphology on preimplantation genetic diagnosis cycles outcome[J].Fertil Steril,2008,89(6):1665-1669.
[33] 刘利敏, 吴志焕, 柯洁荣, 等. 精子形态异常与体外受精移植周期助孕结局及新生儿畸形率的相关性分析[J].河北医学,2020,26(8): 1367-1371.
[34] Zheng WW,Song G,Wang QL, et al. Sperm DNA damage has a negative effect on early embryonic development following in vitro fertilization[J].Asian J Androl, 2018, 20 (1): 75-79.
[35] Choi HY, Kim SK, Kim SH, et al. Impact of sperm DNA fragmentation on clinical in vitro fertilization outcomes[J].Clin Exp Reprod Med, 2017, 44(4): 224-231.
[36] Simon L, Zini A, Dyachenko A, et al. A systematic review and meta-analysis to determine the effect of sperm DNA damage on in vitro fertilization and intracytoplasmic sperm injection outcome[J].Asian J Androl, 2017, 19(1): 80-90.
[37] Albani E, Castellano S, Gurrieri B, et al. Male age: Negative impact on sperm DNA fragmentation[J].Aging (Albany NY), 2019, 11(9): 2749-2761.
[38] Rosiak-Gill A, Gill K, Jakubik J, et al. Age-related changes in human sperm DNA integrity[J].Aging (Albany NY), 2019,11(15):5399-5410.
[39] Maettner R, Sterzik K, Isachenko V, et al. Quality of human spermatozoa: Relationship between high-magnification sperm morphology and DNA integrity[J].Andrologia, 2014, 46(5): 547-555.
[40] 李俊,楊雪梅,赵婷婷,等.精子形态与核蛋白组型转换及DNA完整性的相关性[J].实用医学杂志,2015,31(7): 1144-1146.
[41] Gu XL, Li HG, Xiong CL. Correlation of sperm DNA fragmentation index with age and semen parameters in infertile men[J].Zhonghua Nan Ke Xue, 2018, 24(7): 608-612.
[42] Shuai J, Wu L, Gao YB, et al. Correlation of sperm DNA fragmentation index with semen parameters[J].Zhonghua Nan Ke Xue, 2019, 25(2): 129-134.
[43] 麦选诚,董云华,陈斌,等.不育患者精子DNA损伤和精液常规参数关系分析[J].中国男科学杂志,2016,30(4): 19-22.
[44] Alargkof V,Kersten L, Stanislavov R, et al. Relationships between sperm DNA integrity and bulk semen parameters in Bulgarian patients with varicocele[J].Arch Ital Urol Androl, 2019, 91(2): 178-188.
(收稿日期:2021-11-03)
