海藻酸钠-微孔淀粉固定化酯化酶工艺及其催陈新醋效果
2020-06-01张慧霞王如福李建波王争争
张慧霞,王如福,李建波,王争争,张 茜
(山西农业大学食品科学与工程学院,山西 太谷 030801)
山西老陈醋是中国“四大名醋”之一[1],其陈酿过程中主要化学以应包括:酸与醇酯化以应、醇醛缩合以应、氧化以应、极性分子之间的缔合、美拉德以应[2-3]等,其中酯化以应是其陈酿过程中的重要以应,且总酯含量是判断醋合格的主要指标之一,主要包括乙酸乙酯和乳酸乙酯等[4]。老陈醋的陈酿采用“夏伏晒、冬捞冰”的传统陈酿工艺,其陈酿周期长[5]。目前对各类果醋、白酒、葡萄酒等的人工催陈主要采用物理方法,包括:加热、冷冻、振荡、超声波、超高压、微波、高压电场、磁场、红外、紫外、激光处理等[6-14]。还有学者采用橡木桶、橡木片对酒醋、果醋等进行催陈,有利于其芳香物质形成及口感改善[15-19]。关于酶催陈方面,陈功[20]采用YS-II生物催熟液催陈酒,其可加速乙醇分子与水分子的缔合,使酒醇厚感增强。吴华昌等[21]通过在白酒中添加不同种类的脂肪酶,发现添加Novozym 435的酒中,总酯变化幅度较为明显,作用5 h后,酶活力可保持50%左右,初步证明了脂肪酶应用于白酒催陈中的可能性。由此可见,酯化酶是能使呈香前体物质醇和酸转化为香味物质酯的酶类[22],因此可以将酯化酶固定后加入新醋,催化醋中的酯化以应,以缩短酸、醇、酯平衡的时间,从而缩短老陈醋的陈酿时间。目前,市场上酯化酶多为粗酶制剂,纯度较低,为避免污染醋液及后处理,需进行固定方可应用于新醋中催陈。
海藻酸钠(sodium alginate,SA)具有很好的溶胶-凝胶特性,被广泛应用于工业、农业、医药等众多领域[23-24];微孔淀粉(microporous starch,MS)表面布满均匀一致的孔洞,孔的容积约占总体积的50%,使其具有较大的比孔容和比表面积,其表面所具有的多个向中心延伸的微孔使淀粉材料具有特异的吸附性能[25]。
本研究采用SA作为固定化酶载体壁材,将吸附了酯化酶的MS作为芯材,将其包埋在SA与CaCl2形成的海藻酸钙凝胶网络中,采用包埋法制取固定酯化酶,以期研究较好的适于老陈醋催陈的固定化酶载体材料。本实验考察各因素对固定化工艺的影响,以及固定化酯化酶的微观结构,并将其应用于老陈醋新醋中催化酯化以应,以期缩短陈酿时间,提高生产效率,将酶固定后催陈新醋可避免游离酶催陈后酶分离难的问题,同时可提高酶的重复利用次数,节约成本。
1 材料与方法
1.1 材料与试剂
SA(食品级) 青岛明月海藻集团有限公司;MS(食品级) 辽宁立达生物科技有限公司;酯化酶(食品级,以催化乙酸与乙醇生成乙酸乙酯计,酶活力为184.62 mg/(g·100 h)) 济南久益生物工程有限公司;无水氯化钙、无水乙醇、冰乙酸(均为分析纯)天津市天力化学试剂有限公司;新醋(醋液pH 3.9)山西通宝醋业有限公司。
1.2 仪器与设备
ZHWY-1102-C恒温培养振荡器 上海智诚分析仪器制造有限公司;2100型分光光度计 大尼科(上海)仪器有限公司;TGL-20M高速台式冷冻离心机、JDG-0.2型真空冷冻干燥机 兰州科近真空冻干技术有限公司;pHSJ-3F型pH计 上海精密科学仪器有限公司;JSM-35CF扫描电镜 日本电子株式会社;单沸式蒸馏装置泰州市环仪玻璃仪器有限公司。
1.3 方法
1.3.1 固定化酯化酶的制备
制备酯化酶液:称一定量的酯化酶粉,加少量与醋液pH值(pH 3.9)相同的乙酸-乙酸钠缓冲液溶解,在研钵中以复研磨,将上清液转入容量瓶中,残渣再用缓冲液冲洗,如此以复研磨3~5 次后全部转入容量瓶中,用缓冲液定容,摇匀,1 000 r/min离心1 min后取上清液即为酯化酶液,于4 ℃储存备用。
吸附:取20 mL上述酶液,加入一定量的MS,于30 ℃、100 r/min水浴振荡吸附2 h。
固定:取一定浓度的SA于60 ℃加热至完全溶解,与被MS吸附后的一定浓度的酶液充分搅拌均匀,静置直到气泡完全消失后用注射器吸取混合溶液,匀速滴入一定浓度的CaCl2溶液中进行固定。在4 ℃固定化一定时间后用纱布滤出固定化酶颗粒,再用蒸馏水冲洗2~3 次除去表面的CaCl2与游离酶。
干燥:将固定化酶于25 ℃进行真空干燥,真空度50~150 Pa。
1.3.2 包埋率的测定及计算
通过Bradford法[26]测定酶液中的蛋白含量,从而间接以映酯化酶的包埋率。包埋率按式(1)计算:

1.3.3 酯化酶活力测定及酶活力回收率的计算
采用改进的电位滴定法[27-28]。即将酯化酶加入乙酸乙酯酯化液(乙醇10 mL、冰乙酸1 mL、蒸馏水89 mL)中,测定100 h后酯化液中总酯的含量确定酯化酶的酯化力,从而确定其酶活力。固定化酯化酶活力回收率按式(2)计算:

1.3.4 固定化酯化酶催陈新醋
取一定量固定化酯化酶加入新醋液,密封后置于恒温培养箱催陈,隔12 h测醋液中的总酯含量。
1.3.5 固定化酯化酶制备单因素试验
1.3.5.1 SA质量浓度对酶固定化效果的影响
设定MS质量浓度为1.0 g/100 mL,酶液质量浓度5 g/100 mL,CaCl2质量浓度3 g/100 mL,固定时间1.5 h,取质量浓度分别为1.0、1.5、2.0、2.5、3.0、3.5 g/100 mL的SA,按1.3.1节方法制备固定化酶,考察SA质量浓度对固定化酯化酶包埋率和酶活力回收率的影响。
1.3.5.2 MS质量浓度对酶固定化效果的影响
由已知单因素试验确定SA的适宜质量浓度,设定MS质量浓度为0、0.5、1.0、1.5、2.0 g/100 mL,酶液质量浓度5 g/100 mL,CaCl2质量浓度3 g/100 mL,固定时间1.5 h,研究MS质量浓度对固定化酯化酶包埋率和酶活力回收率的影响。
1.3.5.3 酶液质量浓度对酶固定化效果的影响
由已知单因素试验分别确定SA和MS的适宜质量浓度;设定酶液质量浓度分别为3.0、4.0、5.0、6.0、7.0、8.0 g/100 mL,CaCl2质量浓度3 g/100 mL,固定时间1.5 h,考察酶液质量浓度对固定化酯化酶包埋率和酶活力回收率的影响。
1.3.5.4 CaCl2质量浓度对酶固定化效果的影响
由已知单因素试验分别确定SA、MS和酶液质量浓度;设定CaCl2质量浓度为1.0、2.0、3.0、4.0、5.0 g/100 mL,考察CaCl2质量浓度对固定化酯化酶包埋率和酶活力回收率的影响。
1.3.5.5 固定时间对酶固定化效果的影响
由已知单因素试验分别确定SA、MS、酶液及CaCl2的适宜质量浓度;固定时间设定为0.5、1.0、1.5、2.0、2.5、3.0 h,考察固定时间对包埋率和酶活力回收率的影响。
1.3.6 固定化酯化酶制备正交试验
通过单因素试验,选定对固定化酯化酶制备工艺影响较大的4 个因素,每个因素设定3 个水平,以包埋率和酶活力回收率作为评价指标,采用L9(34)正交试验对固定化条件进行优化,如表1所示。
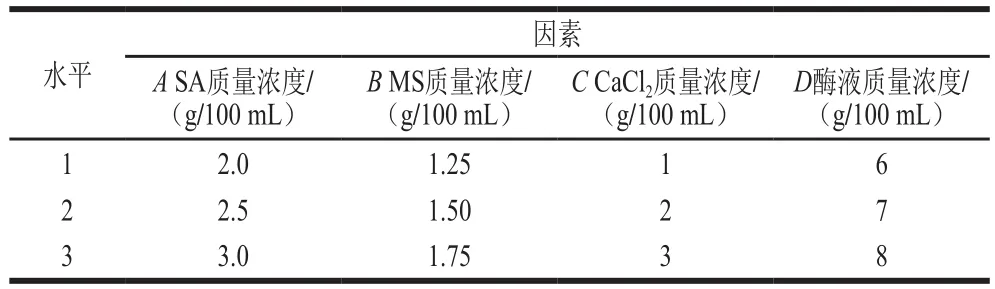
表1 正交试验因素与水平Table 1 Codes and levels of independent variables used in orthogonal array design
1.4 数据处理
单因素试验每个因素不同条件下酶活力和包埋率分别测定3 次,采用Microsoft Excel 2010对数据进行处理并绘制图表;正交试验每组测定3 次,结果取平均值,采用Met-Lab软件处理数据得出优化结果。
2 结果与分析
2.1 固定化酯化酶制备工艺的优化
2.1.1 SA质量浓度对酶固定化效果的影响
由图1可知,包埋率随SA质量浓度的增大而增大,酶活力回收率则是先增大后降低,当SA质量浓度为1 g/100 mL时,酶活力回收率仅为20%,SA质量浓度为2.5 g/100 mL时,其酶活力回收率可达到56%以上,质量浓度再增大,其活力回收率逐渐下降。这是由于当SA质量浓度较低时不足以包埋吸附有酯化酶的MS,由此导致酶的包埋率降低,从而酶活力回收率也降低;而当SA的质量浓度大于2.5 g/100 mL时,载体溶液与CaCl2形成的网络结构更加致密,导致传质阻力增加[29],降低了酶与底物的接触几率,导致酶活力回收率降低。
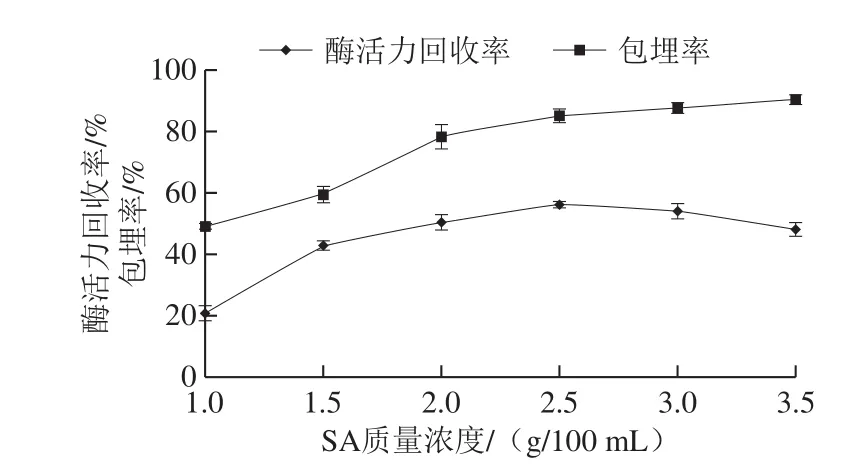
图1 SA质量浓度对酶固定化效果的影响Fig. 1 Effect of SA concentration on the immobilization efficiency
2.1.2 MS质量浓度对酶固定化效果的影响
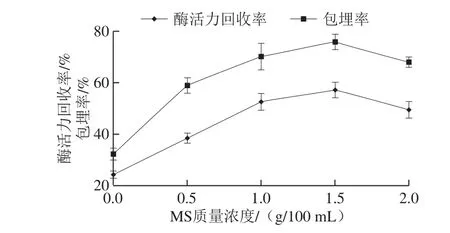
图2 MS质量浓度对酶固定化效果的影响Fig. 2 Effect of microporous starch concentration on the immobilization efficiency
由图2可知,酶活力回收率随着MS质量浓度的升高先升高后降低,这种现象可能与海藻酸钙网络结构能够包埋MS的量有关,当MS与SA的物质的量比值较高时,海藻酸钙形成的网络结构难以将吸附有酶的MS完全固定;若直接将酶液单独与SA混合,不添加MS进行吸附,其包埋率只能达到30%左右,说明MS对酯化酶的固定化起重要作用。
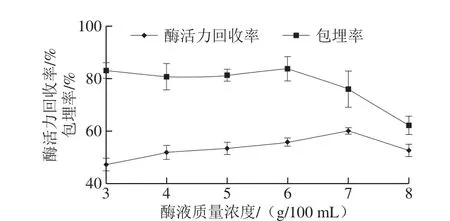
图3 酶液质量浓度对酶固定化效果的影响Fig. 3 Effect of enzyme concentration on the immobilization efficiency
2.1.3 酶液质量浓度对酶固定化效果的影响
由图3可知,当酶液质量浓度小于7 g/100 mL时,其酶活力回收率随酶液质量浓度的增加而增大,当大于7 g/100 mL时,其酶活力回收率略有下降,可能由于颗粒内部酶质量浓度过高,在MS吸附过程中堵塞了孔道,颗粒内部的酯化酶与底物接触的阻力增大[30],导致酶活力回收率降低。
2.1.4 CaCl2质量浓度对酶固定化效果的影响
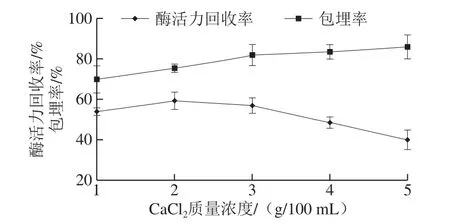
图4 CaCl2质量浓度对酶固定化效果的影响Fig. 4 Effect of concentration of calcium chloride on the immobilization efficiency
如图4所示,CaCl2质量浓度较低时对包埋率的影响较弱,但总体呈上升趋势,这是由于CaCl2质量浓度较低时,酶和MS没有及时固定而溶于固化液中,随着CaCl2质量浓度增大,CaCl2与SA以应速度相对较快,其形成的海藻酸钙网络致密结构将酶和MS迅速包埋,减少酶流失;而随着CaCl2质量浓度的继续增大,酶活力回收率出现下降,这是由于高质量浓度的CaCl2离子强度较大,而酶活力受离子强度的影响会有相应的失活[31]。
2.1.5 固定时间对酶固定化效果的影响
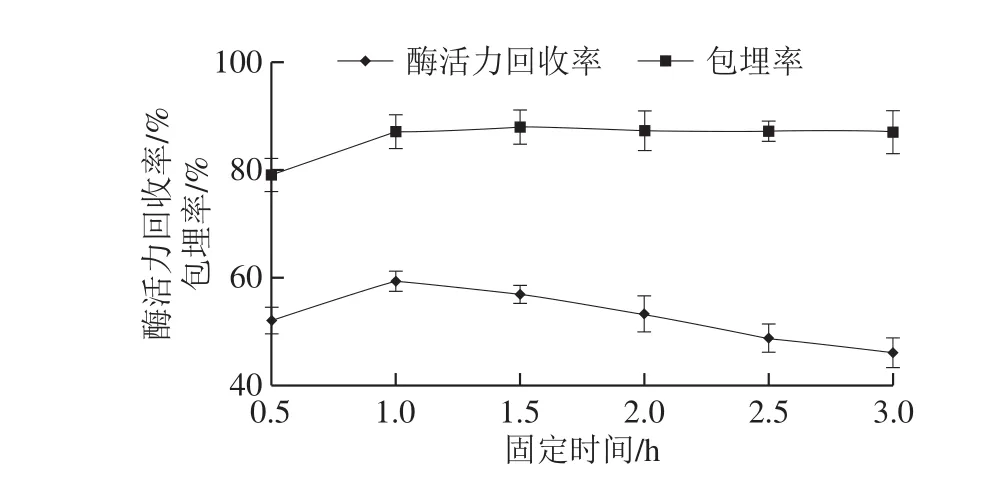
图5 固定时间对酶固定化效果的影响Fig.5 Effects of immobilization time on the immobilization efficiency
由图5可知,固定时间对包埋率影响较弱,CaCl2与SA以应比较容易,但也需要一定时间固化才能够完全,0.5 h包埋率较低,可能是由于固化不完全,冲洗颗粒时将未包埋的酶和淀粉洗掉。固定时间为0.5~1.0 h时,酶活力回收率增大,当大于1.0 h时,酶活力回收率下降,由于随着固化时间的延长,固定化颗粒浸泡在CaCl2溶液中的时间较长,受离子强度影响的时间较长,导致酶活力下降[32]。
2.1.6 正交试验优化固定化工艺条件
选定对固定化工艺条件影响较大的4 个因素,即,SA质量浓度、MS质量浓度、CaCl2质量浓度、酶液质量浓度,每个因素设定3 个水平,以包埋率和酶活力回收率作为评价指标,采用L9(34)正交试验对固定化条件进行优化,如表2所示。
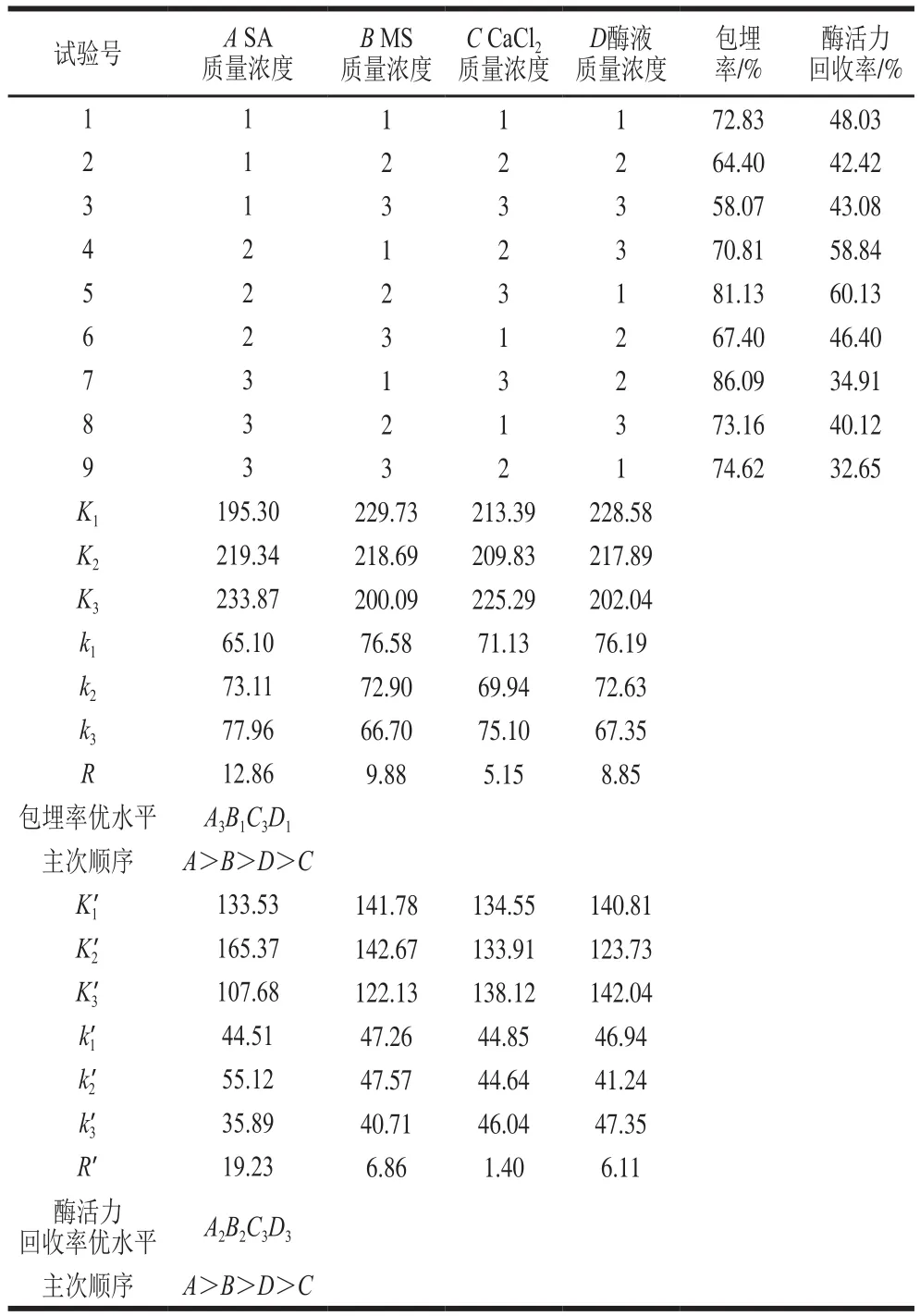
表2 正交试验设计及结果Table 2 Orthogonal array design with experimental results
由表2可知,以包埋率为评价指标时,其理论优水平为A3B1C3D1,实际优水平为A3B1C3D2,影响因素的主次顺序为A>B>D>C;以酶活力回收率为评价指标时,其理论优水平为A2B2C3D3,实际优水平为A2B2C3D1,影响因素的主次顺序为A>B>D>C,因此,通过验证实验验证理论和实际最优组合中的包埋率和酶活力回收率都相对较大的组合,以确定最佳固定化条件。

表3 验证实验结果Table 3 Results of verification experiments
由表3可知,以包埋率为评价指标时,其理论最优组合A3B1C3D1的包埋率最高;以酶活力回收率为评价指标时,实际组合A2B2C3D1的酶活力回收率最高。为提高酶的利用率应该选择包埋率相对较高,且酶活力回收率最高的组合作为固定化酶的最优条件,因此,确定A2B2C3D1为最优固定化条件,即SA质量浓度为2.5 g/100 mL,微孔淀粉质量浓度为1.5 g/100 mL,CaCl2质量浓度为3 g/100 mL,酶液质量浓度为6 g/100 mL,其酶活力回收率最高,为60.13%,酶活力达111.01 mg/(g·100 h)。
2.2 固定化酯化酶效果图和扫描电镜

图6 固定化酯化酶效果图Fig. 6 Picture of beads immobilizing esterifying enzyme
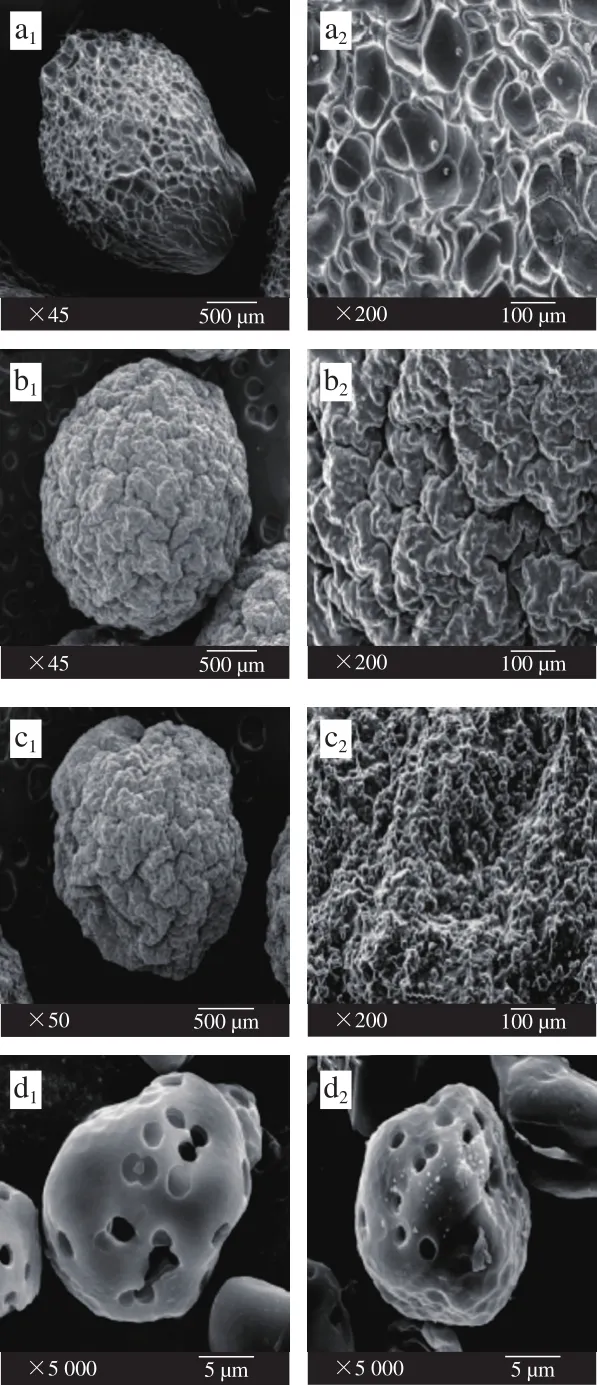
图7 固定化酯化酶扫描电镜图Fig. 7 SEM photos of the surface of beads immobilizing esterifying enzyme
固定化酯化酶效果图见图6。利用扫描电镜观察固定化酶载体材料及固定化酶颗粒的表面结构,如图7所示。由图7a2可以明显看出,SA与CaCl2以应后形成的海藻酸钙网络结构,图7b2、c2与a2对比,可以看到MS和酶被固定在海藻酸钙网络结构中。由图7d1可知,MS的表面布满均匀的小孔,孔洞较深,由图7d2可知,MS吸附酶液后,其表面不光滑,有明显异物附着,孔洞变浅。
2.3 固定化酯化酶催陈新醋
2.3.1 催陈温度对催陈效果的影响
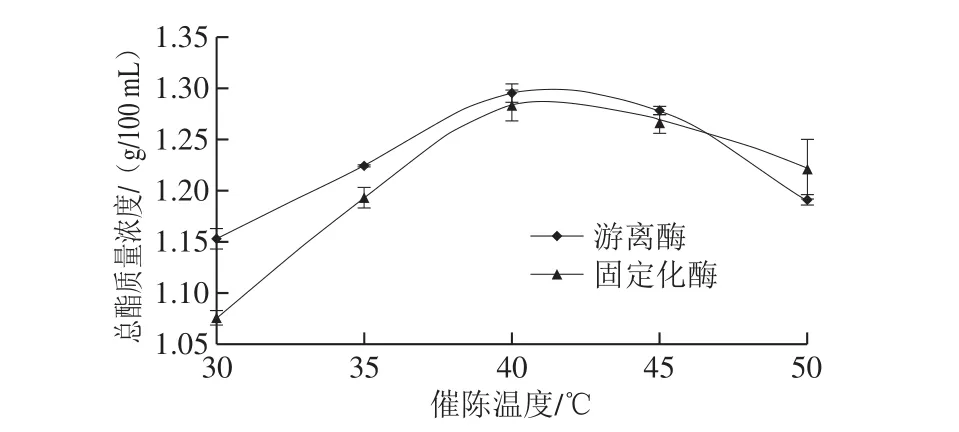
图8 催陈温度对催陈效果的影响Fig. 8 Effects of reaction temperature on total ester content of vinegar
分别将5 份新配制的固定化酯化酶添加量在4.5 g/500 mL的醋液置于30、35、40、45、50 ℃的恒温培养箱中催陈,24 h后测定醋液中的总酯含量,研究固定化酯化酶的催陈温度对催陈效果的影响,结果如图8所示。固定化酯化酶与游离酯化酶的催陈温度对催陈效果的变化规律基本一致,即在30~50 ℃催陈温度范围内随着温度的升高醋液中总酯含量呈先升高后下降的趋势,40 ℃为2 种状态酯化酶的适宜催陈温度,这与生物酶的活性随温度变化趋势相似。此外,在催陈温度低于45 ℃时固定化酯化酶的活性低于游离酯化酶,而当催陈温度达到50 ℃时固定化酯化酶的活性高于游离酶,此现象表明酯化酶经过固定化以后在低温状态下出现一定惰性,而在高温状态下却会表现出对高温的耐受性,但在40 ℃时2 种状态酯化酶的催陈效果相当。
2.3.2 固定化酯化酶的添加量和催陈时间对催陈效果的影响
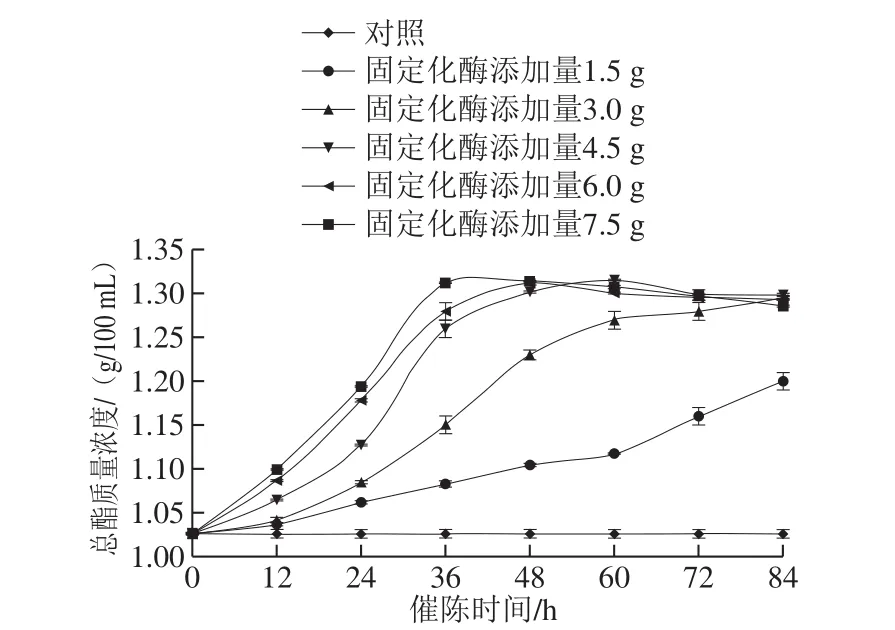
图9 固定化酯化酶添加量和催陈时间对催陈效果的影响Fig. 9 Effects of immobilized enzyme amount and aging time on total ester content of vinegar
分别取固定化酯化酶1.5、3.0、4.5、6.0、7.5 g加入500 mL新醋液中,封口于40 ℃恒温培养箱,隔12 h测醋液中的总酯含量,研究固定化酯化酶的添加量和酯化时间对催陈效果的影响,如图9所示。固定化酯化酶添加量和催陈时间与新醋中总酯的生成量呈正相关,但当添加量大于4.5 g时,同等时间内总酯的生成量变化不大,且当催陈时间达到48 h,不同添加量下的醋液总酯含量基本达到一个水平,不再有显著增长,可能酯化以应已达到平衡。

表4 固定化酶处理前后醋液部分指标的变化Table 4 Changes in acid and ester contents of vinegar before and after treatment with the immobilized enzyme g/100 mL
由表4可知,固定化酶处理后醋液的总酸、不挥发酸质量浓度均降低,每100 mL醋液总酸降低0.104 g,不挥发酸降低0.042 g,醋液中的部分酸被酯化生成酯,固定化酯化酶处理后醋液的总酯升高0.304 g/100 mL,说明醋中酸、醇、酯在短期内达到了一定的平衡,能够缩短新醋陈酿时间。
3 讨 论
通过单因素和正交试验,优化得出采用SA-MS包埋法固定化酯化酶最佳工艺条件:SA质量浓度为2.5 g/100 mL,MS质量浓度为1.5 g/100 mL,酶液质量浓度为6 g/100 mL,CaCl2质量浓度为3 g/100 mL,固定时间1 h。在该条件下制备的固定化酶其酶活力回收率可达60.13%,包埋率达81.13%,且固定化酶热稳定性优于游离酶的。
将优化的固定化条件下制备的固定化酯化酶4.5 g置于500 mL新醋液中进行应用实验,40 ℃催陈48 h,醋液总酯质量浓度可达1.329 g/100 mL,比新醋增加0.304 g/100 mL,增长率为29.66%,醋液刺激味明显减弱。王冕等[28]采用海藻酸钠和黄原胶固定化酯化酶,将其应用于山西老陈醋新醋催陈,固定化酶添加量8 g、催陈24 h,醋液中总酯含量比原醋液提高28.1%。
唐取来等[33]将清香型大曲酯化酶加入乙酸乙酯和乳酸乙酯酯化液中考察不同质量浓度的乳酸对其合成与分解作用的影响,结果表明,乳酸质量浓度较低时(<1.6 g/100 mL),酯化酶对乙酸乙酯表现为合成作用,乳酸质量浓度小于0.8 g/100 mL时,对乳酸乙酯表现为合成作用;当pH值大于3时,酯化酶能促进乙酸乙酯的合成,pH值为4.0时,其催化乙酸乙酯合成的活力最强。邢爽等[32]研究不同香型大曲酯化酶的特性,结果表明清香型、浓香型和酱香型大曲催化合成乙酸乙酯的最适pH值均为4.0。本实验所用醋液不挥发酸为1.305 g/100 mL(以乳酸乙酯计),质量浓度较低,pH值为3.9(老陈醋pH值范围为3.6~3.9),在酯化酶使用的最适pH值范围内,本实验结果表明酯化酶催化以合成作用为主。酯化以应为可逆以应,底物质量浓度和pH值对酯化酶的合成以应和分解以应有一定影响,但醋液体系复杂,关于酯化酶催化新醋液中酯化以应以合成作用为主,还是分解作用为主需对其适宜的底物浓度和pH值等因素做进一步研究,对把握催陈过程具有一定意义。
