基于高通量测序技术分析蜂粮微生物多样性
2020-06-01刘玥佳韩业君彭文君牛庆生方小明赵亚周田文礼
刘玥佳,韩业君,彭文君,牛庆生,方小明,赵亚周,田文礼,
(1.中国农业科学院蜜蜂研究所,北京 100093;2.中国科学院过程工程研究所,北京 100190;3.吉林省养蜂科学研究所,吉林 吉林 132013)
蜂粮是蜜蜂将蜂花粉、蜂蜜、蜜蜂分泌物等充分混合,经特定微生物充分发酵后,贮存于巢房中供蜜蜂食用的物质。其营养丰富、风味独特,是一种极具开发潜力的发酵食品[1]。由于从蜂群中直接获取量少且非常繁琐,理想的方式是实现离群、工业化生产,而制约工业化生产的因素众多,其中关键是发酵微生物的确定。对于研究食品中微生物的群落组成及变化,常用的传统培养分离方法费时、费力,且无法真正解析微生物的组成、丰度及其变化情况。高通量测序技术可省去培养过程,直接从样品中提取微生物基因组DNA后进行测序分析,结合生物信息学工具,能够检测出传统方法无法分离培养的微生物[2-3]。蜂粮发酵过程中的菌群一直处于动态变化中,因此,利用高通量测序技术研究和分析不同发酵周期的蜂粮菌群构成及其演替规律,具有重要的理论意义和潜在的实用价值。
目前,在食品领域中已有大量将高通量测序技术用于微生物群落分析的研究[4-6],例如对干酪、韩国泡菜[7]等发酵食品中微生物群落结构的分析,揭示了发酵食品酿造过程中微生物群落结构、丰度变化及其与代谢产物之间的联系。蜂粮中菌群丰富,包括乳酸菌、芽孢杆菌、酵母菌、霉菌等,但关于蜂粮的菌群结构研究还比较少。刘赛[8]从蜂粮中分离纯化出39 株菌株,并从这些菌株中筛选出了3 株产酸性能较好的乳酸菌,经鉴定分别为:Lactobacillus plantarum、L. casei ssp. casei、L. debrueckii ssp. delbrueckii。Gilliam[9]从人工采集花粉、蜜蜂采集蜂花粉以及贮存在蜂箱中1、2、6 周的(蜂粮)花粉中分离出了6 个属,113 种酵母菌。此外,花粉中大部分的酵母菌种在蜂粮中并未发现,这说明蜂粮酿制过程中酵母菌群发生了变化。张言周等[10]从蜂粮样品中分离出产芽孢的细菌,经鉴定分别隶属于Lysinibacillus fusiformis、Bacillus tequilensis、Fictibacillus nanhaiensis、B. aerophilus、B. invictus、B. sonorensis、L. xylanilyticus、B. methylotrophicus等芽孢杆菌;崔学沛[11]从意蜂蜂粮中筛选得到了B. amyloliquefaciens和B. licheniformis。Gilliam等[12]从蜂粮样品中分离出了曲霉菌、青霉菌和毛霉菌等霉菌。苏松坤[13]从不同酿制时期的蜂粮中亦分离出了曲霉菌、青霉菌和毛霉菌等霉菌,由于花粉源植物和地区的不同,其含量存在一定差异。
目前,通常把蜂粮的发酵过程分为4 个阶段:1)异源微生物生长阶段;2)厌氧发酵起始阶段;3)酸化阶段;4)稳定阶段[14]。开始的0.5 d,花粉中营养物质丰富,乳酸菌和酵母菌大量繁殖。约在发酵开始7 d以后,基质内pH值达到4.0~4.5,高浓度的乳酸抑制乳酸菌和酵母菌等的生长,某些乳酸菌和酵母菌开始消失,蜂粮酿制完成[15]。乳酸菌在发酵第0.5天时丰度最高,发酵第4天时丰度下降,7 d以后乳酸菌含量下降明显。
卡尼鄂拉蜂(Apis mellifera carnica)采蜜能力强,范围广,故本研究以卡尼鄂拉蜂的蜂粮为研究对象,采用Illunina MiSeq高通量测序平台对细菌的16S rDNA V4-V5区进行测序,分析蜂粮的微生物群落多样性及各类微生物的构成及变化,明确蜂粮发酵过程中的优势,为人工蜂粮的生产提供理论依据,以期更好地提高蜂粮品质,推动其产业化发展。
1 材料与方法
1.1 材料与试剂
实验样品采集于吉林省养蜂科学研究所。采集方法:首先,取样的第1天,蜂箱中只保留一张大幼虫脾外,其他脾全部抽出,加一张育过5~6 代蜜蜂的空脾(事先用75%乙醇溶液喷洒消毒);用隔王栅将蜂王限制在子脾上,使工蜂给空脾装花粉。5 h后将花粉脾抽出,均匀选取位于巢脾不同位置的蜂粮样品收集于离心管(已灭菌)中,样品采集完后置于-80 ℃冰箱冻存。10 h后取下多用器盖板,第2天早上再盖回。同时在寄放花粉脾的蜂群内加一张大花粉脾供蜂群食用[16]。按照上述方法依次取得发酵0.5、4、7、12 d的蜂粮样品。
PowerSoil DNA Isolation Kit (Cat# 12888-50)试剂盒 上海斯信生物科技有限公司;胶回收试剂盒德国Qiagen公司。
1.2 仪器与设备
ME104E精密天平 梅特勒-托利多国际贸易(上海)有限公司;Haier磁力搅拌器 常州迈科诺仪器有限公司。
1.3 方法
1.3.1 蜂粮样品总DNA提取
由于每个巢房内可获取的蜂粮样品较少,将若干个巢房的蜂粮样品混匀进行DNA提取以提高DNA浓度,同时使蜂粮样品更具代表性。参照DNeasy PowerSoil Kit(Cat# 12888-50)试剂盒说明,分别提取不同发酵时间蜂粮细菌基因组DNA。所得DNA采用0.8%琼脂糖凝胶电泳检测DNA完整性。
1.3.2 蜂粮16S rRNA基因V4-V5区的扩增
利用琼脂糖凝胶电泳对基因组DNA进行初步检测,即取适量的样本DNA于离心管中,使用无菌水稀释样本至1 ng/μL。以稀释后的基因组DNA为模板进行聚合酶链式以应(polymerase chain reaction,PCR)测定。
1.4 蜂粮高通量测序和数据分析
将PCR扩增产物进行琼脂糖凝胶电泳检测;切下目的条带并用胶回收试剂盒回收。委托北京诺禾致源生物信息科技有限公司基于Illumina MiSeq技术测序平台构建文库,进行高通量双末端测序。
得到下机数据后利用Barcode序列和PCR扩增引物序列进行拆分,截去Barcode和引物序列后,使用FLASH[17]对每个样本的reads进行拼接,得到的原始Tags数据需要经过严格的过滤处理[18]得到高质量的Tags数据。参照QIIME(Version 1.9.1)[19]的Tags质量控制流程,得到最终的有效数据。
利用UPARSE软件(UPARSE v7.0.1001)[20]对所有样本的全部 Effective Tags进行聚类,默认以97%的一致性将序列聚类成为可操作分类单元(operational taxonomic units,OTUs),筛选出现频率最高的OTUs序列作为代表序列。用Mothur方法与SILVA132的SSU rRNA方法将筛选到的OTUs序列进行物种注释并根据其分类学信息在各分类水平上进行分类统计,分析各个样本的群落组成[21-22]。
使用QIIME软件(Version 1.9.1)计算Observed-OTUs、Chao1指数、Shannon指数、Simpson指数、ACE指数、Coverage指数,使用R软件(Version 2.15.3)绘制稀释曲线,并进行α多样性指数组间差异分析。
2 结果与分析
2.1 蜂粮样品总DNA的提取
提取蜂粮基因组总DNA,用琼脂糖凝胶电泳检测其DNA完整性,结果如图1所示,可进行后续测序。
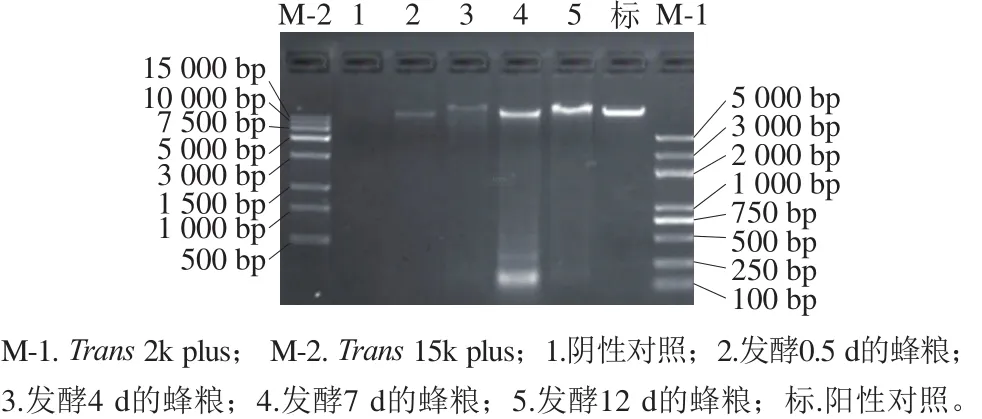
图1 蜂粮细菌基因组DNA提取Fig. 1 Agarose gel electrophoresis of bacterial genomic DNA samples extracted from bee bread
2.2 蜂粮发酵过程中细菌群落的α多样性分析
利用稀释曲线评价蜂粮菌群的测序深度和物种丰富度。从图2可以看出,随着测序深度增加,稀释曲线基本达到饱和,说明样本的测序数据量足以以应蜂粮中的微生物多样性。
每个样品的Coverage指数、Chao1指数和Shannon指数分别用于评估物种的测序深度、丰度和多样性。Coverage指数以映了样本的真实情况,Coverage指数越高,则样本中序列没有被测出的概率越低;Chao1指数是群落丰度指数,Chao1指数越大,表明样品微生物群落丰度越高;Shannon指数是群落分布多样性指数,Shannon指数越大,表明样品微生物多样性越高;OTUs数量亦可以代表样品物种的丰度[23]。由表1可知,不同发酵周期的蜂粮中微生物Coverage指数都大于0.99,说明样品文库中序列基本上都被测出,即样本测序结果可以以映样品的真实情况。随着发酵时间的延长,Chao1指数、ACE指数和Shannon指数先升高后降低,发酵中期,物种丰富度达到最高。由图3可知,4 个样品共得到429 个OTUs,不同发酵周期共有OTUs数为99,各个时期独有的OTUs数相对较少。
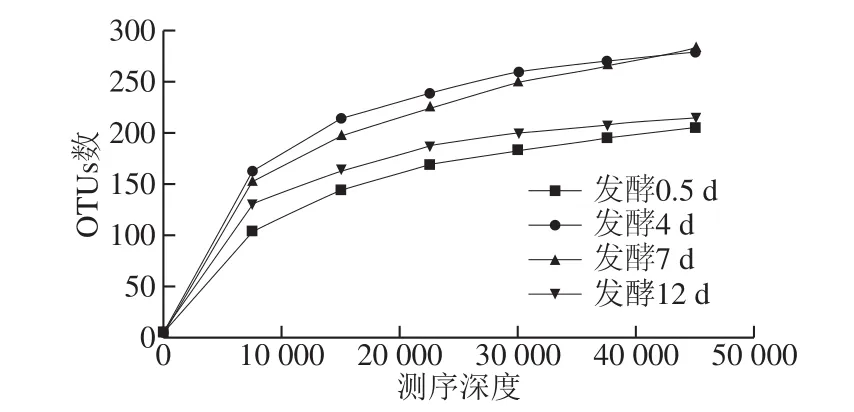
图2 蜂粮测序样品稀释曲线Fig. 2 Rarefaction curves of bee bread
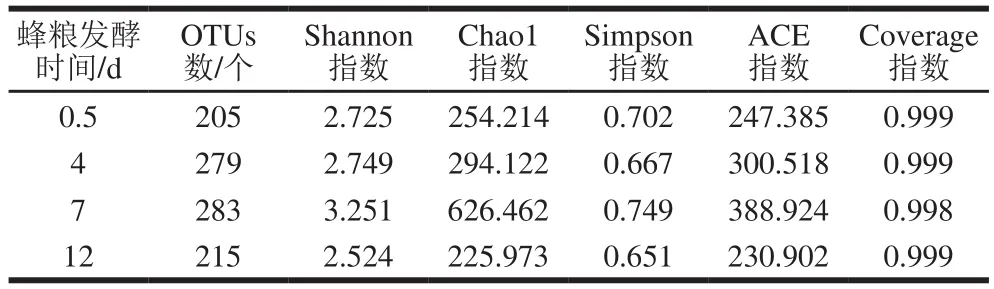
表1 α多样性指数Table 1 α Diversity indices of different samples
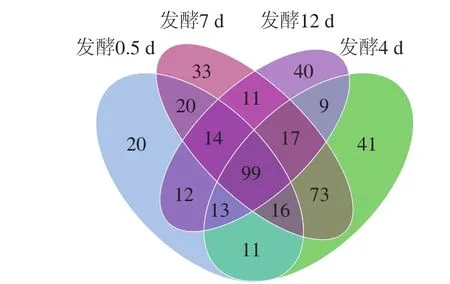
图3 OTUs分布Venn图Fig. 3 Venn diagram showing the distribution of OTUs
2.3 蜂粮菌群多样性
2.3.1 基于门分类水平的蜂粮菌群多样性分析
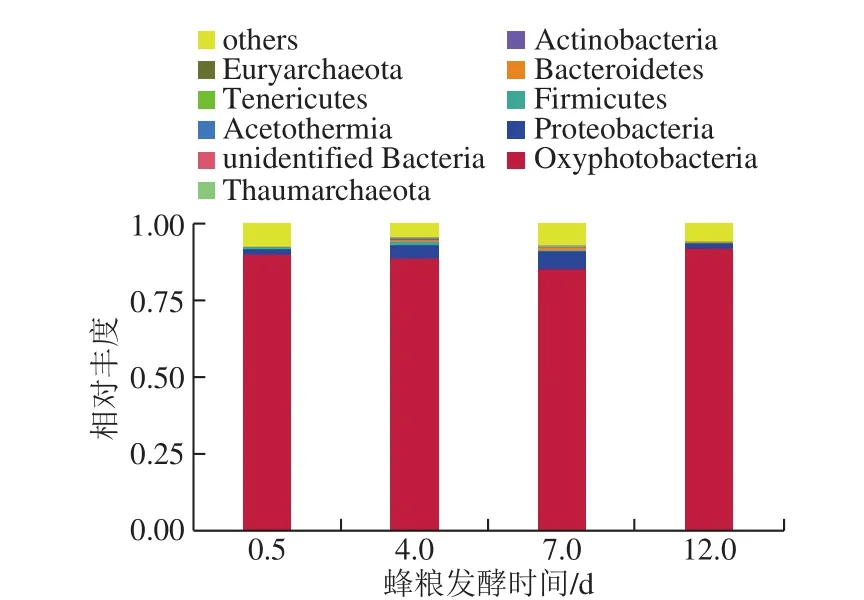
图4 蜂粮菌群基于门分类水平的分布Fig. 4 Bacterial distribution at the phylum level
如图4所示,高通量测序分析表明蜂粮菌群主要由软壁菌门(Tenericutes)、广古菌门(Euryarchaeota)、(Acetothermia)、奇古菌门(Thaumarchaeota)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、生氧光细菌门(Oxyphotobacteria)、螺旋体门(Spirochaetes)等组成。随着发酵时间的延长,基于门水平的微生物多样性发生了变化。
不同发酵周期的蜂粮在门分类水平上,优势菌门所占比例相似,生氧光细菌和变形菌的含量最高,为优势菌群。发酵时间为0.5、4、7、12 d的蜂粮中生氧光细菌和变形菌的含量分别为:90.2%、89.0%、85.6%、92.2%;1.7%、4.2%、5.6%、1.5%。
衣原体门(C hla m y dia e)、梭杆菌门(Fusobacteria)、泉古菌门(Crenarchaeota)在发酵初期含量比较少,而在发酵4、7、12 d的蜂粮样品中均未检测出,可能是来自于蜂花粉,随着发酵的进行,加上蜜蜂的转化,这几种菌逐渐消失。Calditrichaeota、硝化螺旋菌门(Nitrospirae)在发酵0.5、4、7 d的蜂粮中均未检测出,而在发酵12 d的蜂粮中少量存在,说明其产生于蜂粮的发酵后期。
2.3.2 基于纲分类水平的蜂粮菌群多样性分析
如图5所示,高通量测序分析表明蜂粮菌群主要由unidentified Oxyphotobacteria、α-变形杆菌纲(Alphaproteobacteria)、γ-变形杆菌纲(Gammaproteobacteria)、拟杆菌纲(Bacteroidia)、梭菌纲(Clostridia)、δ-变形菌纲(Deltaproteobacteria)、杆菌纲(Bacilli)、Nitrososphaeria、unidentified Actinobacteria、酸微菌纲(Acidimicrobiia)等组成。随着发酵时间的延长,基于纲水平的微生物群落结构发生了变化。Nitrososphaeria和Acidimicrobiia在发酵第0.5天和12天时均为0,仅在发酵中期存在。
蜂粮中主要的菌群为生氧光细菌门Oxyphotobacteria,在蜂粮中占到了80%以上,但其只鉴定到了门分类水平,无法具体鉴定到门以下水平,可能是现有数据库中关于此类菌群的信息较少,所以序列没有得到高相似度的16S DNA比对结果。
2.3.3 基于目水平的蜂粮菌群多样性分析
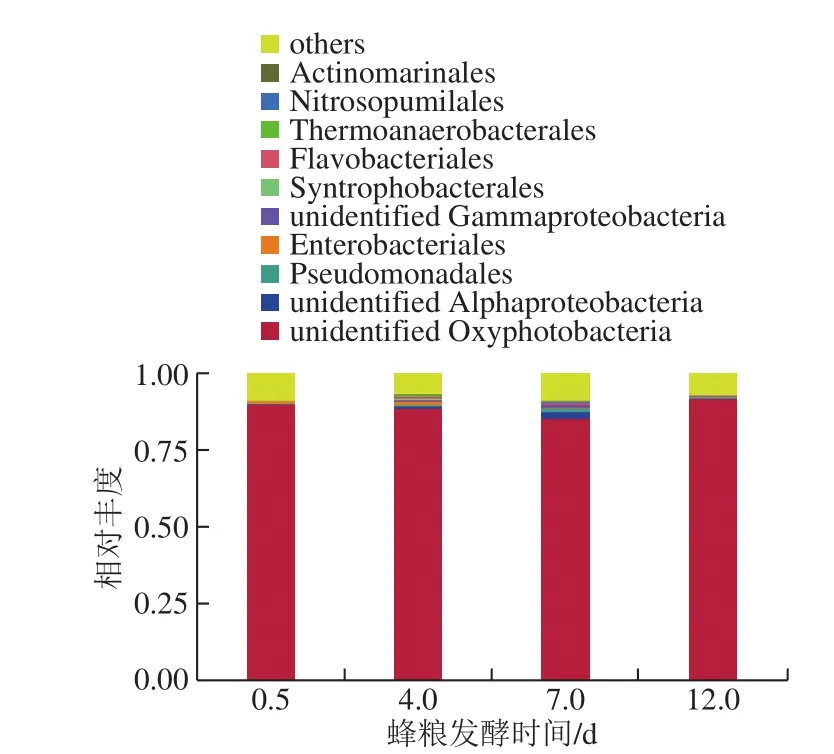
图6 蜂粮菌群基于目分类水平的分布Fig. 6 Bacterial distribution at the order level
如图6所示,测序结果表明蜂粮菌群主要由unidentified Oxyphotobacteria、unidentified Alphaproteobacteria、拟杆菌目(Bacteroidales)、假单胞菌目(Pseudomonadales)、梭菌目(Clostridiales)、肠杆菌目(Enterobacteriales)、unidentified Gammaproteobacteria、立克次氏体目(Rickettsiales)、互营杆菌目(Syntrophobacterales)、黄杆菌目(Flavobacteriales)等组成。这些菌均出现于整个发酵周期。
2.3.4 基于科水平的蜂粮菌群多样性分析
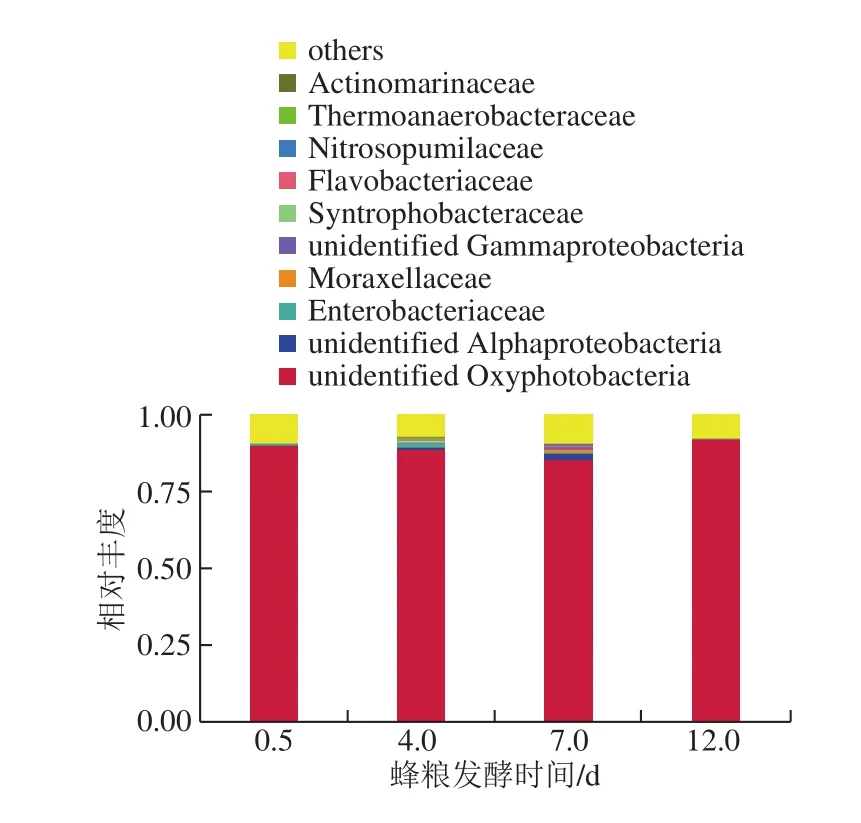
图7 蜂粮菌群基于科分类水平的分布Fig. 7 Bacterial distribution at the family level
如图7所示,测序结果表明蜂粮菌群主要由unidentified Oxyphotobacteria、醋杆菌科(Acetobacteraceae)、unidentified Alphaproteobacteria、肠杆菌科(Enterobacteriaceae)、莫拉氏菌科(Moraxellaceae)、(Muribaculaceae)、普雷沃氏菌科(Prevotellaceae)、unidentified Rickettsiales、unidentified Gammaproteobacteria、互营杆菌科(Syntrophobacteraceae)等组成。
2.3.5 基于属水平的蜂粮菌群多样性分析
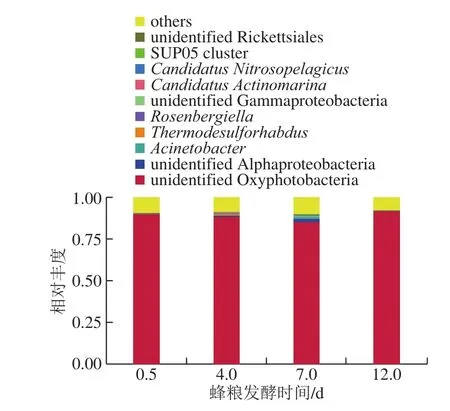
图8 蜂粮菌群基于属分类水平的分布Fig. 8 Bacterial distribution at the genus level
如图8所示,共鉴定出112 个属:在发酵0.5 d的蜂粮中共鉴定出46 个属,4 d的蜂粮中鉴定出个69 个属,7 d的蜂粮中鉴定出77 个属,12 d的蜂粮中鉴定出47 个属,其中4 个样品中有25 个共有菌属。
基于属水平,蜂粮最优势微生物为unidentified Oxyphotobacteria,随着发酵的进行,unidentified Oxyphotobacteria受到抑制,发酵中期减少,发酵后期又增加。但unidentified Oxyphotobacteria始终是优势菌。此外,玫瑰单胞菌属(Roseomonas)、unidentified Alphaproteobacteria、不动杆菌属(Acinetobacter)、热硫还原杆菌属(Thermodesulforhabdus)、unidentified Gammaproteobacteria、短波单胞菌属(Brevundimonas)均呈先增加后减少的趋势,与unidentified Oxyphotobacteria基本一致。unidentified Alphaproteobacteria与unidentified Gammaproteobacteria在发酵第1天时,均为0,发酵中期才存在,很可能来自蜜蜂的肠道菌群。Gammaproteobacteria正是蜜蜂肠道的八大菌群;Stenotrophomonas、Sphingobacterium、Anaerobiospirillum、Odoribacter、Rhodococcus、Bacteroides、Geothermobacter、Calorithrix、Anaeromyxobacter在发酵第1天时,均为0,发酵后期才存在,说明这些菌产生于蜂粮的发酵后期;还有一些菌,如unidentified Gammaproteobacteria、念珠菌(Candidatus)、Nitrosopelagicus、SUP05 cluster、Candidatus Actinomarina、unidentified Bacteria、unidentifiedRhodospirillales、unidentifiedThermoplasmata、弧形菌属(Vibrio)、Puniceispirillum、Aquibacter、嗜热弯曲甲烷热杆菌(Methanothermobacter)、Limnobacter、瘤胃梭菌属(Ruminiclostridium)等在发酵初期和末期均不存在,只存在于发酵中期。
3 讨 论
由于每个巢房内可挖取的蜂粮样品较少,小于0.1 g,进行DNA提取的浓度太低,无法建库进行后续测序,故参考Vigneron等[24]的实验方法,每次取样时均匀选取位于巢脾不同位置的蜂粮样品,将若干个巢房的蜂粮样品混匀,进行DNA的提取以提高DNA浓度,同时可以使蜂粮样品更具代表性。
对不同发酵时间的蜂粮中的细菌种群结构和多样性变化的研究表明,随着发酵的进行,细菌物种多样性和丰富度先升高后降低。但主要优势微生物并没有改变,始终为生氧光细菌和变形菌,生氧光细菌是蜂粮中丰度最高的菌群。unidentified Oxyphotobacteria在发酵过程中丰度一直最高,为发酵过程的主要优势菌。
近年来,科研人员基于16S rRNA序列和宏基因组分析技术,对不同地区的西方蜜蜂的肠道菌群进行了检测,结果显示有95%以上都属于8大类群,分别是Gilliamella、Gammaproteobacteria、Snodgrassella、Bartonella、Acetobacteraceae、Lactobacillus、Lactobacillus acidophilus、Bifidobacterium[25-33]。本研究中发现的unidentified Alphaproteobacteria与unidentified Gammaproteobacteria在发酵第1天时均未被检出,发酵中期才存在,很可能来自蜜蜂的肠道菌群。
Gilliamella、Lactobacillus、Bartonella、Bifidobacterium等几种菌在蜂粮样品中均被检出。Gilliamella与Bifidobacterium均在第7天的样品中含量最高;Lactobacillus在发酵初期含量最高,而后一直呈下降趋势;Bartonella在发酵末期含量最高。Engel等[34]对西方蜜蜂肠道菌群宏基因组的分析发现:其肠道菌可能有多种功能,例如与宿主相互作用,形成生物膜,分解碳水化合物等,对病原菌的防御和免疫起着至关重要的作用。
Engel等[35]通过对Bartonella进一步分析发现:Bartonella含有VB12的合成系统,可以合成VB12供给蜜蜂;此外,Bifidobacterium、Lactobacillus和Gilliamella还具有合成果胶降解酶、糖苷水解酶和多糖水解酶等功能。而果胶纤维素是花粉内壁的主要成分,果胶降解酶的合成表明这些菌群有助于蜂花粉释放营养物质。这些潜在的功能也从基因水平上以映了乳酸菌可能参与了蜜蜂体内碳水化合物的代谢。
4 结 论
本实验通过对卡尼鄂拉蜂不同发酵时间的蜂粮进行高通量测序,分析和研究了蜂粮发酵过程中细菌群落的组成及其丰度变化,考察不同发酵时间对蜂粮发酵过程中菌群的影响,共27 个门、112 个属的细菌被鉴定出。基于门水平,Oxyphotobacteria和Proteobacteria是优势菌群。基于属水平,蜂粮最优势微生物为unidentified Oxyphotobacteria,随着发酵的进行,unidentified Oxyphotobacteria受到抑制,发酵中期减少,发酵后期又增加,但unidentified Oxyphotobacteria始终是优势菌。生氧光细菌与光合作用有关[36],从而推断本实验的优势菌unidentified Oxyphotobacteria可能与植物的光合作用有关,说明这种菌有可能来自于花粉源植物。此外,一些菌如unidentified Alphaproteobacteria与unidentified Gammaproteobacteria等,在发酵第1天时,均为0,发酵中期才存在,很可能来自蜜蜂的肠道菌群。进一步验证了Mattila等[37]认为蜂粮中的菌群一部分来自于蜜蜂肠道菌群的研究结果。
蜂粮中主要的菌群为生氧光细菌门Oxyphotobacteria,在蜂粮中占到了80%以上,但其只鉴定到了门分类水平,无法具体鉴定到门以下水平,可能是现有数据库中关于此类菌群的信息较少,所以序列没有得到高相似度的16S DNA比对结果。研究结果对于蜂粮中该类微生物的分离鉴定具有重要意义。本研究为实现蜂粮工业化生产过程中发酵菌株的确定及发酵条件确定、进一步筛选优势发酵菌株提供一定的参考依据。
