草莓胶孢炭疽菌拮抗细菌贝莱斯芽孢杆菌JK3的鉴定及其抗菌活性
2020-05-29冯江鹏邱莉萍梁秀燕陈碧秀夏海洋彭春龙钟永军
冯江鹏,邱莉萍,梁秀燕,陈碧秀,夏海洋,彭春龙,钟永军,*
(1.台州学院 生物制药研究所,浙江 台州 318000; 2.台州学院 生命科学学院,浙江 台州 318000; 3.台州市农业科学研究院 生物技术研究所,浙江 临海 317000)
草莓是重要的经济作物,在地方特色经济中占有重要的地位。草莓炭疽病是威胁草莓产业健康发展的主要病害之一,严重影响草莓的产量和品质,给我国的草莓产业造成了巨大的经济损失[1-2]。草莓炭疽病菌是典型的高温高湿型病菌,28~32 ℃和90%以上的相对湿度是草莓炭疽病菌侵染的最适条件[3]。草莓栽培多以温室大棚为主,草莓棚内易形成高温高湿的环境,利于草莓炭疽病发生。研究表明,草莓炭疽病的病原菌为炭疽菌属的多种真菌,有胶孢炭疽菌(Colletotrichumgloeosporioides)、尖孢炭疽菌(Colletotrichumacutatum)、草莓炭疽菌(Colletotrichumfragariae)等[4]。不同地域的草莓炭疽病病菌的优势种不同,浙江省草莓炭疽病的优势病原菌为胶孢炭疽菌[5]。
目前,草莓炭疽病的防治主要依赖于化学药剂,但化学药剂的大量使用所带来的药物残留问题、环境问题等,不利于我国农业绿色可持续发展[6-7]。近年来,生物防治因其绿色、安全等特点,越来越为人们所关注。其中,芽孢杆菌是应用最为广泛的生防菌,具有抗逆性强,生物安全性好等突出优点。随着生物防治措施的应用和推广,筛选拮抗芽孢杆菌来防治草莓炭疽病也成为研究热点。吉沐祥等[8]测定了枯草芽孢杆菌和蛇床子素对草莓炭疽病病菌的室内抑菌活性,并结合田间试验的结果,证实枯草芽孢杆菌可用于草莓炭疽病的防治。Nam等[9]从草莓叶片上分离到1株贝莱斯芽孢杆菌(Bacillusvelezensis)NSB-1,发现其对草莓炭疽病具有潜在的防治效果。王美林等[10]研究发现,1 000亿·g-1枯草芽孢杆菌对草莓炭疽病的防治效力与25%多菌灵可湿性粉剂或450 g·L-1咪鲜胺水乳剂的防治效力相当。陈哲等[6]研究复合菌剂对草莓炭疽菌的防治效果时发现,复合菌处理对于草莓炭疽病的防治效果为68.69%,比化学药剂的防治效果提高了23.63%。谷春艳等[11]研究发现,解淀粉芽孢杆菌WH1G对草莓炭疽病菌具有较强的抑制作用,当含菌量为1.0×1010mL-1时,抑制率达89%;将咪鲜胺(0.045 3 mg·L-1)与解淀粉芽孢杆菌WH1G(2.3×106mL-1)按5∶5配比使用时,对病菌抑制的增效作用和防治效果最好,防效达69.94%。
本研究从堆肥中分离对草莓胶孢炭疽菌具有显著拮抗作用的菌株,通过生理生化试验和分子技术对其进行鉴定,对其抗菌活性进行了初步研究,该研究为发掘胶孢炭疽菌引起的草莓炭疽病的生物防治菌株资源奠定了基础。
1 材料与方法
1.1 供试菌株与培养基
LB培养基:蛋白胨10.0 g·L-1,酵母粉5.0 g·L-1,NaCl 10.0 g·L-1,琼脂15.0 g·L-1(仅固体培养基),ddH2O 1 000 mL,pH 7.2~7.4;PDA培养基:马铃薯浸粉5.0 g·L-1,葡萄糖20.0 g·L-1,琼脂14.0 g·L-1,ddH2O 1 000 mL,pH 7.0~7.4。
供试的胶孢炭疽菌(C.gloeosporioides)由台州市农业科学研究院提供。
1.2 试验方法
1.2.1 芽孢杆菌的分离
称取2.0 g土壤或堆肥样品放入100 mL锥形瓶中,加入20 mL 0.9% NaCl溶液,摇匀后80 ℃水浴20 min。取上清液,以10倍稀释制备5个稀释梯度,吸取10-3~10-5稀释梯度的稀释液200 μL涂布LB固体培养基,倒置于30 ℃恒温箱中培养24~48 h。从LB平板上挑取形态不同的单菌落,反复划线分离纯化3次,挑取纯化的菌落于LB培养基中培养24 h,加入甘油并将菌液保藏于-20 ℃冰箱。
1.2.2 拮抗芽孢杆菌筛选
采用平板对峙法筛选拮抗芽孢杆菌[12-13],具体如下:取一块长满胶孢炭疽菌菌丝的PDA平板,用6 mm打孔器制备菌饼,将菌饼转接于PDA平板或LB平板的中央,置于30 ℃恒温培养箱培养1 d。利用十字交叉,在距离菌饼3 cm处的上下同时接种待测芽孢杆菌发酵上清液1.5 μL,在距离菌饼3 cm处的左右同时接种1.5 μL LB液体培养基作为对照,置于30 ℃恒温培养箱培养;隔天观察,用游标卡尺测量草莓胶孢炭疽菌的生长,并计算菌丝生长抑制率。菌丝生长抑制率(%)=[(dc-dt)/dc]×100,其中,dc为对照组菌丝直径,dt为芽孢杆菌处理组菌丝直径。
1.2.3 抑菌试验
制备发酵液:将待测芽孢杆菌接种于LB液体培养基,30 ℃、150 r·min-1摇床培养3 d。将菌液分装于50 mL离心管中,12 000×g离心20 min,收集上清液并过0.22 μm无菌过滤器,4 ℃保藏待用。
无菌发酵上清液的抑制试验参考张紊玮等[13]的方法,具体如下:将JK3菌株的无菌发酵上清液按10%的比例混入50 ℃ LB固体培养基并倒平板,以混入10%比例的LB液体培养基作为对照;在LB平板中央接种草莓胶孢炭疽菌菌饼(直径6 mm),设置3个平行。置于30 ℃恒温培养箱培养,待对照组的草莓胶孢炭疽菌菌丝覆盖平板3/4面积时,用游标卡尺记录各个LB平板上的菌丝直径,并计算无菌发酵上清对菌丝生长的抑制率。菌丝生长抑制率(%)=100×(dc-dt)/(dc-6),其中,dc为对照组菌丝直径,dt为芽孢杆菌处理组菌丝直径。
1.2.4 形态学与生理生化试验测定
按照《常见细菌系统鉴定手册》[14]和《伯杰氏细菌鉴定手册》[15]的方法对拮抗菌的形态和生理生化特征进行鉴定。
1.2.5 PCR扩增与序列测定
抽取待测菌株的基因组,用引物27F(5′-AGAGTTT GATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)进行PCR扩增其16S rDNA序列[16];用引物rpoB-f(5′-AGGTCAACTAGTTCAGTATGGAC-3′)和rpoB-r(5′-AAGAACCGTAACCGGCAACTT-3′)进行PCR扩增rpoB基因保守序列[17];用引物srfAF(5′-TCGGGACAGGAAGACATCAT-3′)和srfAR(5′-CCACTCAAACGGATAATCCTGA-3′)进行PCR扩增srfAA基因序列[18];用引物bmyBF(5′-GAATCCCGTTGTTCTCCAAA-3′)和bmyBR(5′-GCGGGTATTGAATGCTTGTT-3′)进行PCR扩增bymB基因序列[18];用引物bacAF(5′-CAGCTCATGGGAATGCTTTT-3′)和bacAR(5′-CTCGGTCCTGAAGGGACAAG-3′)进行PCR扩增bacA基因序列[18];用引物fenDF(5′-GGCCCGTTCTCTAAATCCAT-3′)和fenDR(5′-GTCATGCTGACGAGAGCAAA-3′)进行PCR扩增fenD基因序列[18];用引物ituCF(5′-GGCTGCTGCAGATGCTTTAT-3′)和ituCR(5′-TCGCAGATAATCGCAGTGAG-3′)进行PCR扩增ituC基因序列[18]。PCR扩增产物经1%琼脂糖凝胶电泳检测后,将目的条带所在胶块切割并送至生物工程(上海)有限公司进行测序。利用NCBI网站的BLAST功能对所测的16S rDNA和rpoB序列进行同源性分析,确定亲缘关系,最后使用MEGA 6.0软件[19]的Neighbor-Joining法[20]构建系统发育树。
1.2.6 抑菌活性物质的稳定性分析
JK3发酵上清液抑菌活性物质的稳定性试验参考孙平平等[21]和张紊玮等[13]的方法,具体如下:
温度稳定性:将JK3菌株的无菌发酵上清分别置于25、40、50、60、70、80、90和100 ℃处理30 min,按5%的比例将不同温度处理的无菌发酵上清混入PDA固体培养基并倒平板,以混入5%比例的LB培养基作为对照;向PDA平板接种胶孢炭疽菌菌饼,置于30 ℃恒温培养箱培养,待对照组的草莓胶孢炭疽菌菌丝覆盖平板3/4面积时,用游标卡尺记录各个PDA平板上的菌丝直径,并计算菌丝生长抑制率。菌丝生长抑制率(%)=100×(dc-dt)/(dc-6),其中dc为对照组菌丝直径,dt为芽孢杆菌处理组菌丝直径。
pH稳定性:用1 mol·L-1的NaOH或HCl,将10倍稀释的JK3无菌发酵上清的pH分别调为2、3、4、5、6、7、8、9、10和11,静置3 h后调回原上清液pH 7.5备用,用上述方法测定不同酸碱度对其抑菌活性的影响。
蛋白酶处理稳定性:将胰蛋白酶、胃蛋白酶和蛋白酶K加入JK3无菌发酵上清液,控制体系中的蛋白酶浓度为20 U·mL-1,置于37 ℃水浴处理1 h,再用前述方法测定不同蛋白酶处理对其抑菌活性的影响。
1.2.7 离体草莓叶片防治试验
草莓叶片准备:植物材料为炭疽易感品种红颊,定植于温室大棚。剪取离芯第2或第3片生长健康、大小相近的复叶,置于保鲜袋带回,立即使用。用75%乙醇棉球轻轻擦拭叶片,保留叶柄2~3 cm。放置2片灭菌湿滤纸于直径20 cm培养皿中,加入1%琼脂块,并将草莓叶柄插入琼脂块中培养。
胶孢炭疽菌孢子准备和接种:将活化培养后的胶孢炭疽菌接于液体培养基PDB中,28 ℃摇床培养2 d;用3层灭菌纱布过滤后收集分生孢子,通过血球计数板计数后用无菌水将其稀释至105mL-1;以无菌水为对照,均匀喷至草莓叶片。每个处理组设置14份草莓叶片。
将JK3菌株的无菌发酵上清原液喷至草莓叶片表面,发酵上清原液喷施时间分别为胶孢炭疽菌孢子接种前24 h、同时(0 h)和接种后24 h,以喷施LB液体培养基作为对照。草莓叶片置于25 ℃光照培养箱培养,8 h/12h(L/D),湿度85%,7 d后观察记录。草莓叶片病变面积比例(%)=病变面积/叶片总面积×100。草莓叶片病变面积防治率(%)=100×(a-b)/a,其中,a为对照组草莓叶片病变面积比例,b为发酵上清液处理组草莓叶片病变面积比例。
2 结果与分析
2.1 胶孢炭疽菌拮抗芽孢杆菌JK3的分离与活性测定
从堆肥等样品中分离纯化了204株芽孢杆菌,利用平板对峙法分别测定分离的芽孢杆菌对胶孢炭疽菌拮抗活性,其中12株具有明显的拮抗活性,JK3菌株对胶孢炭疽菌的拮抗活性最强(图1-A),固体平板上的菌丝生长抑制率为37.12%。
JK3菌株的发酵上清液对胶孢炭疽菌具有较强的抑制活性(图1-B),原液(相当于终浓度稀释10倍)处理组的胶孢炭疽菌几乎不生长,菌丝生长抑制率达93.93%;终浓度稀释100倍处理组,菌丝生长抑制率达到44.01%(图1-C)。
2.2 JK3菌株分子鉴定和生理生化特性
用引物27F/1492R通过PCR扩增JK3菌株的16S rDNA并送测序,测序结果上传GenBank(登录号MN860072);并且在NCBI利用BLAST比对分析。结果显示,JK3菌株与BacillusvelezensisXP-27、BacillusmethylotrophicusHB24和BacillusmethylotrophicusSY33序列最相近,同源性达到100%。用引物rpoB-f/rpoB-r扩增JK3菌株的rpoB基因保守序列并测序,测序结果上传GenBank(登录号MN746370)。用16S rDNA和rpoB基因序列分别构建系统进化树,结果显示,JK3菌株的16S rDNA和rpoB保守序列均与贝莱斯芽孢杆菌聚为一支(图2)。
根据《常见细菌系统鉴定手册》和《伯杰氏细菌鉴定手册》,按照芽孢杆菌分类要求,对JK3菌株进行产酶、碳源利用等生理生化特性分析,结果见表1。JK3能利用山梨醇、D-果糖、纤维二糖、甘油、葡萄糖、蔗糖、淀粉和乳糖,而不能利用D-木糖、半乳糖和鼠李糖;能耐受10% NaCl,并且过氧化氢酶试验、尿素酶试验、淀粉水解试验、明胶液化试验和V-P试验呈阳性(表1)。主要生理生化特性与近源的贝莱斯芽孢杆菌相似(表1)。
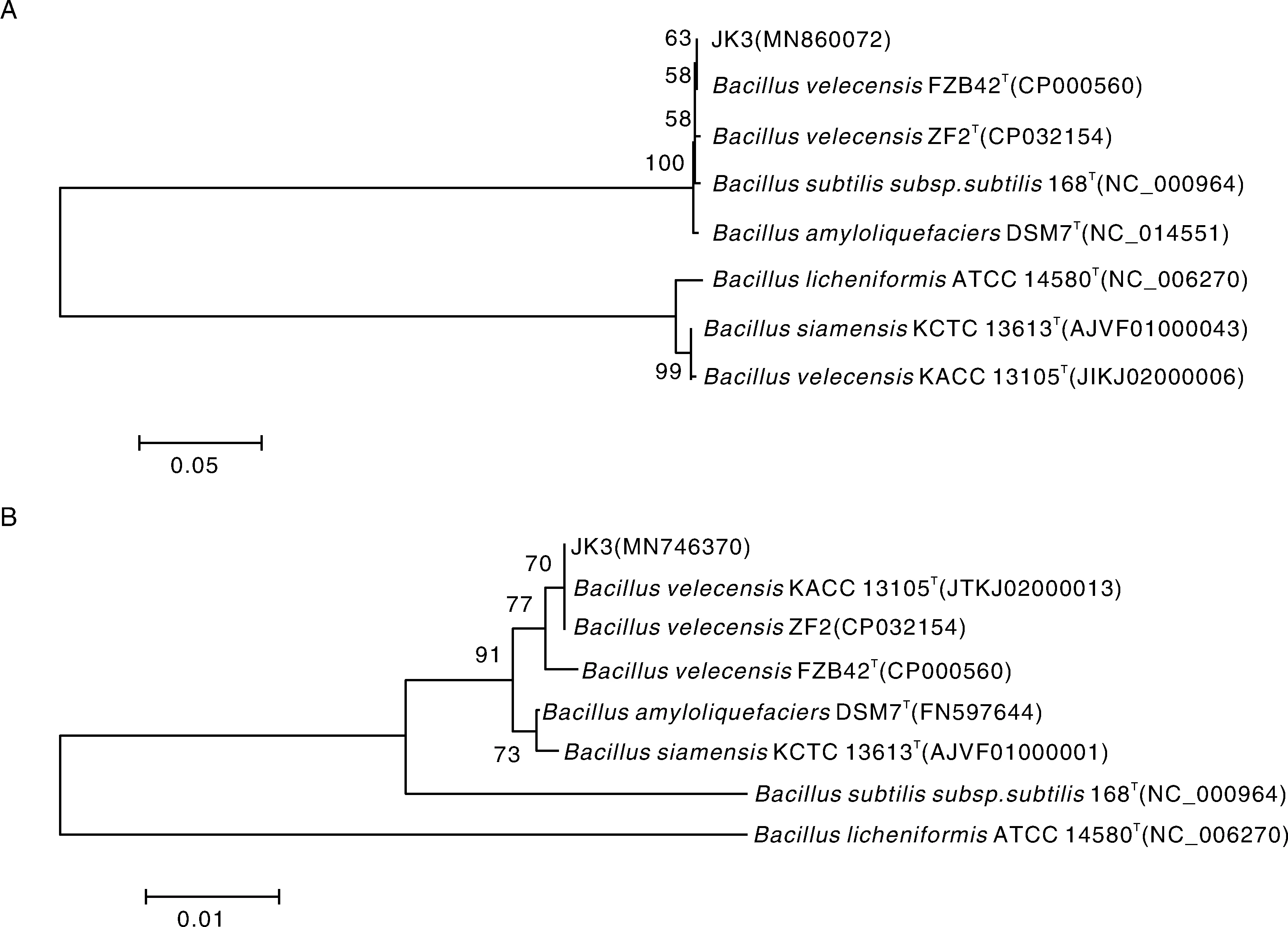
A,基于16S rDNA部分序列构建的系统进化树;B,基于rpoB基因保守序列构建的系统进化树。系统进化树采用邻接法构建;分支数表示1 000次Bootstrap重抽样分析的支持百分比,图例0.05和0.01为遗传距离。Phylogenetic tree constructed based on 16S rDNA partial sequence (A) and rpoB gene conservative sequence (B). The phylogenetic tree was generated using the Neighbor-Joining method. The number of branches indicated the percentage of support for 1 000 bootstrap resampling analysis, the legend 0.05 and 0.01 were the genetic distance.图2 基于16S rDNA序列和rpoB基因保守序列构建的JK3菌株与相近典型菌株的系统进化树Fig.2 Phylogenetic tree constructed based on the 16S rDNA partial sequence and rpoB gene conservative sequence of the isolate JK3 and other related typical strains
表1JK3菌株的生理生化试验
Table 1 Physiological and biochemical characteristics of the isolate JK3

测定指标TestB. velezensisJK3B. velezensisFZB4210% NaCl++革兰氏染色Gram staining++山梨糖醇Sorbitol+—D-果糖D-Fructose+—D-木糖D-Xylose--纤维二糖Cellobiose +—甘油Glycerol +—葡萄糖Glucose ++蔗糖Sucrose++淀粉Starch ++半乳糖Galactose-—鼠李糖Rhamnose-+乳糖Lactose ++吲哚试验Indole test-+V-P试验Voges-Proskauer++甲基红试验Methyl red test-—过氧化氢酶Catalase++淀粉水解Starch hydrolysis++脲酶Urease+—柠檬酸盐利用Citrate utilization-+明胶水解Gelatin hydrolysis+—
-,阴性;+,阳性;—,未见报道.
+, Positive reaction; -, Negative reaction; —, No report.
综合JK3菌株的分子特性和生理生化试验结果,将JK3菌株定为贝莱斯芽孢杆菌(Bacillusveleznsis),命名为贝莱斯芽孢杆菌JK3 (B.velezensisJK3)。
2.3 离体草莓叶片法测定JK3发酵上清液对草莓炭疽病防治效果
图3显示,JK3发酵上清液的喷施时间对防治效果有显著影响。在接种胶孢炭疽菌孢子前24 h或接种胶孢炭疽菌孢子的同时喷施JK3的发酵上清液,防治效果明显,分别达到95.68%和98.99%;而在胶孢炭疽菌孢子接种后24 h喷施发酵上清液,则防治效果差,仅有11.5%。因此,认为JK3菌株发酵上清液对胶孢炭疽菌引起的草莓炭疽病有比较好的预防作用,但治疗作用稍差。
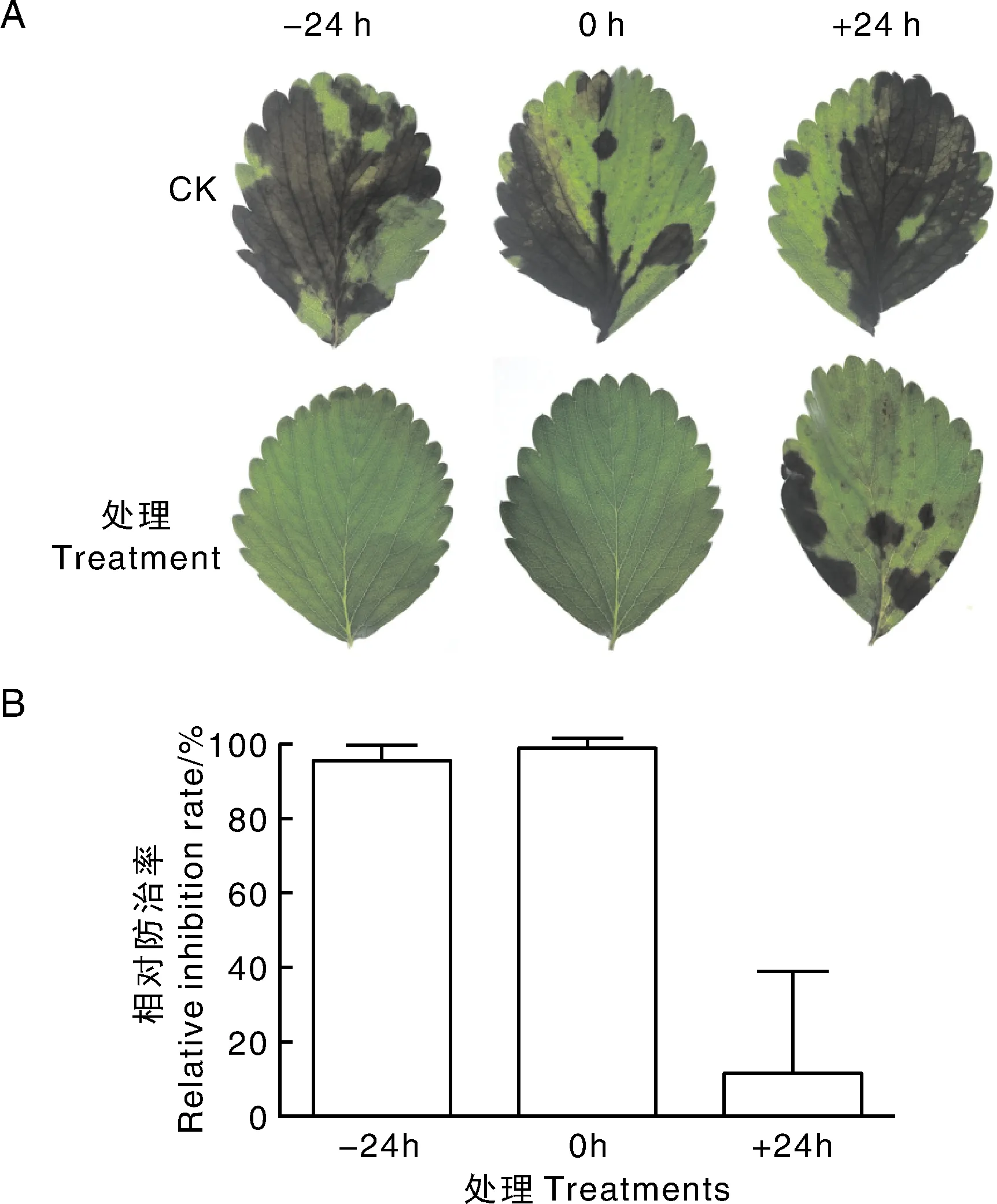
A,喷施JK3发酵上清后的代表性草莓叶片;B,草莓叶片病变面积防治率。-24 h表示接种胶孢炭疽菌孢子前24 h喷施JK3发酵上清液;0 h表示与接种胶孢炭疽菌孢子同时喷施JK3发酵上清液;+24 h表示接种胶孢炭疽菌孢子后24 h喷施JK3发酵上清液。A, Representative lesions on strawberry leaves after treatment with JK3 fermented liquid; B, Inhibition rate of lesion area on strawberry leaves.-24 h, Spraying JK3 fermented liquid 24 h before inoculation with spore suspension of C. gloeosporioides; 0 h, Simultaneous inoculation with spraying JK3 fermented liquid;+24 h, Spraying JK3 fermented liquid 24 h after inoculation.图3 离体草莓叶片试验检测JK3发酵上清液对胶孢炭疽菌的防治效果Fig.3 Inhibitory effect of JK3 fermented liquid on C. gloeosporioides on detached strawberry leaves
2.4 JK3菌株产生的主要活性物质
为了初步探索JK3菌株产生的抗菌活性物质种类,分别测定了JK3菌株发酵上清液的热稳定性、pH稳定性,以及对蛋白酶(胃蛋白酶、胰蛋白酶和蛋白酶K)等的稳定性。结果(图4)表明:JK3菌株发酵上清液pH稳定性好;对50 ℃以上高温略敏感,处理30 min抑菌活性仍然能保留70%以上;胃蛋白酶、胰蛋白酶和蛋白酶K处理后,发酵上清液的菌丝生长抑制活性几乎不受影响,推测JK3产生的主要活性物质可能是非蛋白质类的小分子物质,也有可能产生类似其他芽孢杆菌的脂肽类物质。
由于芽孢杆菌脂肽类物质合成基因比较保守,利用芽孢杆菌脂肽合成基因检测引物,以JK3基因组DNA为模板进行PCR扩增,结果显示,能扩增出Surfactin合成相关基因srfAA、Bacillomycin合成相关基因bymB、Bacillysin合成相关基因bacA、Fengycin合成相关基因fenD、iturin A合成相关基因ituC预期大小片段(图5)。测序结果显示,扩增出的DNA片段均为预期的基因片段。用NCBI中的BLAST比对分析,结果显示,克隆出的基因序列均与来源于贝莱斯芽孢杆菌的相关基因高度同源,表明该菌株具有合成多种脂肽类抗菌物质的能力,推测这些脂肽类物质对草莓胶孢炭疽菌具有抑菌活性。
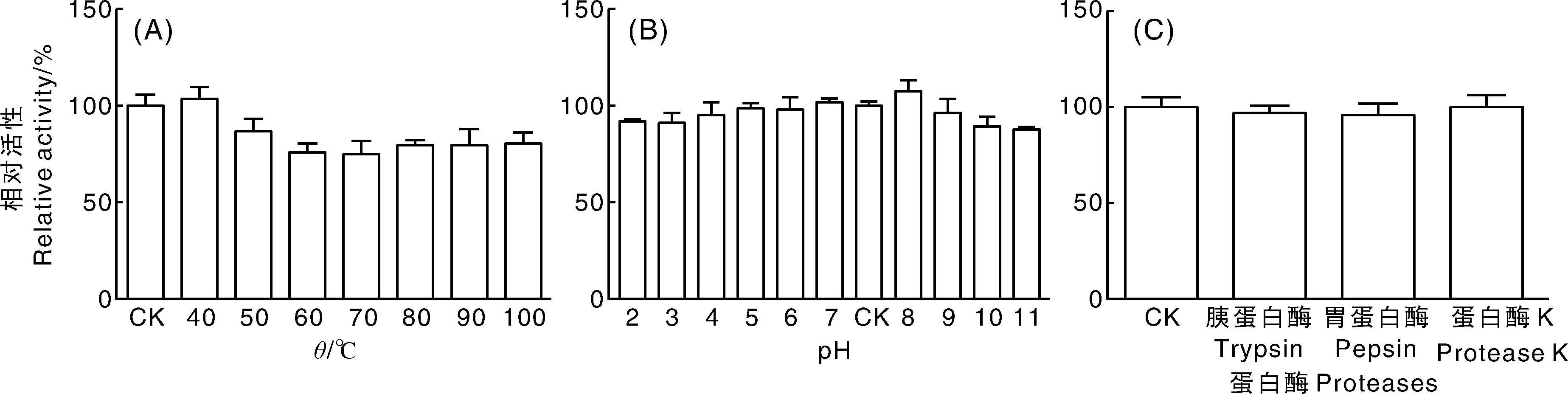
图4 温度(A)、pH(B)和蛋白酶(C)对发酵上清抑菌活性影响Fig.4 Effect of different temperatures (A), pH (B) and proteases(C) on inhibitory stability of JK3 sterile fermented liquid against C. gloeosporioides

M,DNA标准分子质量。M, DNA marker.图5 JK3菌株脂肽合成酶基因PCR凝胶电泳检测结果Fig.5 Detection of lipopeptide biosynthesis genes in the isolate JK3 by PCR
3 结论与讨论
芽孢杆菌分类向来略有争议,2016年,Dunlap等[23]利用全基因组比较对贝莱斯芽孢杆菌、甲基营养型芽孢杆菌、解淀粉芽孢杆菌植物亚种的分类地位进行研究,认为甲基营养型芽孢杆菌、解淀粉芽孢杆菌植物亚种与贝莱斯芽孢杆菌互为同物异名。贝莱斯芽孢杆菌属于枯草芽孢杆菌群,鉴于16S rDNA序列在分类上的分辨率问题[22],本文利用rpoB基因和16S rDNA联合分析,结合生理生化试验结果,将JK3菌株鉴定为贝莱斯芽孢杆菌。
报道显示,贝莱斯芽孢杆菌分布广泛,在河水、农作物土壤、鱼类肠道、植物组织和根际,以及野牦牛牛粪等不同生境中均有发现,并且报道的贝莱斯芽孢杆菌多表现出促植物生长和防治植物病害的作用[22]。本文从堆肥中分离到1株对草莓胶孢炭疽菌具有显著拮抗效果的贝莱斯芽孢杆菌JK3,利用离体草莓叶片测试胶孢炭疽菌引起的草莓炭疽病防治试验,发现JK3发酵上清液对草莓胶孢炭疽菌引起的草莓炭疽病有较好的保护作用,但治疗效果稍差。因此,使用JK3菌株可以用于预防由胶孢炭疽菌引起的草莓炭疽病。由于浙江省草莓炭疽病主要病原菌为胶孢炭疽菌,本文仅测试了JK3对胶孢炭疽菌的拮抗,后一步应该广泛收集植物病原菌,进行JK3抗菌谱试验,明确其可能的作用范围。
室内毒力测定显示,稀释10倍的无菌发酵上清液对胶孢炭疽病菌菌丝生长抑制率达到93%,显示良好的应用潜力。但室内毒力测定结果不一定与田间防效成正比,离体叶片接种试验展示了应用潜力,但由于离体叶片抗病性明显降低,可能与活体效果会有差异。因此,后续需要进一步利用盆栽试验来验证防治效果。芽孢杆菌类产品通常以芽孢的形式进行销售和使用,芽孢杆菌的定殖和原位拮抗决定防治效果,后续试验需要研究JK3在草莓叶面的定殖。本文仅测试了代谢产物的作用效果,如果菌体定殖和代谢产物能够发生协同作用,将显著提高JK3的应用效果。
本试验利用脂肽合成基因引物对JK3菌株的基因组进行扫描,检测到了Surfactin、Bacillomycin、Bacillysin、Fengycin和iturin A的合成相关基因片段,显示JK3菌株具有合成多种脂肽类物质的能力。初步试验显示JK3产生的主要抑菌物质对温度、pH和蛋白酶稳定,显示JK3菌株具有进一步研究的潜力。由于芽孢杆菌的抗菌物质是当前芽孢杆菌研究领域的热点之一,而贝莱斯芽孢杆菌显示了开发成生防制剂的潜力,并且本文研究的JK3菌株对草莓胶孢炭疽菌引起的草莓炭疽病显示出良好的防治效果。因此,JK3研究可以为进一步发掘防治草莓炭疽病生防菌资源奠定基础。
