胆碱类低共熔溶剂选择性分离杨木中木质素的研究
2020-05-28刘金科杨桂花齐乐天陈嘉川
刘金科 杨桂花 齐乐天 薛 玉 陈嘉川
(齐鲁工业大学(山东省科学院)生物基材料与绿色造纸国家重点实验室/制浆造纸科学与技术教育部重点实验室,山东济南,250353)
可再生资源作为石化资源的替代品,已成为世界工业绿色可持续发展的重要原材料[1]。而富含纤维素、半纤维素和木质素成分的木质纤维资源是地球上分布最广泛、含量最丰富的可再生资源[2]。因此,木质纤维资源的高效分离和高值化利用受到越来越多的重视。木质素作为木质纤维的重要组成部分,是自然界中唯一能提供可再生芳香基化合物的非石油资源,具有取代石油等不可再生资源的潜力[3]。但木质素结构复杂,如何高效、高纯度分离木质素是当今科技工作者面临的技术难题之一[4]。Klason 使用64%~72%的浓硫酸水解碳水化合物分离出了Klason木质素,研究发现分离出的木质素产生了一定程度的改性,从而降低了其作为分离产物在工业领域中的应用特性[5];Brauns 等人[6]以无水氯化氢(HCl)作为催化剂,采用有机溶剂分离得到甲醇木质素,但有机溶剂制浆需要高温高压,其工业化应用尚存在一些技术难题。可见,传统木质素分离方法存在木质素溶解率低、溶剂污染大、溶剂难回收等缺陷,从而限制了木质素的高效利用[7]。因此,探寻高效、选择性提取木质素的绿色溶剂显得尤为重要。
低共熔溶剂(DES)是由氢键供体和氢键受体组成的混合物,具有化学稳定性好、不易燃、不挥发、成本低、可重复利用等优点[8]。自2003 年Abbott 等人[9]首次提出后,被认为是一种经济环保的“绿色溶剂”,并在分离过程、化学应用、功能材料和电化学等领域显示出良好的应用前景[10]。近年来使用DES分离生物质原料中木质纤维素的研究报道也逐渐增多。An等人[7]进一步开发了由生物材料组成的胆碱离子液体精氨酸胆碱,并从稻草中提取了超过69%的木质素。Procentese 等人[11]使用氯化胆碱-咪唑制备的DES处理玉米芯水解残渣,去除了88%的木质素。Zhang等人[12]研究发现,氯化胆碱与一元酸、二元酸及多元醇所合成的DES 能够有效地去除玉米芯中的半纤维素和木质素。进一步地,Alvarez-Vasco 等人[13]使用氯化胆碱-乳酸DES,从杉木中提取了58%的木质素,且木质素纯度为95%;其研究还成功地从杨木中提取了78%的木质素,且木质素纯度达到66%。相似的,李利芬[14]用乳酸/氯化胆碱从大青杨中提取了90.4%的木质素。Xia等人[15]在氯化胆碱/甘油(DES)中配位AlCl3·6H2O,设计了3组DES,从杨木中提取了95.46%的木质素,且纯度为(94±0.45)%。Guo 等人[16]用苄基三甲基氯化铵(BTMAC)/乳酸(LA)从玉米芯中提取了63.4%的典型愈创木基(G)、紫丁香基(S)、对-羟基苯基(S)结构的木质素,并且纯度大于96%。Kumar 等人[17]使用甜菜碱-乳酸和氯化胆碱-乳酸两种DES 预处理稻草原料,提取的木质素得率达到60%,且纯度大于90%。以上研究说明,以胆碱类为代表的DES 可以高效、高纯度地提取植物纤维中的木质素,是一种较理想的植物纤维组分提取溶剂。
目前对DES 氢键供体和受体选择范围的相关研究主要集中在氯化胆碱和不同有机酸的组合筛选方面。本研究以杨木为原料,对DES 分子结构进行针对性化学改性,以提高木质纤维组分分离效果和提取效率。探讨不同DES 组成和不同氢键供体含量对植物纤维组分分离效果的影响。同时,本研究对胆碱类DES的氢键受体进行了化学改性,提出一种专用于木质素提取的新型胆碱类DES,并利用傅里叶变换红外光谱仪(FT-IR)、核磁共振波谱仪(NMR)、凝胶渗透色谱仪(GPC)和热重分析仪(TGA)等仪器对提取的木质素进行表征,探究DES 处理对木质素性质的影响。
1 材料与方法
1.1 材料与试剂
速生杨木片取自山东太阳纸业股份有限公司,用磨粉机将其磨碎,然后选出40~60 目木粉,苯-醇抽提8 h 后干燥,作为本实验的木质纤维素原料。氯化胆碱(ChCl,分析纯,98%~101%)、乙醇(分析纯,≥95%)、无水乙醇(分析纯,≥99.7%)、苯(分析纯,≥99.5%)、吡啶(分析纯,≥99.5%)、醋酸酐(分析纯,≥98.5%)、乙醚(分析纯,≥99.5%),国药集团化学试剂有限公司;乳酸(Lac,分析纯,85%~90%)、溴化钾(KBr,光谱纯,≥99%),天津科密欧化学试剂有限公司;甲酸(For,分析纯,85%)、乙酸(Ace,分析纯,99.5%)、丙酸(Pro,分析纯,≥99.5%)、乙酰丙酸(Lev,分析纯,99%)、甲基亚砜(DMSO,99.9%),上海麦克林生化科技有限公司;亚氯酸钠(分析纯,≥80%)、尿素(U,分析纯,≥99%),天津市大茂化学试剂厂;氢氧化钾(分析纯,≥85%)、四氢呋喃(THF,HPLC级,≥99.8%),天津恒兴化学试剂有限公司;硫酸(分析纯,95%~98%),烟台远东精细化工有限公司;硝酸(65%~68%),莱阳经济技术开发区精细化工厂;磨木木质素(MWL),实验室自制。
1.2 实验仪器
粉碎机(青岛即墨市大华机筛厂);真空干燥箱(DZF6092,上海一恒科学仪器有限公司);电热恒温水浴锅(HWS-26,上海一恒科学仪器有限公司);集热式恒温加热磁力搅拌器(DF-101S,巩义市予华仪器有限责任公司);离心机(TG16-WS,上海卢湘仪离心机仪器有限公司);油浴锅(OSB-2200,上海爱朗仪器有限公司);旋转蒸发仪(N-1300,上海爱朗仪器有限公司);高温马弗炉(SX2-2.512TP,济南精锐分析仪器有限公司);凝胶渗透色谱仪(Waters e 2695,美国沃特世公司);核磁共振波谱仪(Bruker AVANCEIIIHD 500,布鲁克科技有限公司);热重分析仪(TA TGA Q50,德国耐驰公司);傅里叶变换红外光谱仪(Bruker Vertex70,布鲁克科技有限公司)。
1.3 DES的合成
低共熔溶剂DES 合成参照文献[13],将氯化胆碱(ChCl)和氢键供体(甲酸、乙酸、丙酸、乳酸、乙酰丙酸、尿素)按不同的摩尔比混合,在65℃下反应2 h,使其充分混合呈现为透明液体,真空干燥后制得不同DES:氯化胆碱-甲酸(ChCl-For)、氯化胆碱-乙酸(ChCl-Ace)、氯化胆碱-丙酸(ChCl-Pro)、氯化胆碱-乳酸(ChCl-Lac)、氯化胆碱-乙酰丙酸(ChCl-Lev)和氯化胆碱-尿素(ChCl-U)。将所制DES 干燥保存,供后续实验用。
乳酸胆碱合成参照文献[18],将氯化胆碱和氢氧化钾加入500 mL 圆底烧瓶,并在乙醇溶剂中水浴加热至60℃,反应4 h,然后过滤取上层清液加入乳酸,反应4 h 后减压旋转蒸发去除溶剂,干燥后得到乳酸胆碱(ChLac),其改性机理如图1所示。改性后得到的乳酸胆碱与乳酸以不同摩尔比混合,在65℃下反应2 h,使其充分混合呈现为透明液体,真空干燥后制得乳酸胆碱-乳酸(ChLac-Lac)。
1.4 DES提取木质素
DES溶解木质纤维原料提取木质素的方法参照文献[13]。在100 mL 耐压瓶中(固液比为1∶30)将不同氢键供体(HBD)和ChCl 混合形成的DES 与经过抽提过的40~60 目杨木木粉混合,在120℃下恒温油浴反应12 h将木质素充分分离;反应结束后,将耐压瓶取下加入20 mL 无水乙醇终止反应,并进行过滤分离,分离所得固体残渣(综纤维素)先用无水乙醇洗涤2~3 次,再用去离子水洗涤2~3 次,最后将固体残渣放置于105℃烘箱中干燥至恒质量,称其质量,计算得率。向分离所得的滤液中加去离子水至1000 mL,静置24 h待木质素完全沉积后进行离心分离,将所得木质素放置于60℃真空干燥箱中干燥至恒质量,称其质量,计算提取率及纯度。DES分离提取杨木木质素的实验流程图如图2所示。
其中,固体残渣(综纤维素)得率、木质素提取率按照式(1)和式(2)计算。

式中,X1为综纤维素得率,%;m1为综纤维素的质量,g;m0为所用原料的质量,g。

式中,X2为DES木质素提取率,%;m2为提取木质素的质量,g;m0为所用原料的质量,g;a为原料中木质素的含量,%。
1.5 杨木原料的组分分析
实验中原料组分含量以及DES 分离后组分含量均参照国家标准测定,其中水分含量测定方法参照GB/T 2677.10—1995;灰分含量测定方法参照GB/T 2677.3—1993;苯-醇抽出物含量测定方法参照GB/T 2677.6—1994;纤维素含量测定方法参照GB/T 2677.10—1995;综纤维素含量测定方法参照GB/T 2677.10—1995;酸不溶木质素含量测定方法参照GB/T 2677.8—1994;酸溶木质素含量的测定方法参照GB/T 10337—1989。

图1 ChLac改性机理

图2 DES分离提取杨木木质素的流程图
1.6 DES提取的木质素的表征
1.6.1 FT-IR分析
取1 mg 经过DES 提取分离的木质素样品,加入100 mg干燥的KBr混合,经玛瑙研钵研磨后压片,置于傅里叶变换红外光谱仪中测试,扫描范围为250~4000 cm-1,扫描次数为16次。
1.6.2 DES提取的木质素的乙酰化
取50 mg经过DES提取分离的木质素溶于4 mL吡啶/醋酸酐(体积比为1∶1)混合液中,在避光条件下常温搅拌24 h后,停止反应,然后将木质素溶液滴入乙醚中沉淀出乙酰化木质素,并用乙醚洗涤沉淀物多次直至无吡啶气味,最后置于40℃的真空干燥箱中干燥,干燥后的乙酰化木质素样品保存于放有五氧化二磷(P2O5)的真空干燥箱中备用。
1.6.3 核磁共振碳谱分析(13C NMR)
取30 mg 乙酰化DES 提取的木质素和磨木木质素(MWL),用氘代二甲基亚砜(DMSO-d6)溶解,在Bruker 500 MHz NMR 光谱仪上使用Q-CAHSQC脉冲程序(松弛延迟设定为6 s),25℃下在δ=0~160 收集13C维度1024个数据点,记录两种木质素的13C碳谱。
1.6.4 相对分子质量测定
通过凝胶渗透色谱仪(GPC)测定DES提取的木质素和MWL 的相对分子质量分布。取约10 mg 样品,用四氢呋喃(THF)溶解,再用0.22 μm 滤头过滤。将配制好的样品用Waters E-2695 系统进行检测;洗脱液为等比例的100% THF,流速0.6 mL/min,柱温保持在45℃,通过0.45 μm过滤器注入样品,并使用245 nm可变波长检测器检测洗脱液中的分级木质素。
1.6.5 热稳定性(TGA)分析
取5~10 mg 木质素样品置于坩埚中,在热重分析仪中进行测试。测试条件为:从室温开始,在氮气环境中以10℃/min的升温速率升温至800℃。
2 结果与讨论
2.1 杨木原料组分分析
实验用木质纤维原料为杨木,组分分析检测结果如表1所示。其中主要组分纤维素、半纤维素和木质素的含量分别为45.62%、32.05%和21.90%。为了有效分离杨木纤维原料组分,采用DES 先将杨木纤维原料进行全组分溶解,然后加入沉淀剂提取木质素。由表1 中数据可知,DES 提取综纤维素得率理想最高值为77.67%,DES 提取木质素得率理想最高值为21.90%。由于DES 处理过程中,半纤维素易发生分解[13],而纤维素损伤较小,因此DES综纤维素得率应不低于纤维素含量,即45.62%。

表1 杨木纤维原料的各组分含量 %
2.2 不同氢键供体对DES溶解能力的影响
图3 为不同氢键供体ChCl 类DES 对杨木综纤维素得率和木质素提取率的影响。从图3可以看出,来自于不同氢键供体形成的DES 处理对综纤维素得率有明显影响,其中ChCl-U 类DES 处理杨木得到的综纤维素得率最高达95.49%,且该数值远高于杨木原料中综纤维素含量,可见,ChCl-U 类DES 溶解效果较差,未能达到原料纤维组分的全溶解,因此得到的综纤维素中仍含有较多的木质素。而ChCl-For类DES处理杨木得到的综纤维素含量低于原料中纤维素含量,这表明DES 处理过程中发生了碳水化合物降解,导致了部分综纤维素溶解损失。可见,较理想的DES处理效果是图3(a)中综纤维素得率介于原料纤维素含量45.62%和综纤维素含量77.67%之间,同时图3(b)木质素提取率接近于原料木质素含量。由图3(a)可知,ChCl-Ace、ChCl-Pro、ChCl-Lac 和ChCl-Lev 类DES 处理后所得综纤维素得率处于上述区间,特别是当氢键供体为乳酸时,综纤维素得率为48.83%,接近于原料中纤维素含量,这表明ChCl-Lac 类DES 可溶解分离出木质纤维中大部分半纤维素和木质素,而保留纤维素,分离效果较优。
图3(b)表明,不同氢键供体构成的DES 对木质素的溶解能力有所不同。ChCl-U 类DES 处理后木质素提取率仅为2.5%,溶解效果较弱,而ChCl-For 类DES 处理后木质素提取率达到了最高值91.73%,但图3(a)中显示其对综纤维素提取效率较低,可能存在着纤维素水解析出的影响;ChCl-Ace、ChCl-Pro、ChCl-Lac和ChCl-Lev类DES处理后对木质素分离均有较好的效果,其中,当氢键供体为乳酸时木质素的溶解效果最好,木质素提取率为57.59%。
上述结果表明不同氢键供体组成的DES 对木质纤维组分的溶解性存在明显差异,其中ChCl-Lac 具有较佳的综纤维素和木质素分离效果,因此后续实验主要探讨了ChCl-Lac 类DES 对原料纤维组分溶解分离提取的效果。
2.3n(ChCl)∶n(Lac)对原料组分分离效果的影响
为优化ChCl-Lac 类DES 的组分分离效果,探讨了n(ChCl)∶n(Lac)的ChCl-Lac 类DES 对木质素提取率的影响,实验结果见图4。由图4(a)可知,随着Lac 量的增加,综纤维素得率缓慢降低,原因是DES处理后大部分半纤维素被溶解进入液相[13],而纤维素几乎未发生降解;氢键供体的增加使得DES 的酸性提高,从而使残存的半纤维素进一步发生降解,因而综纤维素得率逐步降低,并在摩尔比1∶2~1∶10区间内逐渐贴近虚线(45.62%);而当n(ChCl)∶n(Lac)为1∶12 时,分离得到的DES 综纤维素含量低于原料中纤维素含量,这说明乳酸含量过高,加速了纤维素的酸性降解。
从图4(b)中可以看出,随着Lac量的增加,木质素提取率呈现出先降低后升高的趋势。当n(ChCl)∶n(Lac)为1∶2 时木质素提取率为59.70%;而随着氢键供体量的增加,当n(ChCl)∶n(Lac)为1∶6时木质素提取率降低至48.71%;随后木质素提取率随Lac比例的增加而提高,并在n(ChCl)∶n(Lac)为1∶10时,ChCl-Lac 类DES 对木质素的溶解效果达到最好,此时木质素提取率达最高值84.38%。继续增加氢键供体量,木质素提取率开始下降,下降低至82.57%,这表明DES 体系中过多的氢键供体会降低木质素的分离效率。
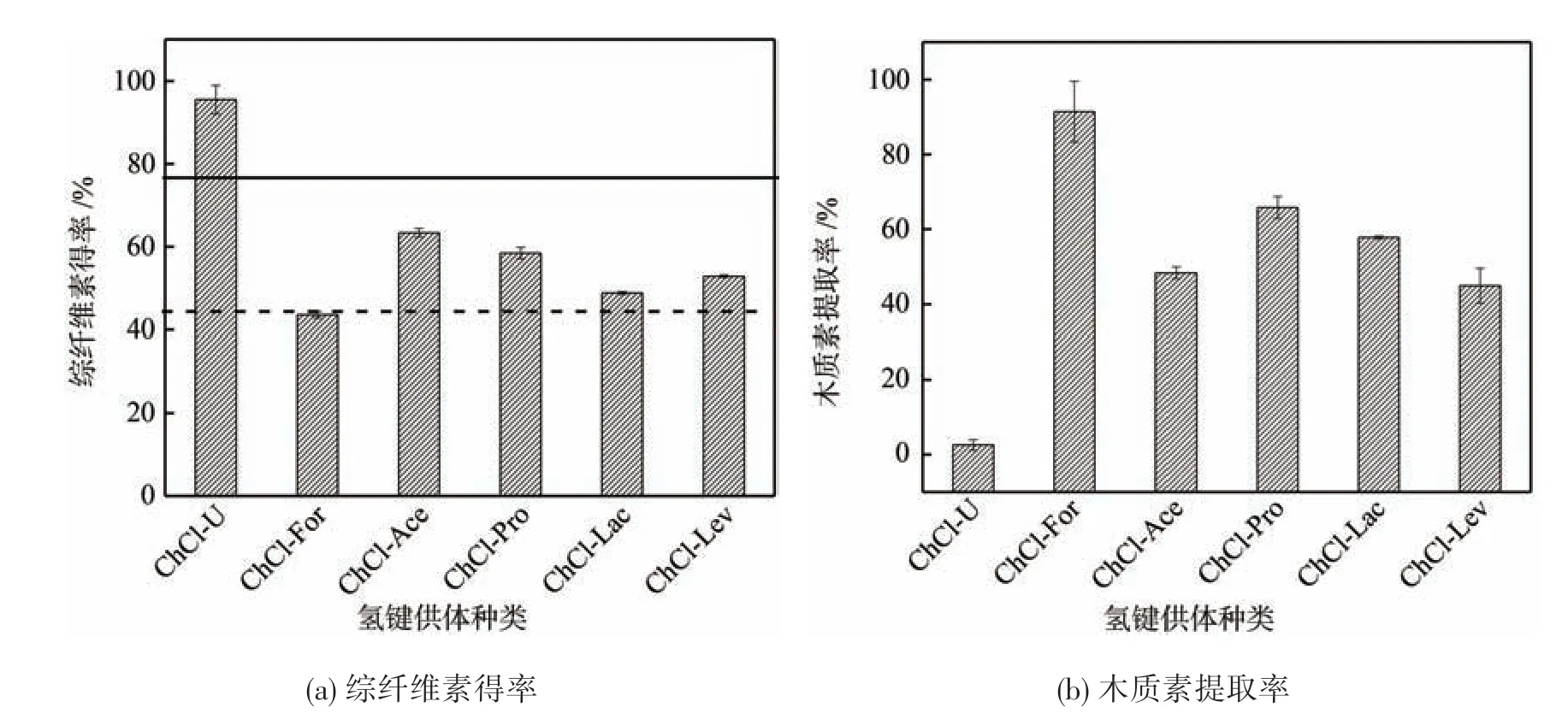
图3 不同氢键供体ChCl类DES对杨木综纤维素得率、木质素提取率的影响
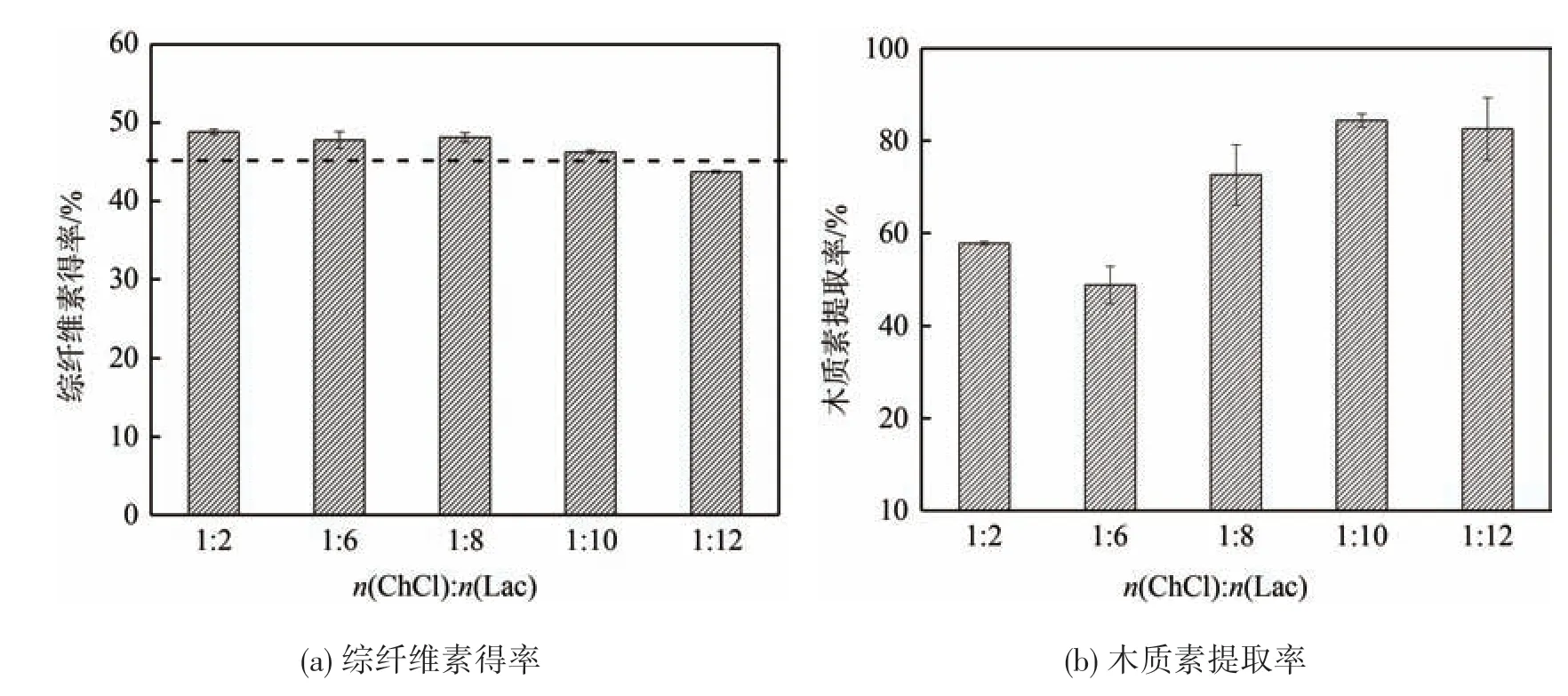
图4 n(ChCl)∶n(Lac)对杨木综纤维素得率、木质素提取率的影响

图5 ChCl-Lac和ChLac-Lac类DES对杨木综纤维素得率、木质素提取率的影响
可见,氢键供体含量会影响ChCl-Lac 类DES 对杨木纤维原料的溶解效果,适当增加氢键供体比例,可以提高ChCl-Lac 类DES 对木质纤维组分的分离效果,较佳的n(ChCl)∶n(Lac)为1∶10,此摩尔比下的ChCl-Lac 对杨木木质素具有较好的分离效果,综纤维素得率为46.26%,木质素提取率为84.38%,木质素纯度为89.82%。
2.4 化学改性对ChCl-Lac 类DES 溶解分离木质纤维组分的影响
DES主要通过其中存在的强氢键作用使木质纤维组分溶解分离,其中氢键受体部分的阴离子是氢键作用的主要基团。但ChCl 中的氯离子电荷分布过于集中,不利于DES 与植物纤维之间进一步作用,进而降低组分溶解分离效率[19],而且氯离子对生产过程中的设备会产生一定程度的腐蚀[20]。因此,针对此问题,本研究对ChCl 类DES 进行了化学改性,以有机酸根置换其中氯离子,从而得到一种低卤素含量的DES ChLac-Lac(摩尔比为1∶10)。改性后得到的ChLac-Lac的pH值和含水量与ChCl-Lac相近,但黏度从0.87 Pa·s 提升到1.40 Pa·s,这说明改性后DES 的氢键作用增强,从而有利于与植物纤维的充分结合,进而提升木质素的提取效果。
图5 为ChCl-Lac 和ChLac-Lac 类DES 对杨木综纤维素得率、木质素提取率的影响。从图5 可以看出,与ChCl-Lac 类DES 相比,经过改性的ChLac-Lac 类DES 对原料的溶解分离能力增强,综纤维素得率从46.26%提高到48.16%。木质素提取率提高,木质素提取率从84.38%提高到了90.13%。同时,表2中数据显示,DES 处理提取的木质素纯度较高,而且DES 经过化学改性后提取的木质素纯度进一步得到提高。可见,经过化学改性的ChLac-Lac 类DES是一种较好的木质纤维组分分离提取剂。
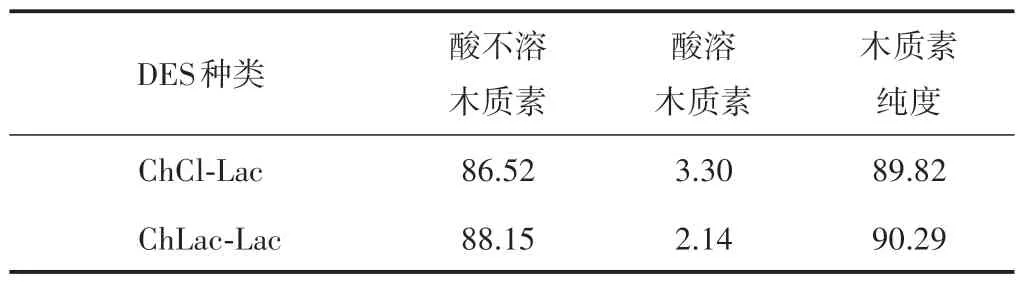
表2 不同DES提取的木质素纯度分析 %
2.5 FT-IR分析
红外光谱可以识别官能团和化合物类别验证木质素样品。图6 为DES 提取的木质素与MWL 的红外光谱图。DES 提取的木质素和MWL 的红外谱图解析如表3所示。从图6可以看出,与MWL相同,DES木质素在1600、1510、1424 cm-1处对应芳环骨架振动,为木质素的典型特征峰,并且在1462 cm-1为C—H 变形和芳环振动的结合,表明经过DES 处理分离提取的木质素苯环结构没有被破坏[21]。在1325、1220、1120 cm-1等处有较高强度的谱峰,说明DES 提取的木质素组分中含有较多的紫丁香基结构单元(S 型),在1270 cm-1处的较弱峰对应愈创木基中C—O 伸缩振动,表明DES 提取的木质素组分中含有少量的愈创木基结构单元(G 型),这表明DES 提取的木质素属于G、S 型。在1033 cm-1处对应碳水化合物中C—H弯曲振动,与MWL 相比DES 提取木质素的峰很小,说明DES 提取的木质素中碳水化合物含量更少,木质素纯度更高,这与ChLac-Lac 类DES 处理可以提高木质素纯度的结论相吻合。
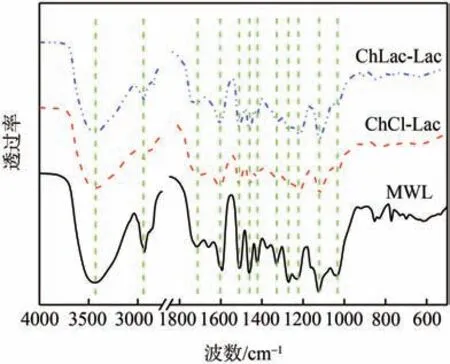
图6 DES提取的木质素与MWL的FT-IR谱图

表3 DES提取的木质素和MWL的FT-IR谱图解析
2.6 核磁共振碳谱分析(13C NMR)
对ChCl-Lac 和ChLac-Lac 在摩尔比为1∶10 提取的木质素进行核磁共振碳谱表征,谱图和化学位移对应的谱峰归属解析如图7 和表4 所示。从图7(a)和图7(b)中可以看出,在δ=90~102 处几乎没有任何信号峰,表明经过DES 处理后提取的木质素中碳水化合物含量很少,进一步说明DES 提取的木质素纯度高,碳水化合物杂质含量少。另外,δ=72~90 之间信号峰的缺失,表明DES 提取的木质素中几乎无醚键存在[13],这说明在处理过程中木质素发生了β-O-4 醚键的断裂,也证明了DES 处理可以降解木质素大分子,获得相对分子质量较小的木质素。图7 中在δ=171~174 处的强吸收峰表明DES 提取的木质素大分子中存在许多酚羟基;在δ=103~108、131.2 和151.8 处的吸收峰,表明DES 提取的木质素分子中存在许多紫丁香基结构单元;在δ=54~57 处的吸收峰,表明DES提取的木质素分子有甲氧基的存在;在δ=52~54处的吸收峰,表明DES 木质素分子中有β-β键或β-5 键的存在[22]。此外,与图7(a)相比,图7(b)在δ=54~57 区间存在的峰较多,表明ChLac-Lac 木质素分子中含有较多不同种类的甲氧基。结果表明,经过DES 处理提取的木质素分子基本结构单元主要为紫丁香基结构单元。
2.7 相对分子质量分析
采用凝胶渗透色谱仪(GPC)对摩尔比为1∶10的DES 提取的木质素进行相对分子质量分布分析,结果如表5 所示。从表5 中可以看出,经过两种DES处理后提取得到的木质素与MWL 相比,呈现出更低和更窄的相对分子质量分布,表明在两种DES 分离木质素时,木质素大分子结构间连接键β-O-4 醚键发生了断裂,使木质素降解为小分子片段,使其结构变得相对简单,并且不会发生缩合反应,这与13C NMR谱图的分析结果一致。从表5 中还可以看出,与ChCl-Lac 类DES 提取的木质素相比,ChLac-Lac 类DES 提取的木质素相对分子质量更低,表明经过ChLac-Lac类DES处理后木质素的醚键断裂更加明显。与MWL 相比,经过DES 处理提取的木质素具有较低的相对分子质量分布,而且由于醚键比C—C 键更容易受到破坏而使木质素分子间醚键减少,从而减少木质素的缩合而使DES 提取的木质素具有更好的稳定性。可见,DES分离提取的木质素具有独特的结构特性,使其具有更加广泛的应用价值。

表4 DES提取的木质素的13C NMR谱图解析
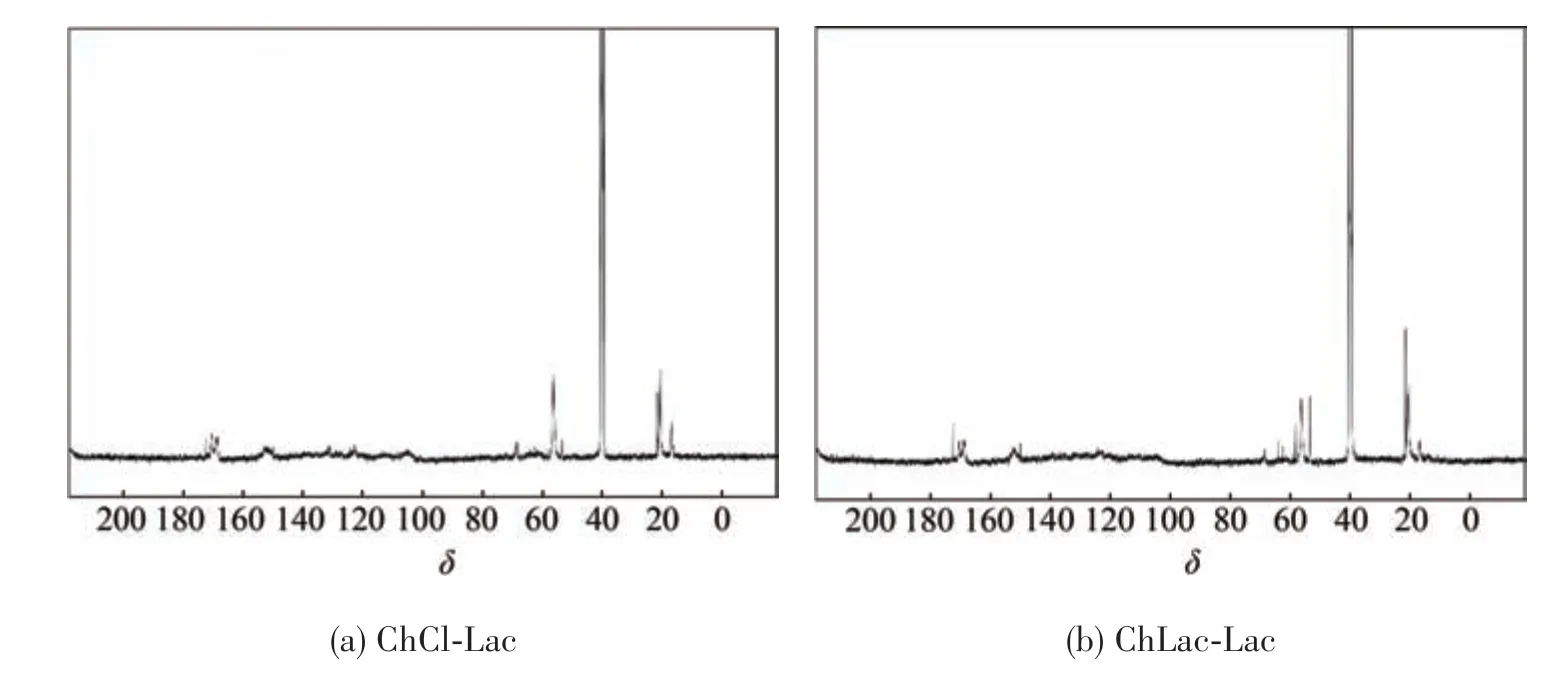
图7 不同DES提取的木质素的13C NMR谱图
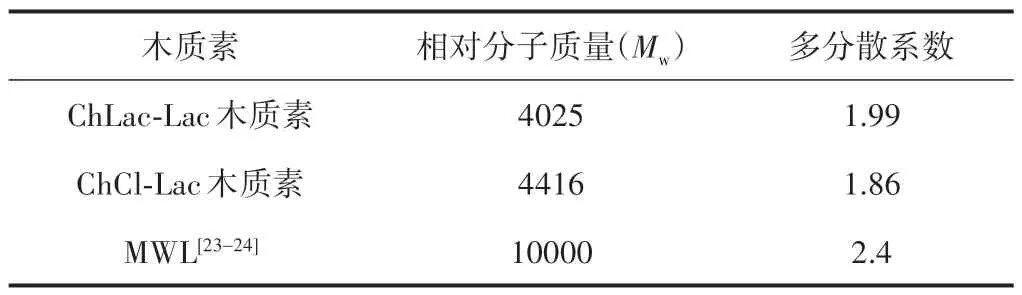
表5 DES提取的木质素和MWL的相对分子质量及其分布
2.8 热稳定性分析(TGA)
木质素分子的热化学降解是理解其化学结构和性质之间关系的重要途径。图8为不同处理条件下提取所得木质素的TGA 曲线。从图8可以看出,两种DES提取的木质素降解曲线基本重合,表明两种木质素的降解行为基本一致。MWL 和两种DES 提取的木质素的降解温度范围几乎相同,根据降解温度主要分为3个阶段,即木质素初始降解阶段(80~160℃)、木质素主要降解阶段(200~400℃)和木质素炭化阶段(400~600℃)。木质素初始降解阶段为木质素样品中水分的蒸发和木质素小分子的部分降解;木质素主要降解阶段为木质素网状苯丙烷型高分子类物质受热裂解生成小分子物质的过程[25];木质素炭化阶段为木质素分子内部连接键逐渐发生断裂,而且在此阶段木质素分子连接键断裂之后的残渣在温度升高过程中进一步发生反应变成焦炭,直到600℃后焦炭质量基本稳定不再发生反应[26]。与MWL 相比,DES 提取的木质素在600℃有更多的残余物,这说明经过两种胆碱类DES处理后木质素的稳定性更好。

图8 不同DES提取的木质素和MWL的TGA曲线
3 结论
本研究以杨木为原料,对低共熔溶剂(DES)分子结构进行针对性化学改性,以提高木质纤维组分分离效果和提取效率。探讨不同DES 组成和不同氢键供体含量对杨木纤维组分分离效果的影响。
3.1 不同氢键供体种类和摩尔比的氯化胆碱(ChCl)类DES 对杨木原料组分分离的效果不同,其中氯化胆碱-乳酸(ChCl-Lac)在摩尔比为1∶10条件下表现出最优的综纤维素和木质素分离效果,其综纤维素得率为46.26%,木质素提取率为84.38%,木质素纯度为89.82%。
3.2 将ChCl-Lac 改性后制得的新型低共熔溶剂乳酸胆碱-乳酸(ChLac-Lac)可进一步提高其对木质纤维组分的分离效果,其综纤维素得率为48.16%,木质素提取率为90.13%,木质素纯度为90.29%。
3.3 DES 处理后得到的木质素纯度高、杂质少、热稳定性好,同时,处理后所得木质素分子发生β-O-4醚键的断裂,生成小分子木质素,使得相对分子质量降低,分布变窄。
