马氏珠母贝水通道蛋白基因AQP4 cDNA克隆和表达分析
2020-05-25潘肖兰刘惠茹许濛许瀚之张华何毛贤
潘肖兰, 刘惠茹, 许濛, 许瀚之, 张华, 何毛贤
海洋生物学
马氏珠母贝水通道蛋白基因cDNA克隆和表达分析
潘肖兰1, 2, 3, 刘惠茹1, 2, 3, 许濛1, 2, 3, 许瀚之1, 2, 3, 张华1, 4, 何毛贤1, 4
1. 中国科学院热带海洋生物资源与生态重点实验室, 中国科学院南海海洋研究所, 广东 广州 510301; 2. 广东省应用海洋生物学重点实验室, 广东 广州 510301; 3. 中国科学院大学, 北京 100049; 4. 中国科学院南海生态环境工程创新研究院, 广东 广州 510301
水通道蛋白4(aquaporin4, AQP4)是一类被动运输水的通道蛋白。本研究根据转录组测序获得的马氏珠母贝片段, 采用RACE技术获得了的全长cDNA, 命名为, 其5′非翻译区(untranslated region, UTR)为114bp, 3′UTR为839bp, 开放阅读框(open reading frame, ORF)为858bp, 编码285个氨基酸。PfAQP4含有6个α螺旋跨膜区、5个环、1个主要内嵌蛋白(major intrinsic protein, MIP)结构域、2个NPA(Asn-Pro-Ala)基序, 属于AQP1-like型。利用qPCR技术分析在不同组织、不同发育时期以及盐度胁迫条件下的mRNA表达模式。结果显示: (1)在所有被检测组织中均表达, 其中在闭壳肌、足和鳃中表达量较高; (2)在不同的发育时期均有表达, 其表达量整体呈现先升高后降低的趋势, 其中在2—4细胞期表达量最高, 在眼点幼虫期表达量最低; (3) 在高盐度组(36‰)盐度胁迫24、72、120h后,表达量显著上升, 在168h降至对照组水平; 在低盐(16‰)组,表达量在24h显著上调, 在72h恢复至对照组水平, 说明盐度影响鳃组织中的表达量, 也表明在马氏珠母贝渗透压调节中起着非常重要的作用。
马氏珠母贝; 水通道蛋白4; 盐度胁迫; 渗透压调节
马氏珠母贝()是一种生活于浅海的狭盐性贝类, 适宜盐度范围为19.61‰~36.65‰(王如才等, 1993)。浅海是大陆架上方水体, 其盐度容易受降雨以及长期无降雨的影响, 变化范围通常较大。对于生长在浅海的物种来说, 及时响应外界海水的盐度变化尤为重要。在水产动物中, 鱼类渗透压调节机制研究得较为深入, 部分鱼类的渗透压调节机制已经得以阐明(林浩然, 1999), 而关于海水无脊椎动物渗透压调节的研究主要集中在甲壳类(Péqueux, 1995; Mcnamara et al, 2012)。海洋贝类马氏珠母贝的此类研究还未见报道, 对其渗透压调节的研究有助于理解其对盐度变化的响应。
水通道蛋白(aquaporin, AQP)在渗透压调节中起重要作用, 该蛋白主要位于细胞膜, 通过响应外界环境盐度变化来指导水分的运输, 属于主要内嵌蛋白家族(major intrinsic protein, MIP)。CHIP28是一个28kD的疏水性跨膜蛋白(Denker et al, 1988), 1991年, 该蛋白被证实具有水运输功能并被更名为水通道蛋白1(aquaporin1, AQP1), 由此水通道蛋白正式被人类发现(Preston et al, 1992; Connolly et al, 1998)。人体中发现了13种AQP, 编号为0—12, 分为四种类型, 分别是AQP1-like(0、1、2、4、5、6), 只运输水, 水通道蛋白6(aquaporin6, AQP6)还可运输NO3+; AQP8-like(8), 可运输水和H2O2; AQP3- like(3、7、9、10), 可运输水和甘油; AQP11-like(11、12), 只含有一个NPA (Asn-Pro-Ala)序列, 目前对水的运输能力并不清楚(Campbell et al, 2008; Ishibashi et al, 2009; Soto et al, 2012)。AQP结构以AQP1最为典型, 含有5个环(A—E)、6个跨膜区和两个同向重复单元, 每个同向重复单元分别含有一个NPA序列。E环NPA序列前有一个汞抑制位点(Csy) (Hasegawa et al, 1994), 当有机汞或离子汞与该位点结合后可抑制水的运输, AQP4不存在该位点(Parisi et al, 2007)。通常4个AQP亚基聚成一个四聚体, 每个单体中的两个NPA序列折叠形成独特的具有高度选择性的“沙漏”形状狭窄通道(Agre et al, 1993), 通道中有“芳香族/精氨酸(aromatic/ arginine, ar/R)选择性过滤器, 只允许水分子排成单一纵列以适当角度顺势通过(Agre et al, 2002; Ho et al, 2009)。AQP4水通透性最强(安皓, 2017)。在哺乳动物中, AQP4与许多疾病的发生发展有关, 特别是在创伤性脑损伤和脑卒中后引起的脑水肿的发展过程中起主要作用(Huang et al, 2007)。
在马氏珠母贝中, 关于的研究还未见报道, 对于在盐度胁迫下的表达特性还未知。本文通过RACE技术从马氏珠母贝中获得一个()的cDNA全长序列, 分析序列特性后通过qPCR技术分析在马氏珠母贝不同组织、不同发育时期及不同盐度胁迫时长下的mRNA表达情况, 为进一步研究马氏珠母贝的渗透压调节机制奠定基础。
1 材料与方法
1.1 实验材料
实验用的马氏珠母贝为总重在7g左右的11月龄贝, 养殖于深圳市大鹏澳海区。
1.2 PfAQP4克隆
利用Magen公司通用RNA提取试剂盒提取全组织的总RNA, 根据转录组测序得到的cDNA片段设计5′和3′RACE引物(表1), 并进行巢式PCR, PCR产物经1.5%琼脂糖凝胶电泳, 用Gel Extraction Kit (Omega)切胶回收, 回收的PCR产物用pMD™19-T Vector Cloning Kit(Takara)进行TA连接后转化Trans5α Chemically Competent Cell(TransGen), 蓝白斑筛选重组子测序。

表1 本研究所用的引物序列
1.3 生物信息学分析
用NCBI ORFfinder(https://www.ncbi.nlm.nih. gov/orffinder/)查找的开放阅读框(open reading frame, ORF); 用prettyseq(http://www. bioinformatics.nl/emboss-explorer/)进行序列展示; 用ProtParam(https://web.expasy.org/protparam/)分析蛋白质的理化性质; 用ProtScale(https://web.expasy. org/cgi-bin/protscale/protscale.pl)分析蛋白质的亲水性; 用TMpred(https://embnet.vital-it.ch/software/ TMPRED_form.html)进行跨膜区预测; 用Origin 2018软件进行跨膜区数据处理; 用SMART(http:// smart.embl-heidelberg.de/)分析蛋白质的保守结构域; 用MatGAT2.01进行氨基酸一致性分析; 用clustalx软件进行多序列比对; 用BoxShade(https://embnet. vital-it.ch/software/BOX_form.html)和Adobe Illustrator CS6对多序列比对数据进行处理; 用SWISS- MODEL(https://www.swissmodel.expasy.org/)进行蛋白质三级结构预测; 用PyMOL软件处理三级结构模型; 用MEGA6以N-J法构建系统进化树。
1.4 盐度胁迫实验
将200只马氏珠母贝随机分为5组, 盐度梯度设置为16‰、20‰、29‰、32‰、36‰。由于当时养殖海区的海水盐度为29‰, 故以盐度29‰为对照组, 不同盐度用海水和淡水或海水晶配置。每天8:00投喂扁藻1次, 14:00换水1次, 分别于处理后4、24、72、120、168h取样, 每个盐度组的每个时间点取5只贝的鳃组织用RNA保护剂(Takara)保存。
1.5 组织分布与不同发育时期样品
用于组织分布实验的样品取自3只贝, 每只贝取其鳃、足、外套膜、性腺、消化腺和闭壳肌6个组织保存。不同发育时期的样品包含极体期、2—4细胞期、囊胚期、原肠期、担轮幼虫期、D型幼虫期、壳顶幼虫期、眼点幼虫期、附着幼虫期和稚贝期样品。
1.6 实时定量PCR
按照1.2的方法提取盐度胁迫实验、组织和不同发育时期样品的总RNA, 用UV-Vis Spectrophotometer Q500(QUAWELL)测定RNA浓度, 1.5%琼脂糖凝胶电泳检验RNA质量。用带有去除基因组功能的逆转录试剂盒ReverTra Ace®qPCR RT Master Mix With gDNA Remover(Toyobo)进行cDNA第一链合成, 用SYBR®Green Realtime PCR Master Mix(Toyobo)和Light Cycler 480(Roche, Switzerland),为内参基因进行实时荧光定量分析, 每个样品3个技术重复。反应体系为: SYBR®Green Realtime PCR Master Mix 5µL, 双蒸馏水3.4µL, cDNA模板1µL, 上下游引物各0.3µL, 共10µL。反应程序为: 95℃预变性10min; 95℃ 10s, 56℃ 15s, 72℃ 15s, 45个循环。2–Dct法计算相对mRNA表达量。用SPSS19.0软件的单因素方差分析法(ANOVA)进行显著性分析(<0.01)。
2 结果
2.1 马氏珠母贝PfAQP4的克隆和结构分析
获得的全长cDNA(GenBank No.: MN310685)为1837bp, 包含114bp的 5′非翻译区(untranslated region, UTR), 839bp的3′UTR, 858bp 的ORF, 共编码285个氨基酸(图1)。
ProtParam分析得出该蛋白质分子式为C1366H2146N350O396S11, 分子质量为30.172kDa, 理论等电点(pI)为5.02; 含22个带负电氨基酸(Asp+Glu)、15个带正电氨基酸(Arg+Lys); 脂肪系数为105.72, 亲水性总平均数为0.459, 为正数, 故该蛋白是一类疏水性蛋白, 不稳定指数计算为29.29(小于40), 是一类稳定的蛋白。

图1 PfAQP4的 cDNA全长序列及推导的氨基酸
小写字母表示5′UTR和3′UTR序列, 大写字母表示ORF序列, 阴影部分表示SMART预测的MIP结构域, 方框示NPA序列, 下划线示6个跨膜区, *代表蛋白翻译终止子, 粗体aataaa代表polyA加尾信号
Fig. 1 cDNA sequence and deduced amino acid sequence ofLower case letters indicate 5'UTR and 3'UTR, upper case letters indicate ORF, shaded areas indicate SMART-predicted MIP domains, boxes indicate NPA sequences, underlined letters indicate six transmembrane regions, and * represents protein translation terminator. aataaa in bold represents polyadenylation tail signal
TMpred和SMART分析表明该蛋白质有1个MIP结构域, 位于10~244AA; 有6个跨膜区(24~45AA、68~87AA、113~132AA、156~173AA、187~206AA、227~249AA); 5个环, 分别是A—E, 与ProtScale分析PfAQP4亲水性结果一致(图2), 两个NPA序列位于B环和E环, 分别位于95~97AA和209~211AA。
利用SWISS-MODEL对PfAQP4序列进行三维结构预测, 用Target-Template Alignment法进行模型创建, 智人()AQP4(GenBank No.: 3GD8_A)为模板, 最后构建的模型QMEAN为–3.79, GMQE为0.69, 说明构建的模型质量良好, 可用于该蛋白三级结构预测分析。预测的PfAQP4三维结构符合典型的水通道蛋白结构, 跨膜序列形成6个α螺旋包围一个孔道, B、E环形成2个短螺旋以一定角度伸入孔道内, 共同形成一个只有水分子能够通过的通道(图3)。
2.2 多序列比对及进化分析
MatGAT氨基酸一致性分析显示马氏珠母贝PfAQP4氨基酸序列与长牡蛎()和虾夷扇贝()的AQP4氨基酸序列一致性较高, 分别为53.4%和52.2%, 与微生物停乳链球菌()和犬链球菌()的一致性较低, 分别为23.4%和23.5%(表2); 多序列比对显示, PfAQP4与其他的AQP4蛋白序列较为一致, 都含有6个α螺旋跨膜区、5个环和2个NPA基序, F75、H197、C206、R212是构成选择性过滤器的4个氨基酸(图4)。不同物种AQP4蛋白序列聚类分析发现, 长牡蛎和虾夷扇贝首先聚为一支, 其次与马氏珠母贝聚为一支, 表明PfAQP4蛋白与长牡蛎和虾夷扇贝AQP4蛋白亲缘关系最近(图5)。
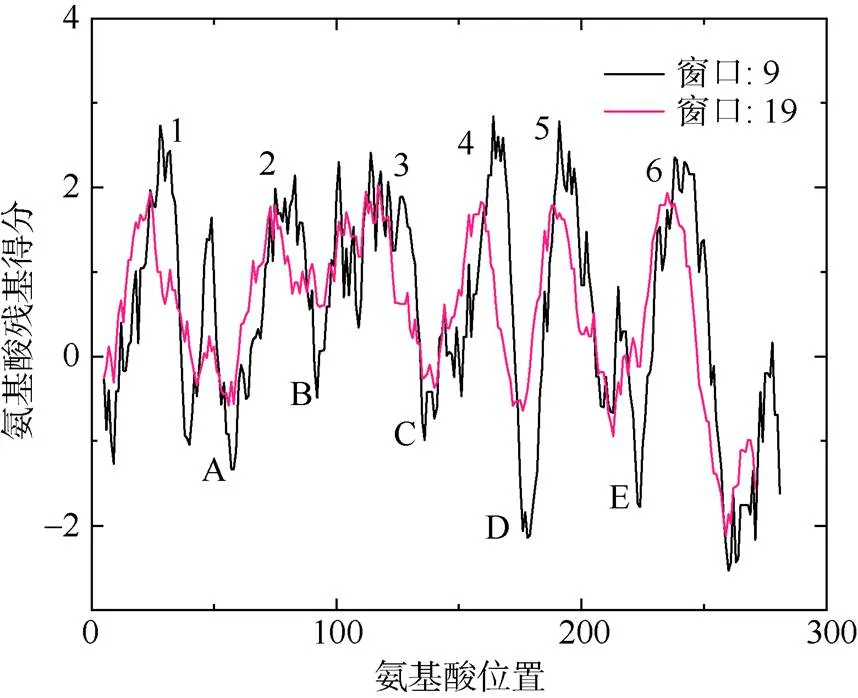
图2 PfAQP4疏水性示意图
1—6表示6个跨膜区; A—E表示5个环; 窗口大小是指用于轮廓计算的间隔长度, 在计算给定残基i的得分时, 考虑以残基i为中心的选定长度区间内的氨基酸
Fig. 2 Hydrophobic plots of PfAQP4. Numbers 1-6 represents six transmembrane regions, A-E represent five loops, and the windows size refers to the interval length used for contour calculation. When calculating the score of a given residue i, the amino acids in the selected length interval centered on residue i are considered

图3 PfAQP4 (a) 和H.sAQP4 (b) 蛋白质三维结构
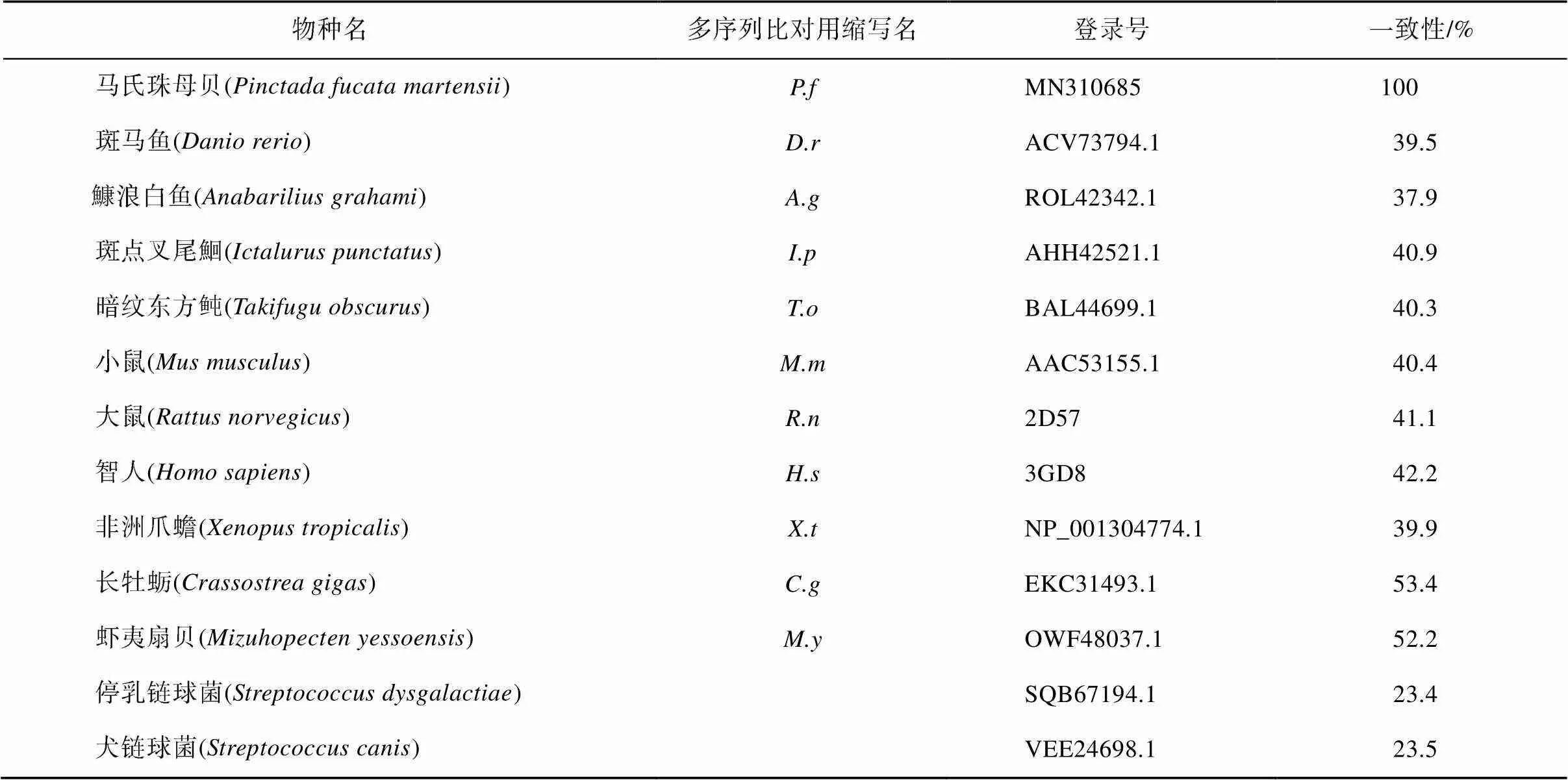
表2 PfAQP4与其他已知AQP4同源序列氨基酸一致性比较

α1—α6为6个跨膜区, 方框表示NPA基序, 黑色背景白字表示纵列碱基保守性≥50%, 灰色表示纵列各碱基相似, 白色背景黑字表示碱基不保守
Fig. 4 Multi-sequence alignment of PfAQP4 with other species AQP4. α1-α6 represents six transmembrane regions, the box represents the NPA motif, the white letter with black background indicates the column are conserved (≥50%), the gray shading indicates the columns are similar, and the black letter with white background indicates that the residues are not conserved
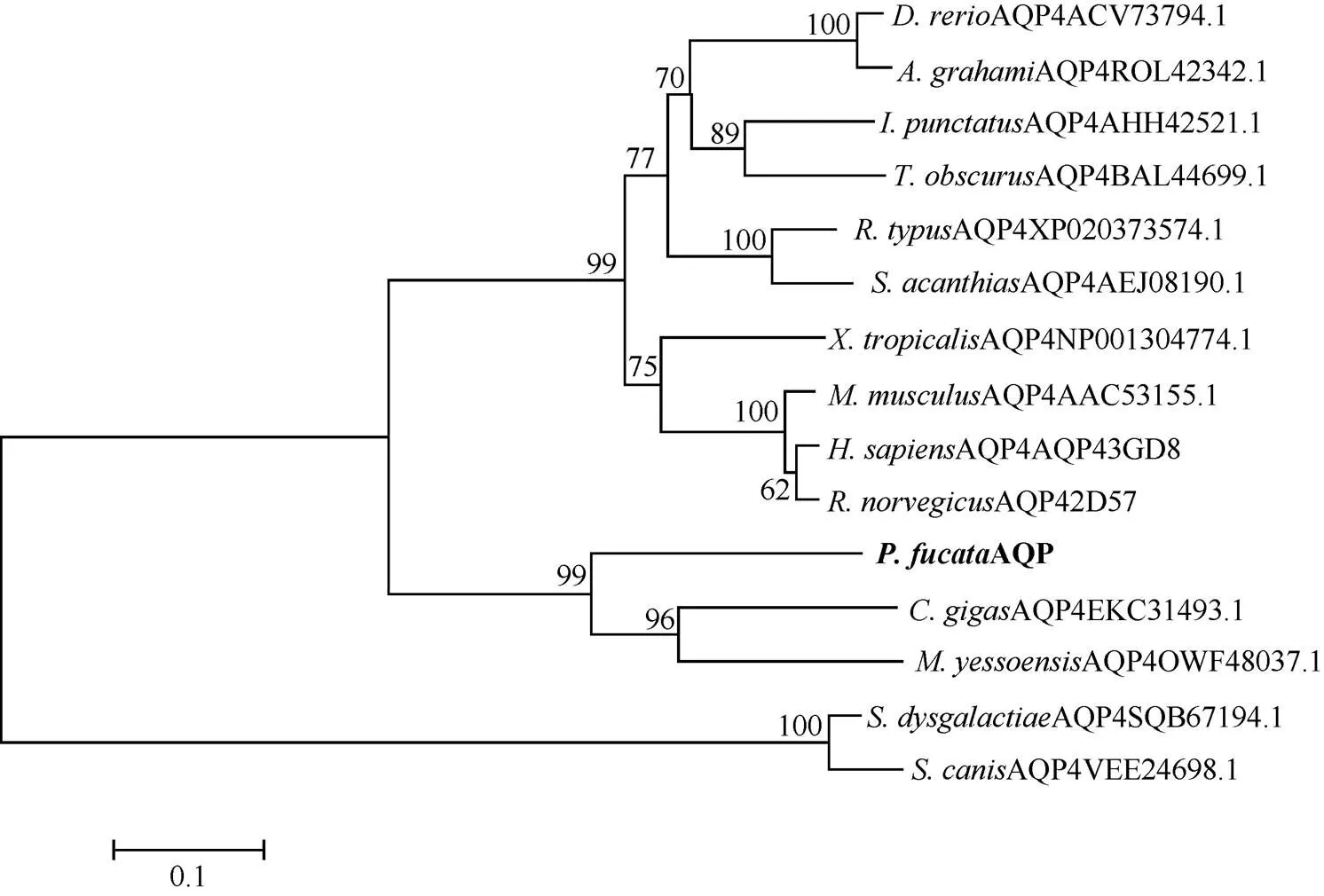
图5 PfAQP4与其他物种AQP4的系统进化分析(N-J法)
2.3 PfAQP4在不同组织和不同发育时期的表达量测定
在马氏珠母贝的鳃、足、消化腺、闭壳肌、性腺和外套膜这6个组织中,都有表达, 只是表达量高低的不同。在闭壳肌、足和鳃这3个组织中表达量最高, 其次为消化腺、性腺和外套膜(图6)。
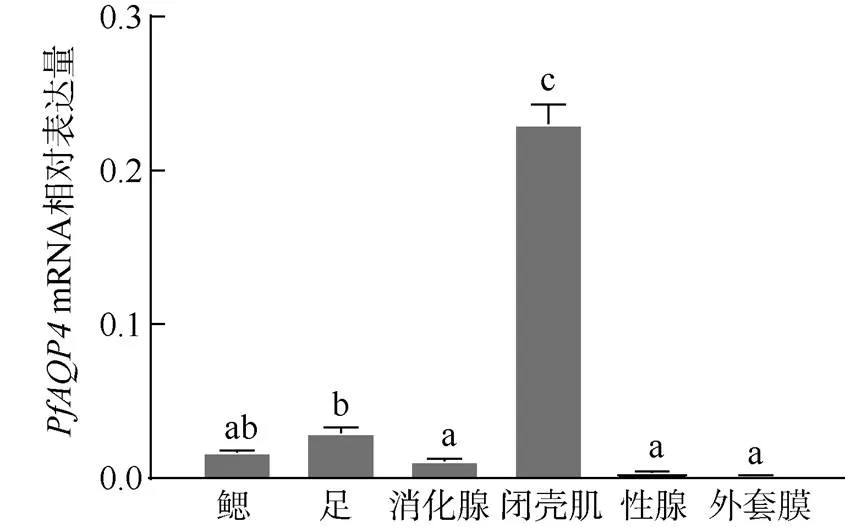
图6 PfAQP4在不同组织中的相对表达量
不同字母表示组间差异性显著(<0.01)
Fig. 6 Relative expressions ofin different tissues. Different letters indicate significant differences between groups (<0.01)
在不同发育时期中均有表达, 其表达在整体上呈现先升高后降低的趋势, 2—4细胞期表达量最高, 随着胚胎发育向幼虫发育时期推进,表达量缓慢下降, 在眼点幼虫期表达量最低, 最高表达量为最低表达量的33.22倍(图7)。
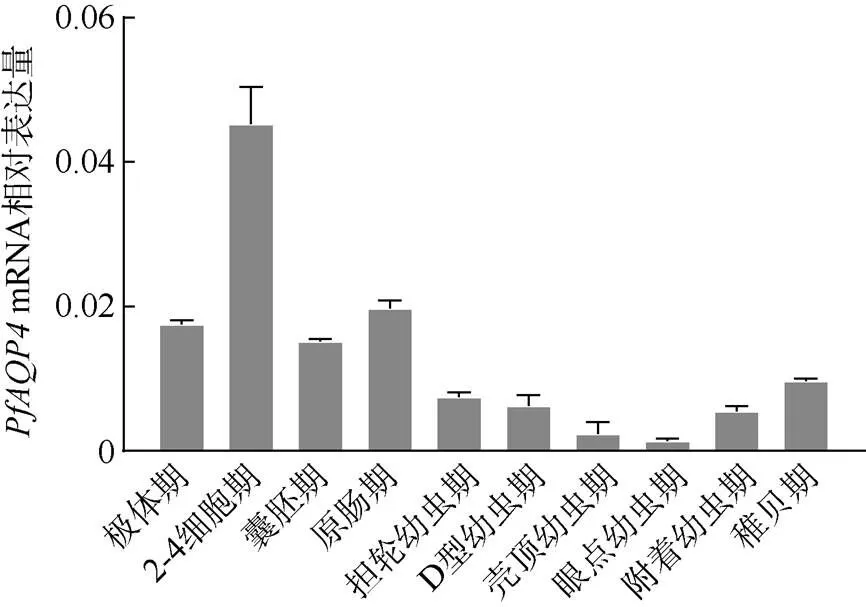
图7 PfAQP4在不同发育时期的相对表达量
2.4 盐度胁迫对PfAQP4 mRNA表达量的影响
在16‰低盐胁迫下,mRNA在4h的相对表达量为0.00179, 相应时刻对照组mRNA相对表达量为0.00191, 两组间无显著性差异; 在24h时mRNA相对表达量为0.0351, 与对照组相比显著上升(<0.01), 是对照组的20.98倍; 在72h时,mRNA相对表达量为对照组的1.14倍, 与对照组间无显著性差异。
在20‰低盐胁迫和在32‰高盐胁迫下,mRNA相对表达量在所有时刻和对照组水平一致, 没有显著性差异。
在36‰高盐胁迫下,mRNA在4h的相对表达量与对照组无显著性差异; 在24、72、120h,mRNA显著高表达(<0.01), 相对表达量分别为0.00647、0.00607和0.00623, 分别为相应时刻对照组的3.86、4.13和3.45倍; 在168hmRNA相对表达量降至0.00236, 为对照组的0.85倍, 无显著差异(图8)。
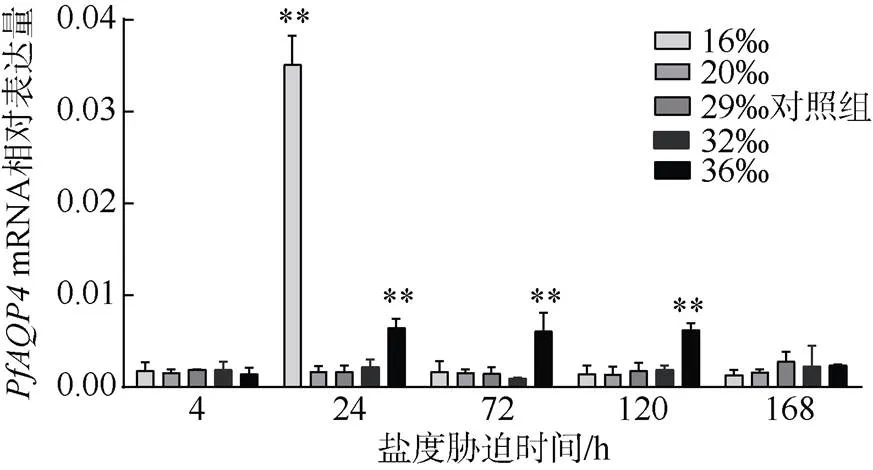
图8 PfAQP4在不同盐度胁迫下的相对表达情况
**表示同一盐度组在不同时刻差异极显著(<0.01)
Fig. 8 Relative expressions ofunder different salinity stress. ** indicates that the same salinity group is significantly different at different times (<0.01)
3 讨论
3.1 PfAQP4的结构与分类地位
本研究获得的马氏珠母贝的AQP编码285个氨基酸, 该蛋白含有1个MIP结构域, 6个跨膜结构域, 5个环, 2个NPA基序, 第二个NPA基序后的Arg(R)高度保守, 符合AQP基因家族的特征。在构成选择性水孔构件的4个氨基酸位点(F75、H197、C206、R212)中(Beitz et al, 2006; Kamegawa et al, 2016), 除了C206位点, 其他3个位点的氨基酸在不同物种中都具有极高的保守性。在无脊椎动物中C206位点氨基酸残基为半胱氨酸(Csy), 而在脊椎动物中该位点对应的氨基酸残基为丙氨酸(Ala); 目前在哺乳动物中已经成功克隆了13种AQP, 而最先被发现且研究最清楚的AQP1蛋白序列的一个典型特征就是该位点氨基酸残基为Csy, 以起到汞抑制性, 且只有AQP1存在这个特征, 其他专一性水分子通道不存在。基于序列特征, 马氏珠母贝AQP应归为AQP1。
然而, 在系统进化分析上, 马氏珠母贝AQP与AQP4聚为一支。考虑到低等无脊椎动物和高等脊椎动物的进化地位不同, 序列特征可能有所不同, 因此我们认为马氏珠母贝AQP是属于AQP4的一类蛋白, 将其命名为PfAQP4。进化分析表明, PfAQP4首先与长牡蛎和虾夷扇贝聚为一支, 然后与高等脊椎动物聚为一支, 与微生物的遗传距离较远, 符合物种遗传进化关系。
3.2 PfAQP4在不同组织和不同发育时期的表达模式
在所有被检测组织中均有表达, 说明该基因为组成型表达, 其中在闭壳肌、足和鳃表达量较高, 在消化腺、性腺和外套膜中较低。AQP4在不同物种的组织分布模式存在差异, 香港牡蛎()3种亚型的组织表达模式并不完全一样, 在鳃和外套膜中的表达量最高, 闭壳肌的表达量次之(万茜, 2014)56-58; 凡纳滨对虾()在其鳃、肌肉、脑和肝胰腺的表达量较高(高沿, 2016)40-42; 在尖吻角鲨()中,的表达量为肝脏>鳃>肠(Cutler et al, 2012)。这可能是因为不同物种的生理特征不同, 导致在不同物种的不同组织中表达模式也不同。
在马氏珠母贝不同发育时期中,的表达呈现先急剧升高, 然后缓慢下降, 最后缓慢升高的趋势。马氏珠母贝卵子在性腺内的发育停留在减数分裂I前中期, 精卵结合后卵子继续进行减数分裂(沈亦平等, 1993; 何毛贤等, 2002)。海洋生物的胚胎发育需要适宜的盐度, 盐度不适宜会导致畸形率上升或者孵化率下降(张鑫磊等, 2006; 赵明等, 2011), 根据在马氏珠母贝不同发育时期的表达量变化, 推测PfAQP4可能参与马氏珠母贝早期胚胎发育。
3.3 马氏珠母贝对外界渗透压力变化的调节机制
进行渗透压调节的生物可分为两种类型, 分别是“渗透压随变者”(osmoconformers)和“渗透压调节者”(osmoregulators), 前者是指在适应盐度波动时, 最终将内部体液(即血液或血淋巴)的渗透压调节到与外部介质的渗透压相同的水平。海洋无脊椎动物双壳贝类大部分属于渗透压随变者, 在遇到盐度压力时, 首先通过关闭贝壳、封闭外套腔来应对, 其次则由体内与离子交换和水转运有关基因的表达来进行下一步调节(Davenport, 1979; Navarro, 1988; 水柏年, 2007)。贝类渗透压的恒定主要是指贝类血淋巴的主要渗透效应物与外部水环境中有机离子和无机离子含量平衡, 不会导致生物细胞膨胀或皱缩, 可以进行正常生活的一种状态。在无脊椎动物中, 渗透压主要效应物包括各种无机离子和游离氨基酸等; Na+/K+-ATP酶被认为参与甲壳类渗透压调节(Wilder et al, 1998; 王劭雯, 2012), 牛磺酸作为一种游离氨基酸, 在哺乳动物脑的渗透压调节中起到重要作用(Pasantes-Morales et al, 1997), 马氏珠母贝也含有大量的牛磺酸, 但其是否参与马氏珠母贝渗透调节还未知。
目前未发现海洋贝类有专门用于渗透调节的器官, 其跟渗透压调节关系最为紧密的是鳃组织。有研究报道, 在极端盐度胁迫下, 海湾扇贝()的鳃组织和肝胰腺严重损伤(王吉桥等, 2001)。因此, 本研究对马氏珠母贝鳃组织在不同盐度胁迫下的mRNA相对表达量进行检测。在低盐(16‰)胁迫下,表达量在24h显著上升, 为对照组的20.98倍, 在72h表达量下降至对照组水平, 在高盐(36‰)胁迫下,mRNA相对表达量也在24h显著上调, 但只是对照组的4倍左右, 并保持该水平直至120h, 在168h降至对照组水平, 低盐(16‰)组mRNA相对表达量的上升幅度比高盐(36‰)组高出约5倍且恢复至对照组水平的时间较高盐组快。说明在面对盐度胁迫时, 鳃通过升高的表达量来控制水分的进出, 低盐胁迫时作用时间短, 高盐胁迫时作用时间长, 暗示马氏珠母贝更容易适应低盐环境。面临盐度胁迫时表达量改变的现象也见于其他物种, 在香港牡蛎中, 低盐胁迫和高盐胁迫均显著上调鳃组织AQP4的表达量(万茜, 2014)61-62; 在凡纳滨对虾中, 高盐胁迫显著上调鳃表达量(高沿, 2016)50-55; 在大鼠中, 高盐胁迫显著上调星形胶质细胞表达量(Arima et al, 2003); 在人体中, 高盐胁迫显著下调视网膜色素上皮细胞和星形胶质细胞的表达量(Willermain et al, 2014), 对于下调的原因, 研究者表示是由于AQP4发生内化从而导致含量减少, 且内化的原因是由钠离子和氯离子介导, 现医学上正在开发AQP4抑制剂来治疗脑水肿及高眼压等症状(陈海, 2005; 丁颖, 2014)。在面对盐度胁迫时, 物种通过控制的表达来进行渗透压的调节。鉴于渗透调节是一个复杂的网络系统, 且不同生物体的不同组织由于结构特征不同而具有不同的功能, 因此还要从不同物种、不同器官、离子交换、游离氨基酸含量等方面来解释渗透压调节。目前马氏珠母贝的水分运输和渗透压的调节机制尚不清楚,的调节机制也不明确, 有待进一步的研究。
安皓, 2017. 水通道蛋白7、8及精液pH值对大菱鲆()精子活力影响研究[D]. 青岛: 中国科学院大学(中国科学院海洋研究所). AN HAO, 2017. The influence of aquaporin 7 aquaporin 8 and semen pH on sperm viability[D]. Qingdao: University of Chinese Academy of Sciences (The Institute of Oceanology, Chinese Academy of Sciences) (in Chinese with English abstract).
陈海, 2005. AQP4、AQP9在大鼠眼组织的定位与功能研究[D]. 重庆: 重庆医科大学. CHEN HAI, 2005. The effect of intraocular pressure alteration on expression of AQP4, AQP9 and their mRNA in the rat eyes[D]. Chongqing: Chongqing Medical University (in Chinese with English abstract).
丁颖, 2014. 高渗钠对体外培养星形胶质瘤U251细胞膜AQP4内化的影响研究[D]. 长沙: 中南大学. DING YING, 2014. The study of hypertonic saline influence the AQP4 internalization in plasma membrane of human astrocytoma U251[D]. Changsha: Central South University (in Chinese with English abstract).
高沿, 2016. 凡纳滨对虾水孔蛋白-4基因克隆、表达及其对盐度胁迫的反应研究[D]. 北京: 中国科学院大学. GAO YAN, 2016. Aquaporin-4 in: molecular cloning, gene expression and its response to salinity stress[D]. Beijing: University of Chinese Academy of Sciences (in Chinese with English abstract).
何毛贤, 姜卫国, 潘金培, 2002. CB抑制合浦珠母贝受精卵第一极体释放的染色体分离[J]. 水产学报, 26(1): 15–20. HE MAOXIAN, JIANG WEIGUO, PAN JINPEI, 2002. Chromosome segregation in fertilized eggs from pearl oysterDunker following the first polar body inhibition with cytochalasin B[J]. Journal of Fisheries of China, 26(1): 15–20 (in Chinese with English abstract).
林浩然, 1999. 鱼类生理学[M]. 广州: 广东高等教育出版社: 193–226.
沈亦平, 姜海波, 刘汀, 等. 1993. 合浦珠母贝卵子成熟的细胞学观察[J]. 武汉大学学报(自然科学版), (5): 109–114. SHEN YIPING, JIANG HAIBO, LIU TING, et al, 1993. Cytology of egg maturation of pearl oysterDunker[J]. Journal of Wuhan University (Natural Science Edition), (5): 109–114 (in Chinese with English abstract).
水柏年, 2007. 若干环境因子对缢蛏(Lamarck)快速净化的影响研究[J]. 现代渔业信息, 22(9): 6–10. SHUI BONIAN, 2007. A study on effect of several environmental factors on quick purification of(Lamarck)[J]. Modern Fisheries Information, 22(9): 6–10 (in Chinese with English abstract).
万茜, 2014. 香港牡蛎()水通道蛋白基因家族的克隆与表达分析[D]. 北京: 中国科学院大学. WAN XI, 2014. Cloning and expression analysis of aquaporin gene family from[D]. Beijing: University of Chinese Academy of Sciences (in Chinese with English abstract).
王吉桥, 靳翠丽, 姜静颖, 2001. 不同降盐度方式对海湾扇贝幼贝存活的影响[J]. 中国水产科学, 8(3): 35–39. WANG JIQIAO, JIN CUILI, JIANG JINGYING, 2001. Influence of salinity-decreasing regimes on survival of juvenile[J]. Journal of Fishery Sciences of China, 8(3): 35–39 (in Chinese with English abstract).
王如才, 王昭萍, 张建中, 1993. 海水贝类养殖学[M]. 青岛: 青岛海洋大学出版社: 213.
王劭雯, 2012. 皱纹盘鲍幼鲍对海水盐度的耐受性分析[D]. 青岛: 中国科学院研究生院(海洋研究所). WANG SHAOWEN, 2012. Analysis of the toleration to different salinities inIno[D]. Qingdao: The Institute of Oceanology, Chinese Academy of Sciences (in Chinese with English abstract).
张鑫磊, 陈四清, 刘寿堂, 等, 2006. 温度、盐度对半滑舌鳎胚胎发育的影响[J]. 海洋科学进展, 24(3): 342–348. ZHANG XINLEI, CHEN SIQING, LIU SHOUTANG, et al, 2006. Effects of temperature and salinity on embryonic development of Tongue Sole,Gunther[J]. Advances in Marine Science, 24(3): 342–348 (in Chinese with English abstract).
赵明, 陈超, 柳学周, 等, 2011. 盐度对七带石斑鱼胚胎发育和卵黄囊仔鱼生长的影响[J]. 渔业科学进展, 32(2): 16–21. ZHAO MING, CHEN CHAO, LIU XUEZHOU, et al, 2011. Effect of salinity on embryonic development and post-embryonic larval growth of[J]. Marine Fisheries Research, 32(2): 16–21 (in Chinese with English abstract).
AGRE P, PRESTON G M, SMITH B L, et al, 1993. Aquaporin CHIP: the archetypal molecular water channel[J]. American Journal of Physiology -Renal Physiology, 265(4): F463–F476.
AGRE P, KING L S, YASUI M, et al, 2002. Aquaporin water channels-from atomic structure to clinical medicine[J]. The Journal of Physiology, 542(1): 3–16.
ARIMA H, YAMAMOTO N, SOBUE K, et al, 2003. Hyperosmolar mannitol stimulates expression of aquaporins 4 and 9 through a p38 mitogen-activated protein kinase-dependent pathway in rat astrocytes[J]. The Journal of Biological Chemistry, 278(45): 44525–44534.
BEITZ E, WU BINGHUA, HOLM L M, et al, 2006. Point mutations in the aromatic/arginine region in aquaporin 1 allow passage of urea, glycerol, ammonia, and protons[J]. Proceedings of the National Academy of Sciences of the United States of America, 103(2): 269–274.
CAMPBELL E M, BALL A, HOPPLER S, et al, 2008. Invertebrate aquaporins: a review[J]. Journal of Comparative Physiology B, 178(8): 935–955.
CONNOLLY D L, SHANAHAN C M, WEISSBERG P L, 1998. The aquaporins. A family of water channel proteins[J]. The International Journal of Biochemistry & Cell Biology, 30(2): 169–172.
CUTLER C P, MACIVER B, CRAMB G, et al, 2012. Aquaporin 4 is a ubiquitously expressed isoform in the dogfish () Shark[J]. Frontiers in Physiology, 2: 107.
DAVENPORT J, 1979. Isa short term osmoregulator?[J]. Comparative Biochemistry and Physiology Part A: Physiology, 64(1): 91–95.
DENKER B M, SMITH B L, KUHAJDA F P, et al, 1988. Identification, purification, and partial characterization of a novel Mr 28,000 integral membrane protein from erythrocytes and renal tubules[J]. The Journal of Biological Chemistry, 263(30): 15634–15642.
HASEGAWA H, MA T, SKACH W, et al, 1994. Molecular cloning of a mercurial-insensitive water channel expressed in selected water-transporting tissues[J]. The Journal of Biological Chemistry, 269(8): 5497–5500.
HO J D, YEH R, SANDSTROM A, et al, 2009. Crystal structure of human aquaporin 4 at 1.8 Å and its mechanism of conductance[J]. Proceedings of the National Academy of Sciences of the United States of America, 106(18): 7437–7442.
HUANG CHUNYI, LAMITINA T, AGRE P, et al, 2007. Functional analysis of the aquaporin gene family in[J]. American Journal of Physiology-Cell Physiology, 292(5): C1867–C1873.
ISHIBASHI K, HARA S, KONDO S, 2009. Aquaporin water channels in mammals[J]. Clinical and Experimental Nephrology, 13(2): 107–117.
KAMEGAWA A, HIROAKI Y, TANI K, et al, 2016. Two-dimensional crystal structure of aquaporin-4 bound to the inhibitor acetazolamide[J]. Microscopy, 65(2): 177–184.
MCNAMARA J C, FARIA S C, 2012. Evolution of osmoregulatory patterns and gill ion transport mechanisms in the decapod Crustacea: A review[J]. Journal of Comparative Physiology B, 182(8): 997–1014.
NAVARRO J M, 1988. The effects of salinity on the physiological ecology of(Molina, 1782) (Bivalvia: Mytilidae)[J]. Journal of Experimental Marine Biology and Ecology, 122(1): 19–33.
PARISI M, DORR R A, OZU M, et al, 2007. From membrane pores to aquaporins: 50 years measuring water fluxes[J]. Journal of Biological Physics, 33(5–6): 331–343.
PASANTES-MORALES H, SCHOUSBOE A, 1997. Role of taurine in osmoregulation in brain cells: mechanisms and functional implications[J]. Amino Acids, 12(3–4): 281–292.
PÉQUEUX A, 1995. Osmotic regulation in crustaceans[J]. Journal of Crustacean Biology, 15(1): 1–60.
PRESTON G M, CARROLL T P, GUGGINO W B, et al, 1992. Appearance of water channels inoocytes expressing red cell CHIP28 protein[J]. Science, 256(5055): 385–387.
SOTO G, ALLEVA K, AMODEO G, et al, 2012. New insight into the evolution of aquaporins from flowering plants and vertebrates: orthologous identification and functional transfer is possible[J]. Gene, 503(1): 165–176.
WILDER M N, IKUTA K, ATMOMARSONO M, et al, 1998. Changes in osmotic and ionic concentrations in the hemolymph ofexposed to varying salinities and correlation to ionic and crystalline composition of the cuticle[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 119(4): 941–950.
WILLERMAIN F, JANSSENS S, ARSENIJEVIC T, et al, 2014. Osmotic stress decreases aquaporin-4 expression in the human retinal pigment epithelial cell line, ARPE-19[J]. International Journal of Molecular Medicine, 34(2): 533–538.
Cloning and expression analysis of aquaporin genecDNA from
PAN Xiaolan1,2.3, LIU Huiru1,2, XU Meng1,2, XU Hanzhi1, 2, ZHANG Hua1, 3, HE Maoxian1, 3
1. CAS Key Laboratory of Tropical Marine Bio-resources and Ecology, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou 510301, China;2. Guangdong Provincial Key Laboratory of Applied Marine Biology, Guangzhou 510301, China;3. University of Chinese Academy of Sciences, Beijing 100049, China;4. Institution of South China Sea Ecology and Environmental Engineering, Chinese Academy of Sciences, Guangzhou 510301, China
Aquaporin 4 (AQP4) is a major channel that passively transports water. In this study, based on a fragment ofofobtained by transcriptome sequencing, the full cDNA was obtained using RACE technology, named, which includes 114 bp of 5'UTR, 839 bp of 3'UTR, and 858 bp of the Open Reading Frame (ORF) encoding a total of 285 amino acids. Thehas six alpha-helix transmembrane regions, five loops, one major intrinsic protein (MIP) domain, and two NPAs (Asn-Pro-Ala) motif, indicating that it belongs to AQP1-like type. Real-time fluorescent quantitative PCR was used to analyze the mRNA expression pattern ofin different tissues, different developmental stages, and different salinity stress conditions. The results showed that: (1)was expressed in all tested tissues, and its expression level was higher in adductor muscle, foot, and gill; (2) in different developmental stages,was increased first and then decreased, highly expressed in the 2-4 cell stage and lowly expressed in eye-spot larva stage; (3) the expression of gillmRNA in hypersaline group (36‰) increased significantly at 24h, 72h, and 120h, and returned to the control level at 168 h; in the hyposaline group (16‰),was significantly up-regulated at 24 h, and the expression level returned to the control level at 72h. These results showed that the salinity can affect the expression ofin gill, andhad a very important effect on the osmoregulation of
aquaporin 4, salinity stress, osmoregulation
Q753; S917.4
A
1009-5470(2020)03-0066-10
10.11978/2019074
http://www.jto.ac.cn
2019-08-19;
2019-11-28。
林强编辑
国家贝类产业技术体系岗位科学家(CARS-49); 海洋生态文明工程项目(ISEE2018PY03); 广东省科技计划项目(
潘肖兰(1996—), 女, 广西壮族自治区河池市人, 硕士研究生, 研究方向为马氏珠母贝分子遗传育种。E-mail: panxiaolan17@mails.ucas.edu.cn
何毛贤。E-mail: hmx2@scsio.ac.cn, 电话: 020-89023144
2019-08-19;
2019-11-28.
Editor: LIN Qiang
The Earmarked Fund for Modern Agro-industry Technology Research System ( CARS-49); Marine Ecological Civilization Project(ISEE2018PY03); Science and Technology Planning Project of Guangdong Province, China()
HE Maoxian. E-mail: hmx2@scsio.ac.cn, Tel: 020-89023144
