基于三乙胺体系的电致化学发光生物传感器检测葡萄糖
2020-05-09陈时洪
李 芹,李 婷,贺 莹,陈时洪*
(1.重庆市沙坪坝区人民医院 消化内科,重庆 400030;2.西南大学 化学化工学院,重庆 400715)
近年来,越来越多的人患有糖尿病,糖尿病已成为一个世界性的公共问题,是影响人类生活的重要疾病之一。糖尿病还能引起很多并发症,如骨质疏松、心血管疾病等[1-2]。测定血清中葡萄糖含量是诊断糖尿病的重要指标之一。因此,简单、快速和灵敏地测定葡萄糖在医学检验中具有重要价值,对食品工业中质量监控和糖尿病病情监控均有着重要意义[3-4]。目前检测葡萄糖的方法很多,如化学发光法[5]、比色法[6]、荧光法[7]以及色谱法[8]等。化学发光法对一系列化合物均有响应,选择性较差;比色法对被测物质的纯度要求较高,需要繁琐的样品预处理过程;荧光法局限于分析过程中需外加光源,因此不可避免地存在光散射的影响,从而影响检测灵敏度;色谱法虽检测的准确性和灵敏度高,但需要专门的仪器以及繁琐的样品前处理过程,成本高且费时。

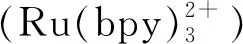

1 实验部分
1.1 仪器与试剂
MPI-A型电致化学发光分析仪(西瑞迈分析仪器有限公司)用于ECL检测,高压倍增管设置为600 V,低电位设置0 V,高电位为1.25 V;CHI760E电化学工作站(上海辰华仪器公司)用于循环伏安(CV)和电化学阻抗(EIS)扫描;JEM 1200EX透射电子显微镜(日本电子株式会社)和Thermo escalab 250Xi X射线光电子能谱仪(美国热电公司)用于材料的XPS表征;实验使用三电极体系:修饰的玻碳电极为工作电极,铂电极为对电极,Ag/AgCl或甘汞电极为参比电极。
葡萄糖氧化酶(GOx)、葡萄糖购自Sigma(St.Louis,Mo,USA),Ru(bpy)3Cl2购自苏州钠凯科技有限公司,三乙胺(Et3N)购于阿拉丁上海有限公司,三噻吩丙二酸(TA)、氯铂酸(H2PtCl6)购于北京百灵威科技有限公司,以上试剂均为分析纯;磷酸盐缓冲溶液(PBS)做测试底液;实验用水均为超纯水。
1.2 Pt NPs和 Pt NPs-Ru复合物的制备
Pt纳米粒子(Pt NPs)的制备[10]:Pt NPs通过加热H2PtCl6和TA的水溶液得到。首先将1.9 mL 0.02 mol/L H2PtCl6稀释至50 mL,加入0.5 mL 0.3 mol/L TA后,所得溶液于100 ℃下搅拌20 min,即得到深棕色Pt NPs分散液。
Pt NPs-Ru复合物的合成[10]:在上述已制备好的Pt NPs分散液(5.0 mL)中,于剧烈搅拌下缓慢加入0.1 mL 0.04 mol/L Ru(bpy)3Cl2溶液。3 min后,出现大量黑色颗粒,在12 000 r/min条件下离心10 min,收集沉淀并用水洗涤,得到黑色的Pt NPs-Ru复合物,将其分散在2.0 mL水中备用。

图1 Pt NPs-Ru复合物和传感器的制备过程Fig.1 Preparation process of Pt NPs-Ru complex and sensor
1.3 传感器的制备
玻碳电极(GCE,直径4 mm)经Al2O3粉末抛光后,用水和乙醇超声清洗干净。将处理好的电极置于室温下晾干。移取10 μL Pt NPs-Ru复合物分散液滴涂于电极表面,室温下静置使其晾干。将15 μL 20 mg/L GOx 溶液滴涂至Pt NPs-Ru复合物修饰电极,4 ℃下孵育过夜,在水中浸洗,洗掉未被结合的酶,得到所需的ECL传感器,制备过程如图1所示。
1.4 检测方法
使用三电极体系进行检测。光电倍增管电压设为600 V,扫描电压为0~1.25 V。检测底液为含有10.0 mmol/L Et3N 的3.0 mL PBS溶液(pH 7.4,0.1 mol/L)。测定修饰电极对不同浓度葡萄糖的ECL响应信号。
2 结果与讨论
2.1 纳米材料的表征
利用透射电子显微镜(TEM)表征了Pt NPs-Ru复合物的微观形貌(图2A),可清晰观察到复合物的颗粒结构,由粒径分布图可知,其粒径约1.1 nm(图2A插图)。进一步采用X射线光电子能谱(XPS)对Pt NPs-Ru进行表征,其元素组成情况示于图2B。由图可清楚地观察到C1s峰、O1s峰、Pt4f峰以及Ru3p峰。图2C、D分别显示了Pt4f区在75.10 eV和71.85 eV处的2个结合能峰以及Ru3p区在464.70 eV处的特征峰。以上结果表明复合物同时存在Ru(Ⅱ)和Pt NPs,证明该复合物已制备成功。


2.2 电极修饰过程的CV、EIS与ECL表征
采用循环伏安法(CV)、电化学阻抗法(EIS)及电致化学发光法(ECL)分别对传感器的构建过程进行表征。其中CV和EIS测试均在含有铁氰化钾(5.0 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6])的PBS溶液中进行。如图3A所示,裸电极呈现出明显的氧化还原峰(曲线a)。当电极修饰上Pt NPs-Ru复合物时(曲线b),由于Pt NPs上所带的负电荷与[Fe(CN)6]3-/4-发生排斥而阻碍电子传递,导致峰电流明显降低。当电极进一步修饰GOx后(曲线c),峰电流进一步降低,这是因为GOx同样对电子传递具有阻碍作用。修饰电极过程的EIS表征图则显示,随着Pt NPs-Ru复合物和GOx的修饰,其阻抗图谱中的半圆直径逐渐增大(图3B),表明阻抗值逐渐增大,表现出与CV相同的变化趋势,进一步表明传感器已构建成功。


为了进一步证明传感器的构建过程,进一步使用ECL进行表征。ECL检测在3.0 mL含有10.0 mmol/L Et3N的PBS(0.1 mol/L,pH 7.4)中进行。如图3C所示,裸电极几乎不能产生ECL信号(曲线a),这是因为此时电极不存在任何发光物质。修饰Pt NPs-Ru纳米复合物后的电极能产生很强的ECL信号(曲线b)。进一步将GOx修饰至电极表面后,ECL强度有所减弱(曲线c),这是因为蛋白质大分子阻碍了电子传递,从而导致发光强度降低。

(1)

(2)
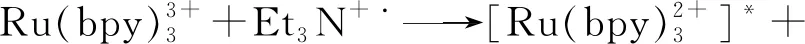
(3)
(4)

(5)
(6)
2.3 实验条件的优化
2.3.1 pH值的影响研究了磷酸盐缓冲溶液的pH值对体系ECL信号强度的影响。在含有10.0 mmol/L Et3N和1.0 μmol/L葡萄糖的PBS缓冲溶液(3.0 mL)中测试了传感器的ECL信号随不同pH值(5.0、6.0、7.4、8.0、9.0)的变化情况,结果如图4A所示。由图可知,pH值从5.0增至8.0时,ECL信号随着pH值的增加而显著增加。当pH值由8.0变化至9.0时,ECL信号基本稳定。这是由于共反应试剂Et3N为碱性,在pH值5.0和6.0的酸性条件下Et3N被中和,故此时的ECL信号低。考虑到酶催化效果,实验选用pH 7.4的PBS缓冲溶液作为检测底液。
2.3.2 Pt NPs-Ru修饰量的影响进一步探究了Pt NPs-Ru在电极上的修饰量对体系ECL信号的影响。在含有10.0 mmol/L Et3N的3.0 mL 0.10 mol/L PBS溶液(pH 7.4)中测试了传感器ECL信号随Pt NPs-Ru在电极上修饰量(5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0 μL)的变化情况,结果示于图4B。当修饰量从5.0 μL增至10.0 μL时,ECL信号在不断增加。当修饰量为11.0 μL和12.0 μL时,ECL信号已超过检测量程。为了确保检测的准确度,本实验选择Pt NPs-Ru在电极上的修饰量为10 μL。
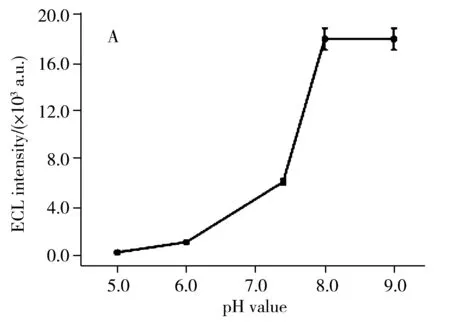

图5 传感器对不同浓度葡萄糖的响应Fig.5 ECL responses of the biosensor for different concentration of glucose glucose concentration(a-g):0.01,0.05,0.1,1.0,5.0,10, 50(×10-6 mol/L);pH 7.4 PBS,Et3N concentration: 10.0 mmol/L;insert:the calibration curve for glucose
2.4 传感器的性能
2.4.1 标准曲线图5显示了传感器对葡萄糖的响应情况。当葡萄糖浓度由1.0×10-8mol/L增至5.0×10-5mol/L时,传感器的ECL信号不断减小,线性曲线示于插图B。由图可知,在此范围内,ECL信号(I)与葡萄糖浓度的对数(lgc)之间有良好的线性关系,其线性方程为I=-1 575.51+(-1 285.98)lgc。相关系数(r2)为0.995 7,检出限(S/N=3)为5.2×10-9mol/L。将该传感器的性能与其它方法进行比较,结果见表1。相比于其他ECL方法,本实验所构建的生物传感器用于检测葡萄糖具有更低的检出限。

表1 不同生物传感器检测葡萄糖的比较Table 1 Comparison of different biosensors for the determination of glucose
2.4.2 稳定性与选择性稳定性和选择性是传感器的重要性能。图6A显示了在含有10.0 mmol/L Et3N和5.0 μmol/L葡萄糖的0.1 mol/L PBS(pH 7.4)底液中,目标传感器连续扫描10圈的ECL响应情况。测得连续扫描10圈所得的ECL信号的相对标准偏差(RSD)为0.88%,说明该生物传感器具有良好的稳定性。选择乳糖、蔗糖、麦芽糖和色氨酸作为潜在的干扰物质,测试了传感器在含有10.0 mmol/L Et3N的0.1 mol/L PBS(pH 7.4)底液中,对0.05 μmol/L葡萄糖以及50.0 μmol/L上述干扰物质的ECL响应情况。如图6B所示,与空白溶液相比,上述干扰物质对所制备传感器的ECL响应无明显影响,而在目标物葡萄糖存在下,ECL响应信号显著减小,表明所构建的生物传感器拥有较好的选择性。

3 结 论

