新生儿坏死性小肠结肠炎回肠造口术对应激指标和免疫球蛋白的影响
2020-05-07钟陈义孔飞腾四川省妇幼保健院小儿外科四川成都610045
符 松,单 伟,马 超,钟陈义,孔飞腾 (四川省妇幼保健院小儿外科,四川 成都 610045)
新生儿坏死性小肠结肠炎(necrotizing enterocolitis,NEC)是一种小儿多发的肠黏膜损害或肠道弥漫性坏死疾病,流行病学特征多样化,病理生理复杂化。临床以腹胀、呕吐、便血为主,病情可进一步发展为肠穿孔,引起休克甚至死亡,直接威胁患儿生命[1-2]。NEC发生后多种免疫细胞可通过分泌多种细胞因子,如白细胞介素-6(interleukin-6,IL-6)、干扰素-γ(interferon-γ,IFN-γ)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等,介导与局部炎症有关的免疫应答以辅助抗体生成,并抑制相关免疫细胞分泌免疫因子,使机体组织遭受损伤[2]。临床上主要选择常规保守治疗,但有研究指出,常规保守治疗后患儿相关炎性指标及免疫球蛋白分子无显著改善,且进展为肠穿孔的风险增加[3-4]。既往研究已证实炎症应激反应严重者可破坏弹力纤维、软骨和平滑肌,引起免疫功能下降,加重NEC病情[5-6]。近年来有研究资料显示,对患儿采取回肠造口术治疗可有效改善患儿免疫功能[2]。但目前关于回肠造口术在NEC患儿中的广泛应用仍缺乏相关数据支持,且治疗效果判断和病情预测敏感指标暂不明确。因此本研究通过分析应激指标、免疫球蛋白与新生儿NEC回肠造口术疗效的相关性,以期为NEC患儿的治疗提供新的方向和策略。
1 资料与方法
1.1 临床资料
回顾性分析2016年4月至2019年4月我院收治并确诊的NEC患儿98例,其中采用回肠造口术治疗的49例患儿设为手术组,采用常规支持疗法治疗的49例患儿设为常规组。手术组男27例、女22例,平均年龄(8.22±1.03)d,足月儿20例、早产儿29例,出生体质量≥2 500 g者21例、出生体质量<2 500 g者28例。常规组男28例、女21例,平均年龄(8.41±1.03)d,足月儿22例、早产儿27例,出生体质量≥2 500 g者23例、出生体质量<2 500 g者26例。2组患儿上述基线资料分布差异无统计学意义(P>0.05),具有可比性。
本研究获得我院医学伦理会批准,患儿监护人均签署知情同意书。纳入标准:①由5年以上专科医师根据临床表现、实验室和超声检查诊断为NEC,符合NEC诊疗共识[7];②经Bell-NEC分级标准确定均为ⅡA~ⅢB期[8];③年龄≤28 d;④对治疗方法耐受,能完成本研究;⑤依从性较好,能配合治疗和检查;⑥临床资料完整,各项辅助检查完善;⑦正确采集血标本。排除标准:①合并先天性心脏病;②出现严重合并症或并发症需进行其他治疗;③2个或2个以上器官及系统功能损害;④近期应用免疫调节剂或激素类药;⑤过敏体质;⑥合并其他感染或出血;⑦合并肝肾损害。
1.2 方法
常规组患儿给予静脉营养、禁食(Ⅱ期7~10 d,Ⅲ期14 d以上,待临床情况好转、大便潜血转阴、X射线片异常征象消失后可逐渐恢复经口喂养)、胃肠减压、机械通气、抗感染(根据血培养阳性,参考其药物敏感试验结果选择抗生素,如为厌氧菌首选甲硝唑,肠球菌可选择万古霉素,疗程视病情轻重而异,一般7~10 d,重症14 d以上)、维持呼吸功能及水电解质平衡(每日供给液体量120~150 mL/kg,根据胃肠道丢失再做增减;给予胃肠外营养,保证每日378~462 kJ能量供给,并补充必需氨基酸、必需脂肪酸和维生素;有凝血机制障碍时可输新鲜冰冻血浆,严重血小板减少可输注血小板;出现体克时给予抗休克治疗)。
手术组患儿全身麻醉气管内插管后,经下腹部弧形切口或右下腹腹直肌切口,将末端回肠距回盲瓣10 cm处提出于切口外,分离对应肠系膜并切断结扎肠系膜血管直达系膜根部;以Kocher钳钳夹肠管两端,切断肠管,残端以乙醇纱球擦拭,远端肠管做2层荷包缝合;将肠管封闭后置入腹腔,在腹直肌外缘处做1个2~3 cm长的斜切口,切开腹外斜肌腱膜,切断腹内斜肌及腹横肌,切开腹膜;将近端肠管提出切口外约 4 cm长,将肠管浆肌层与腹膜、筋膜、皮肤分层间断缝合,以防造口肠管回缩或其他肠管经此切口疝出;造口暂时予以封闭,术后48~72 h再予开放,并做好导管固定、胃肠减压等术后护理,以减少切口污染。
1.3 观察指标
应激反应指标[干扰素-γ(IFN-γ)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)]及免疫指标[免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、补体3(C3)、补体4(C4)] 检测:分别于治疗前1 d和治疗后7 d抽取2组患儿静脉血3 mL,置于含促凝剂的真空采血管中,20 min内经4 ℃、3 000 r/min离心15 min,分离血清后置于-80 ℃冰箱保存备用;AITH-1600全自动生化分析仪对所有血标本进行检测,参照ELISA试剂盒说明书,采用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测IFN-γ、IL-6、TNF-α水平,免疫散射速率法检测IgA、IgM、C3、C4水平。
治疗后7 d,依据临床症状和腹部X射线平片检查判断疗效:显效为治疗后患儿腹泻、腹胀、便秘等临床症状体征显著缓解,吃奶量显著增加,肠壁囊样积气消失;有效为腹泻、腹胀、便秘等有所缓解,吃奶量有所增加,肠壁囊样积气有所消失;无效为腹泻、腹胀、便秘等临床症状和吃奶量、肠壁囊样积气无显著变化或加重甚至病死;病死为患儿因病死亡,并由专科医师判断为不可逆的脑死亡。临床有效率=(显效+有效)/总例数×100%,病死率=病死例数/总例数×100%。
采用电话及门诊检查相结合方式进行随访,患儿治疗时间为随访起点,随访至患儿死于NEC及NEC相关事件或治疗后1个月止,截尾数据为失访、随访结束时死于与NEC无关疾病。根据随访期间生存情况将手术组患儿分为存活组和病死组,比较2组临床资料(存活患儿以随访截止资料为准,病死患儿以死亡前最近随访资料为准)。
1.4 统计学方法
2 结果
2.1 手术组和常规组应激指标分析
治疗前,2组患儿IFN-γ、IL-6、TNF-α比较,差异无统计学意义(P>0.05);治疗后,2组患儿IFN-γ、IL-6、TNF-α均低于治疗前,且手术组低于常规组,差异有统计学意义(P<0.05),见表1。
2.2 手术组和常规组免疫球蛋白分析
治疗前,2组患儿IgA、IgM、C3、C4水平比较,差异无统计学意义(P>0.05);治疗后,2组患儿IgA、IgM、C3、C4水平均高于治疗前,且手术组高于常规组,差异有统计学意义(P<0.05),见表2。
2.3 手术组和常规组临床有效率、病死率分析
手术组临床有效率优于常规组,病死率低于常规组,差异均有统计学意义(P<0.05),见表3。
2.4 手术组病死和存活患儿临床资料特征
手术组存活和病死患儿是否足月、IFN-γ、IL-6、TNF-α、IgA、IgM、C3、C4比较差异有统计学意义(P<0.05),性别、出生体质量、年龄比较差异无统计学意义(P>0.05),见表4。
2.5 多因素Logistic回归分析
多因素Logistic回归分析结果显示,IFN-γ、IL-6、TNF-α升高而IgA、IgM、C3、C4降低是影响NEC患儿病死高危因素(P<0.05),见表5。
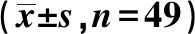
表1 手术组和常规组应激指标比较
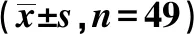
表2 手术组和常规组免疫球蛋白比较

表3 手术组和常规组临床有效率、病死率比较[n=49,例(%)]
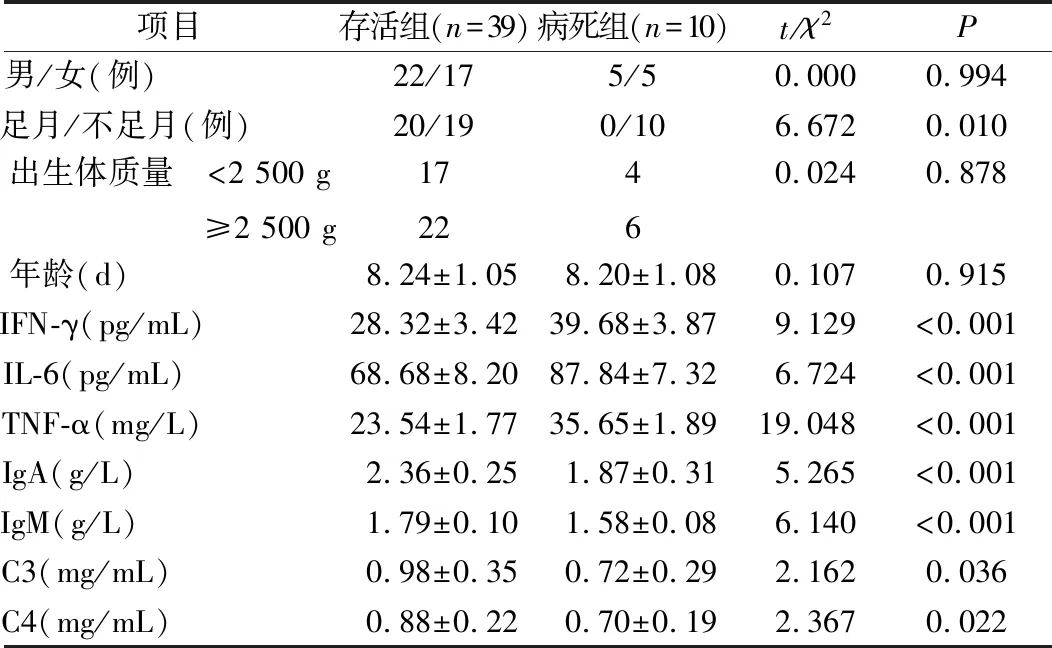
表4 手术组中病死和存活患儿临床资料比较
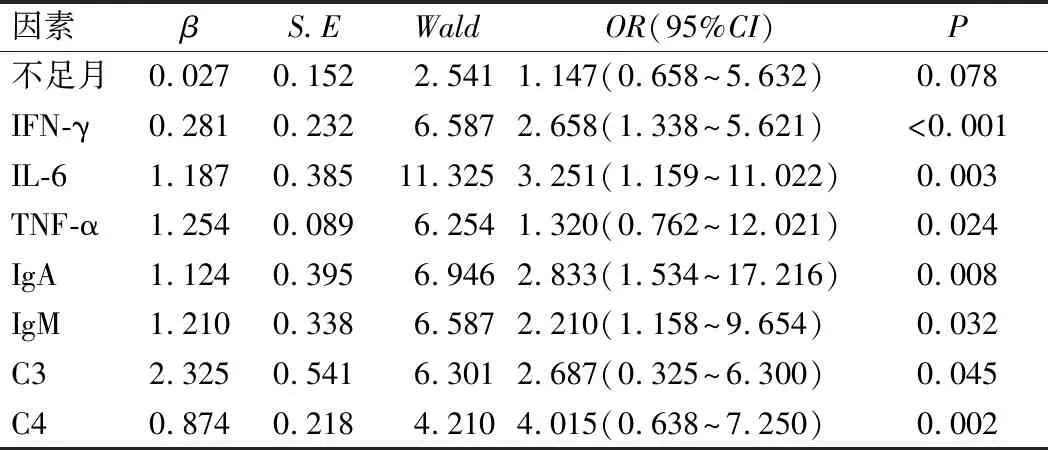
表5 多因素Logistic回归分析
3 讨论
NEC本质是IL-1、IL-8、IFN-γ等细胞因子释放导致的宿主自身免疫性损伤,在儿科病房NEC是引发小儿多器官及系统受累的主要原因[9]。目前认为,NEC发生和进展主要与免疫功能紊乱和炎症介质大量刺激生成有关。研究指出,胃肠道发生感染时肺部扩张,引起肺-血管紧张素-支气管系统兴奋,进而导致免疫功能受损,NEC病情进一步发展[10]。此外,肠道相关病菌侵犯消化道后,在内毒素作用下引发树突状细胞、单核巨噬细胞、自然杀伤细胞、血管内皮细胞等参与免疫应答,释放出大量炎症介质而引起免疫功能紊乱及炎症因子分泌增加[11],提示炎症应激反应和免疫球蛋白可共同作用于NEC,并影响该病进展与恶化。
基于NEC发病基础可知,治疗过程中关注其炎症因子和免疫球蛋白水平可更全面地判断治疗效果。一般来说,NEC未发生肠穿孔或无显著手术指征时可选择保守治疗,根据患儿营养需求给予静脉营养、禁食、胃肠减压、机械通气、抗感染、维持呼吸功能等治疗,可满足机体蛋白质代谢过程和神经、肠道功能恢复[12]。但由于NEC病情发展迅速,常规保守治疗对有效减少炎症因子、改善免疫功能效果不佳,易导致病情加重[13]。刘伟等[14]指出,当发生NEC时即可选择进行手术治疗,但手术介入治疗是否对一般情况良好的NEC患儿的预后有影响暂无定论,且暂无相关指标作为治疗效果判断的标准。本研究结果显示,对一般情况良好的NEC患儿而言,手术治疗疗效更好,病死率更低,患儿预后较好。本研究中,手术组患儿术后应激反应指标水平低于常规组,而免疫球蛋白水平高于常规组,说明手术治疗可有效降低患儿机体炎症应激反应、改善免疫功能。参考吴晓霞等[15]的研究,考虑原因为手术治疗NEC可直接切除坏死段小肠,避免肠坏死、穿孔,同时可通过改善应激指标和免疫球蛋白来提高临床疗效。本研究对病死率进行进一步的多因素分析发现,IFN-γ、IL-6、TNF-α表达升高而IgA、IgM、C3、C4表达降低是NEC影响患儿病死的高危因素,说明手术治疗可通过降低IFN-γ、IL-6、TNF-α水平,提高IgA、IgM、C3、C4水平,从而改善NEC患儿疗效。但吴书清等[16]则认为手术治疗不能改善机体免疫功能,考虑与其采取的手术方法为肠造瘘术有关。而本研究采用回肠造口术,具有适当的位置和腹壁孔径,可向外段提供足够的血液供应,可防止外漏,进而达到较好的治疗效果。进一步分析应激指标和免疫球蛋白参与NEC预后机制发现,肠道发生感染后机体免疫球蛋白呈高表达状态,血液和细胞外液中主要抗体IgA、IgM、C3、C4表达受到抑制,引起免疫功能下降[17]。另外,感染状态下毒素和病菌通过呼吸道、消化道和破损肠黏膜进入机体后,机体长期处于炎症应激状态,导致毒素和病菌在机体内大量增殖,引起炎症反应,体内IFN-γ、IL-6、TNF-α等炎症因子分泌增多,诱导机体产生迟发型变态反应性损伤[18-19]。本研究结果符合上述报道,证实了回肠造口术治疗NEC患儿机制为降低IFN-γ、IL-6、TNF-α而提高IgA、IgM、C3、C4水平。
综上所述,回肠造口术治疗NEC患儿具有较好的临床疗效,其作用机制是通过降低应激指标水平和提高免疫球蛋白,从而改善机体免疫功能,控制患者病情;应激指标和免疫球蛋白的监测可能为NEC防治和疗效判断的预测因子。但由于时间限制、样本量小,应激指标和免疫球蛋白与NEC关系及其对疾病进展的影响机制较复杂,且回肠造口术治疗NEC一般情况良好的患儿尚存在争议,仍需设计更为严密的多中心、大样本、双盲研究进一步明确应激指标、免疫球蛋白与NEC回肠造口术疗效相关性。