Notch3信号介导小胶质细胞活化在慢性前列腺炎疼痛中的作用
2020-05-07王永权周占松陆军军医大学第一附属医院全军泌尿中心重庆400038陆军军医大学神经生物学教研室重庆400038
张 恒,付 炯,何 鹏,王永权,杨 忠,周占松 (.陆军军医大学第一附属医院全军泌尿中心,重庆 400038;.陆军军医大学神经生物学教研室,重庆 400038)
慢性前列腺炎疼痛是泌尿男性生殖科的顽症,常表现为持续内脏牵涉痛,且前列腺炎症消失后疼痛相关症状仍持续存在,其发生已证实与神经机制的异常有关。脊髓小胶质细胞是中枢系统的重要免疫细胞,在神经病理性疼痛中可通过分泌炎症介质因子而致痛。疼痛领域初步研究还发现,Notch3参与胶质细胞神经病理性痛觉信息的传递,是调控痛觉传导的关键信号分子之一,但慢性前列腺炎疼痛中Notch3是否通过介导小胶质细胞活化引起持续的前列腺炎疼痛尚有待研究[1]。本研究通过建立慢性前列腺炎疼痛大鼠模型,观察L5~S2脊段Notch3信号是否介导小胶质细胞活化,并通过调节致痛炎症因子导致中枢的痛觉过敏,以进一步阐明慢性前列腺炎疼痛发生的神经机制。
1 材料与方法
1.1 主要试剂和仪器
CFA购自Sigma公司(美国),Notch3和IBA-1引物合成由基康生物公司完成(中国),RT-PCR kit和ELISA kit购自上海生工(中国),SYBR green PCR core reagent kit 购自Applied Biosystems公司(美国),DNA Engine OPTIONTm2购自MJ research 公司(美国)。
1.2 方法
1.2.1 动物模型的建立和分组 慢性前列腺炎疼痛大鼠模型参照Nackley等[2]和 Butler等[3]的方法建立,成年雄性特异性无病原体(specific pathogen free,SPF)大鼠由陆军军医大学动物实验中心提供,体质量(200±25)g。实验分为两部分:一是疼痛模型的鉴定、Notch3和小胶质细胞活化,炎症因子的检测,完全随机分为实验组和对照组(n=6)。大鼠均采用1%戊巴比妥钠腹腔注射,前列腺经下腹正中小切口(1 cm)暴露,实验组大鼠前列腺双侧叶各注射完全弗氏佐剂(complete Freund’s adjuvant,CFA)10 μL,对照组双侧叶注射等量生理盐水。两组大鼠均用5-0可吸收线缝合关闭切口,消毒包扎,术后大鼠置于安静、温暖、避光环境饲养,12 h后按时相点进行后续相应实验;炎症组织学检查取注射后12 d大鼠组织,其余实验取4个时相点:0、4、12、24 d。第二部分为模型大鼠鞘内注射阻断Notch3和小胶质细胞后进行炎症因子检测,实验分为3组(n=6),分别在鞘内注射:①Notch3受体拮抗剂N-乙酰半胱氨酸(NAC) 4 mmol/L为NAC组;②小胶质细胞抑制剂米诺环素(minocycline)5 mol/L为minocycline组;③等体积人工脑脊液 (ACSF,pH 5.5)为ACSF组。所有程序均遵守实验动物使用指南。
1.2.2 热辐射痛阈法疼痛模型鉴定 实验大鼠置于底为3 mm厚的有机玻璃箱(2 cm×12 cm×22 cm)中,大鼠适应环境30 min后,利用热辐射刺激仪(12 V、 50 W )发出5 mm光斑照射大鼠足底,从照射开始至大鼠出现抬腿回避时间即为热缩腿反射潜伏期(thermal withdrawal latency,TWL),每次照射时间不超过30 s,最长记为30 s,二次测量最少间隔10 min,每只测量5次,去掉最大和最小值,计算3次平均值时间。
1.2.3 大鼠前列腺炎症模型组织鉴定 大鼠注射CFA 12 d后,经腹腔注射10%水合氯醛(0.3 mL/100 g)麻醉,经心脏灌入200 mL 0.9%生理盐水,然后再灌入48 ℃、含4%多聚甲醛的0.01 mol/L磷酸盐缓冲液约300 mL,剖腹收集左右前列腺组织,标本固定在4 ℃、4%多聚甲醛中过夜、包埋、石蜡切片常规染色、切片在显微镜下检查。
1.2.4 qRT-PCR检测Notch3 和IBA-1mRNA的表达 将实验大鼠分别在注射CFA 后0、4、12、24 d断头处死,游离取出L5~S2脊段双侧的后角组织,称取相同量的组织使用RT-PCR kit提取RNA,分光光度法测定总RNA的纯度,A260和A280的比值为1.8~2.0,取2 μg 总RNA 进行cDNA逆转录,反应条件为70 ℃,5 min→37 ℃,60 min→70 ℃,10 min。再取20 ng cDNA进行qRT-PCR检测目标基因。循环条件为50 ℃,30 min→95 ℃,15 min→94 ℃,15 s→56 ℃,15 s→72 ℃,30 s。共40个循环。用GAPDH作为内参,建立扩增的标准曲线和分析计算,用与内参的相对值来检测样本的表达量。 目标基因和内参引物序列为IBA-1:TTG ATC TGA ATG GCA ATG GA (forward) , CCT CCA ATT AGG GCA ACT CA (reverse);Notch3:TGG CGC CTC TTC AAC AAC A(forward) , ATC CCA GCC GCA CTC CTC (reverse); GAPDH:TTT AAC TCT GGT AAA GTG GAT ATT GTT G(forward) , ATT TCC ATT GAT GAC AAG CTT CC (reverse)。
1.2.5 ELISA检测TNF-α、IL-1β的表达 分别在注射CFA 0、4、12、24 d时将模型大鼠的L5~S2全部脊髓后角取出,再将相同量的组织加入0.5 mL冰裂解液(50 mmol/L Tris,150 mmol/L NaCl,1% TritonX-100,0.5%钠脱氧胆酸盐,l mmol/L PMSF,0.1% SDS,10 mmol/L氟化钠和1 mmol/L硫酸钠)。冰上匀浆,以1 800 r/min离心10 min, 收集上清液,采用ELISA试剂盒检测IL-1β和TNF-α的含量。
1.2.6 鞘内注射抑制Notch3和小胶质细胞 按Yaksh等[4]的方法鞘内置管。大鼠以1%戊巴比妥钠腹腔注射麻醉,CFA同法注射前列腺制作疼痛模型,再暴露大鼠寰枕膜,用PE-10插管小心插入脊髓蛛网膜下腔,进管约6 cm,有脑脊液溢出即封闭外口,缝合皮肤,并将PE-10管固定于皮肤以防止脱落,恢复期为7 d,术后无运动障碍用于进一步的实验,按前述分组连续鞘内注射5 d,注射量为15 μL,均用5 μL的ACSF冲洗,注射在5 min内完成。5 d后同法取脊髓组织用ELISA测定TNF-α和IL-1β的含量。
1.3 统计学分析
2 结果
2.1 热辐射痛阈法测定模型大鼠的痛觉
实验组大鼠的TWL时间较对照组明显缩短(P<0.01),说明前列腺注射CFA后导致了大鼠的痛觉过敏,成功建立了慢性前列腺炎疼痛的大鼠模型(表1)。
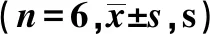
表1 实验组和对照组TWL时间比较
*:与对照组比较,P<0.01;#:与0 d比较,P<0.01
2.2 前列腺病理切片观察
CFA注射的前列腺炎组的大鼠前列腺组织可见细胞变性,坏死脱落,皱缩,间质内有大量的淋巴细胞、单核细胞聚焦,部分淋巴细胞成簇状浸润;而注射生理盐水的对照组大鼠前列腺组织结构基本正常,无明显炎性细胞浸润,提示CFA注射可建立明显的前列腺炎模型(图1)。
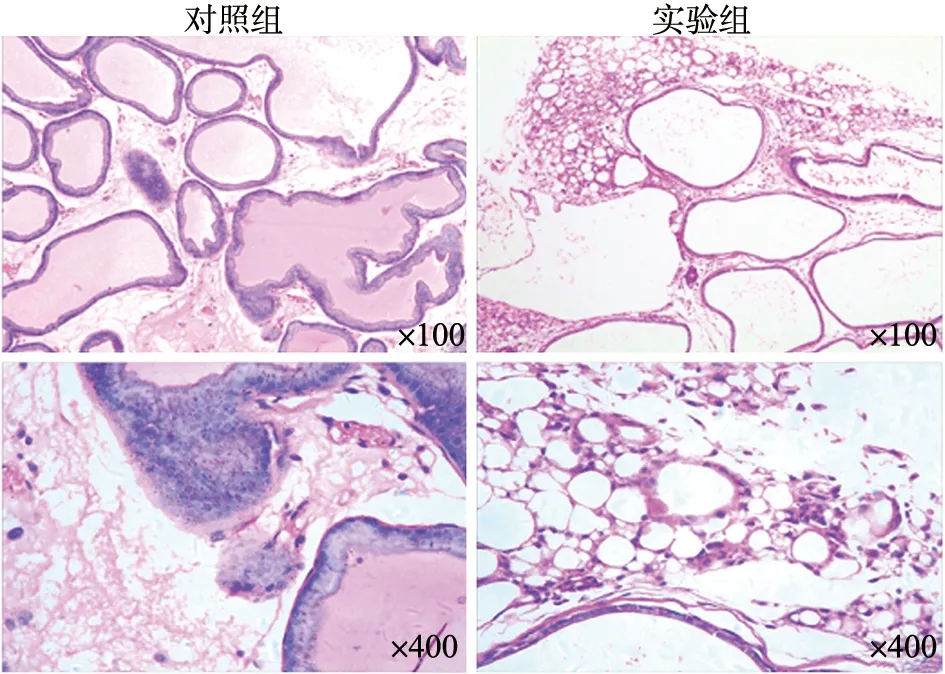
图1 前列腺炎实验组大鼠组织学检查
2.3 L5~S2脊段Notch3和IBA-1 mRNA的表达
qRT-PCR结果显示,疼痛模型大鼠L5~S2脊髓小胶质细胞标志物IBA-1和Notch3 mRNA在4 d、12 d和24 d 的表达均明显高于对照组 (P<0.01),峰值出现在12 d,表明慢性炎症实验组L5~S2脊髓中枢存在小胶质细胞活化和Notch3信号的激活(表2、3)。
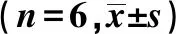
表2 L5~S2脊段Notch3 mRNA相对表达量
*:与对照组比较,P<0.01;#:与0 d比较,P<0.01;△:与4 d比较,P<0.05
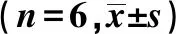
表3 L5~S2脊段IBA-1 mRNA相对表达量
*:与对照组比较,P<0.01;#:与0 d比较,P<0.01;△:与4 d比较P<0.05
2.4 L5~S2脊段TNF-α、IL-1β的分泌
ELISA结果显示,实验组大鼠L5~S2脊髓组织内炎症因子TNF-α、IL-1β含量在4 d时开始升高、12 d时最高,24 d下降,数值均明显高于对照组(P<0.01) (表4、5)。
表4 L5~S2脊段TNF-的表达
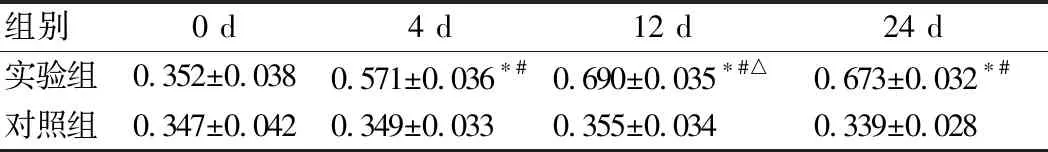
组别0 d4 d12 d24 d实验组0.352±0.0380.571±0.036∗#0.690±0.035∗#△0.673±0.032∗#对照组0.347±0.0420.349±0.0330.355±0.0340.339±0.028
*:与对照组比较,P<0.01;#:与0 d比较,P<0.01;△:与4 d比较,P<0.05
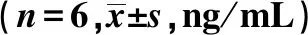

组别 0 d4 d12 d24 d实验组0.249±0.0280.390±0.038∗#0.493±0.027∗#△0.459±0.026∗#对照组0.261±0.0290.273±0.0290.250±0.0280.261±0.018
*:与对照组比较,P<0.01;#:与0 d比较,P<0.01;△:与4 d比较,P<0.05
2.5 Notch3和小胶质细胞抑制后炎症因子表达
鞘内置管后持续注射Notch3和小胶质细胞,采用ELISA检测到NAC组、minocycline组大鼠L5~S2脊髓组织内炎症因子TNF-α、IL-1β含量明显低于ACSF组(P<0.01) ,见表6。
表6 抑制Notch3和小胶质细胞后L5~S2脊段IL-1β和TNF-表达
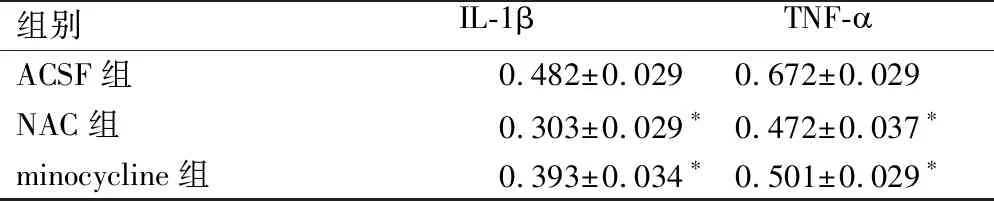
*:与ACSF组比较,P<0.01
3 讨论
慢性前列腺炎(chronic prostatitis,CP)是泌尿科最常见的疾病,占门诊患者的25%~35%,最新的流行病学数据显示,50岁以下男性具有前列腺炎症状的比例可能高达11.5%,其中慢性无菌性前列腺炎(Ⅲa型)/慢性盆腔疼痛综合征(CPPS)( Ⅲb型)则占临床前列腺炎患者的90%左右[5]。慢性前列腺炎疼痛的病因和发生机制仍不明确,长期的疼痛可引起患者严重的身心障碍,目前尚缺乏有效的治疗手段,其诊治已成为国内外泌尿学科的难题[6]。因此,对慢性前列腺炎疼痛发生机制的研究极其重要,相关理论的研究可以为该病的临床诊治带来新的治疗方法。
Shoskes等[7]于2009年提出了著名的前列腺炎的UPOINT的疾病分类体系,为慢性前列腺炎的诊治提供了一个新的思路,并得到了广泛的认可。UPOINT 将慢性前列腺炎归结为6大基本“临床表型” :U 即urinary,P 即psychosocial,O 即organ-specific,I 即infection,N 即neurologic /systemic,T 即tenderness。这个分类系统显示,慢性前列腺炎疼痛常表现为不同程度且不易治愈的会阴部疼痛不适,并常伴有膀胱尿道功能障碍,是患者就诊的主要原因。但循证医学研究发现,虽然随着认识的深入,治疗方法有了很大程度的改进,但主要表现为疼痛和排尿症状的前列腺炎患者的生活质量并无明显改善[8]。因此前列腺炎疼痛病因可能不局限于前列腺本身的感染,而应存在中枢神经调控机制的异常[9]。慢性前列腺炎疼痛常呈现出两个明显的临床特点:①疼痛的泛化,疼痛不仅限于前列腺所在部分,而是分布在与膀胱尿道神经支配相关的L5~S2骶神经支配区,在没有原发病变的其他部位可出现自发疼痛,并存在着不同程度的膀胱和尿道肌肉功能障碍,表现出内脏牵涉痛的特点;②疼痛的持续,临床上可见有些前列腺炎疼痛在前列腺炎症消失后仍存在持续疼痛。所以各种临床现象提示:慢性前列腺炎疼痛极有可能是一种持续的内脏神经牵涉痛,其疼痛的发生与支配前列腺相应脊段的神经改变有关[10]。我们前期的研究中建立了稳定的前列腺疼痛大鼠模型,发现慢性前列腺炎疼痛中L5~S2中枢胶质细胞活化与中枢痛敏形成密切相关,与慢性前列腺炎疼痛内脏牵涉痛的发生密切相关[11-12]。
脊髓背角是机体痛觉调制或整合的重要中枢,研究显示疼痛调制不仅由神经元网络完成,星形胶质细胞和小胶质细胞活化也参与了许多疼痛调制[13],痛觉信息可通过多种炎症因子激活胶质细胞,而星形胶质细胞活化是慢性神经病理性疼痛产生与维持的关键因素[14]。小胶质细胞广泛分布在中枢神经系统,正常生理状态下,小胶质细胞被认为是中枢神经系统的“休眠”细胞,但其并不是静止的,当中枢神经系统受外伤、缺血和感染等伤害性刺激后迅即激活,产生一些痛觉调质或增痛物质,如神经营养因子(BNDF)、白介素(IL)、肿瘤坏死因子(TNF)等炎症介质,这些因子增加局部突触可塑性和突触效率,其高表达可引起神经细胞的痛敏,并参与神经损伤后伤害性感受器的再生,在动物神经损伤和疼痛模型中可观察到炎症因子在胶质细胞中的表达升高,通过鞘内注射转录因子及炎症因子拮抗剂等手段能减弱病理性疼痛大鼠的超敏现象[15-16]。除分泌炎症因子外,小胶质细胞与神经元间存在着双向信息交流,小胶质细胞能影响神经元活动,实验研究显示抑制小胶质细胞的活化可以减少痛觉超敏的发生,如坐骨神经炎性损伤模型大鼠,鞘内注射小胶质细胞活化的抑制剂minocycline可抑制低阈值的机械性异常疼痛[17]。研究显示,胶质细胞活化需要特定的受体介导下的信号通路激活,近年来Notch信号在胶质细胞活化中的介导作用引起了疼痛学的极大关注,已证实Notch信号通路的抑制可降低由脊神经损伤所致的神经病理性疼痛的发生[18]。
Notch信号是一个在进化中高度保守的反映细胞间通讯的信号通路,调控细胞的分化和增殖,在胚胎发育和细胞命运中发挥决定性作用,哺乳动物神经系统中有 4 种Notch受体(Notch 1~4)和多种配体(Jagged 1、2和Delta 1、3、4),都是单次跨膜蛋白,Notch及其配体的胞外段都含有多重的表皮生长因子重复区,可通过加糖基化进行修饰。Notch受体同样含有几种区域使得受体在缺乏配体的情况下保持其灭活状态,当受体和配体结合后,γ-分泌酶复合体即可对Notch的跨膜段进行裂解,释放Notch胞内段NICD到细胞液中,而胞外段NECD将和配体一同经过内吞作用进入“信号发送细胞”,即所表达配体的细胞。配体同样可被γ-分泌酶切割而发挥相应的信号转导作用。目前,Notch因为可以激活炎症细胞产生炎症介质,在痛觉调制中的作用已引起了广泛关注。
Notch信号通路可以通过兴奋或抑制神经元,从而参与中枢痛敏机制的形成,但其相关机理至今仍不清楚[19]。Woolf等[20]发表经典慢性病理性痛机制:生理痛反应期系外周伤害性信息传入大脑皮质产生正常痛觉,在病理性痛早期,主要是受体和通道磷酸化,胞内信号转导通路被激活,是翻译后水平的变化,而在疼痛慢性期,主要是受体、通道和胞内信号转导通路发生长时程、持续性的变化,累及递质表达、突触连接方式、神经元结构和存活等多个环节,是核转录和翻译水平的变化。其中信号通路的激活,继而影响核转录和翻译水平的变化,被看作神经可塑性改变的重要环节。人体组织的Notch基因,不仅在胚胎期参与神经干细胞的增殖、分化以及神经元的学习和记忆;而且在成年哺乳动物神经损伤后表达会显著增高,参与胶质细胞激活和神经重塑过程,抑制Notch信号具有明显的镇痛的作用[21-22]。疼痛学最新的研究发现,Notch3与神经性病理疼痛的关系密切,引起了高度的关注,Notch3信号通路可参与成年动物的神经可塑性改变,脊髓背角Notch3 活化水平高,神经元的兴奋性增高,而Notch3活化水平低,则神经元抑制[1]。相关实验结果还显示,该通路的激活可促进神经干细胞向胶质细胞的分化,参与了正常神经网络形成等过程[23]。在动物缺氧等损伤模型上的研究发现,Notch3 通路的活化还具有激活胶质细胞的功能,提示Notch3信号通路有可能在成体神经系统损伤后的可塑性变化起重要作用,而且Notch3信号参与多种体内的炎性损伤反应,并与其他炎症通路信号之间形成交互网络[24-26]。本研究观察到了前列腺炎疼痛模型中存在小胶质细胞Notch3的高表达,并证实了通过抑制小胶质细胞和Notch3活化可以有效减少炎症因子的分泌,从而缓解慢性前列腺炎的神经炎性疼痛。
慢性前列腺炎疼痛作为一种常见的炎性内脏痛,发病率高且不易治疗,研究该疼痛的产生的神经免疫机制、外周机制以及中枢机制等之间联系以及相互作用途径非常有意义,可以为以后临床慢性前列腺炎疼痛新机制的研究、寻找药物治疗的新靶点寻找方向。本研究证实,慢性前列腺炎疼痛存在相应L5~S2脊段神经调控机制的异常,脊髓小胶质细胞活化在疼痛发生和维持中起了重要作用,而且小胶质细胞活化与Notch3信号激活有关, Notch3在慢性前列腺炎疼痛中可能介导小胶质细胞激活,通过炎症因子分泌,参与伤害性信息传导和痛觉调制,在中枢痛敏形成中起着关键作用,除了我们发现的炎症因子分泌外,Notch3信号还可能通过影响神经元兴奋性、胶质细胞的再生和激活,从而通过调控膜受体、离子通道、多种细胞因子和神经递质的表达以及突触可塑性的变化等途径发挥致痛作用[27],这些机制还有待下一步的深入研究。