miR-138-5p靶向HIF-1α影响人白血病K562细胞增殖和侵袭转移
2020-05-07纪冬梅李艳平王晓红朝阳市中心医院血液内科辽宁朝阳122000
郭 涛,纪冬梅,李艳平,卢 阳,弋 莉,王晓红 (朝阳市中心医院血液内科,辽宁 朝阳 122000)
白血病以骨髓中造血干细胞无限增殖为特点,除急性粒细胞和急性淋巴细胞白血病之外,慢性粒细胞白血病(chronic myelogenous leukemia,CML)是最常见的白血病种类,是由粒细胞系造血干细胞的恶性增殖所致[1-4]。目前,CML的主要治疗途径是BCR/ABL融合蛋白靶向药物联合酪氨酸激酶抑制剂,但只在慢性期有效,对于急性期BCR/ABL融合蛋白阳性病例疗效欠佳[5-6]。此外,化疗药物通常缺乏肿瘤特异性,化疗药物或酪氨酸激酶抑制剂的长期使用还会导致肿瘤细胞产生耐药性[7]。因此,探索新的CML治疗方法对提高疗效、减轻副作用具有重要意义。MicroRNAs(miR)是一种内源性非编码小分子RNA,存在于所有真核细胞中,长度约为22个核苷酸,参与调控细胞生长、增殖、凋亡和迁移等过程,在机体中扮演着十分重要的角色。研究表明,miR的异常表达常与多种疾病发展进程密切相关,调控其表达在癌症治疗方面存在巨大潜力[8-9]。研究表明,miR-138-5p对人肾癌、胰腺癌和鼻咽癌等肿瘤细胞的侵袭、迁移及化疗敏感性具有一定的调节作用[10-12]。但miR-138-5p在人白血病中的作用研究尚未见报道,据报道,四砷四硫化物(As4S4)治疗白血病的机制与下调miR-181密切相关,而miR-138被证明对多种癌症的生存和转移具有抑制作用[10-13]。另外,HIF-1α的表达增加可加强肿瘤的化学抗辐射性,而通过RNA或小分子靶向抑制HIF-1α能抑制白血病细胞体内外生长[14-15]。故本研究以体外培养的人白血病K562细胞为研究对象,探讨miR-138-5p对人白血病K562细胞增殖、侵袭和迁移的影响。
1 材料与方法
1.1 仪器与试剂
人白血病K562细胞株购自美国典型培养物保藏中心。恒温培养箱购自美国Thermofisher公司,实时荧光定量PCR仪购自美国AB公司,电泳仪和半干转膜仪购自美国伯乐公司,Gel View 6000化学发光凝胶成像系统购自广州云星仪器有限公司,超净工作台购自苏州中亚净化设备有限公司,RPMI1640、胎牛血清及TurboFect Transfection Regent脂质体转染试剂均购自Thermo Fisher公司,荧光素酶报告基因检测试剂盒购自Promega公司,RNA提取试剂盒和定量PCR试剂盒均购自宝生物工程大连有限公司,抗体均购自英国Abcam公司;引物使用Primer 5.0软件设计,由上海生工生物工程技术服务有限公司合成。miR-138 mimic、pc-HIF-1α及含HIF-1α野生型/突变型的荧光素酶报告基因质粒载体均由上海Genepharm公司合成。
1.2 细胞培养
用含10%胎牛血清和1%青-链霉素的RPMI1640培养基培养人白血病K562细胞,培养条件为37 ℃,5% CO2。每2~3 d换液1次,当细胞融合率达80%时可进行传代。取对数生长期细胞进行后续实验。
1.3 细胞分组与转染
将K562细胞分为K562组、miR-138 mimic组、HIF-1α过表达组(pc-HIF-1α组)和共转染组(mimic+pc-HIF-1α组)。严格按照转染试剂说明书,将miR-138-5p mimic和pc-HIF-1α单独或共转染入K562细胞中,此外另设mimic-scramble组作为miR-138-5p mimic转染的阴性对照,转染48 h后进行相应检测。
1.4 荧光素酶报告实验
严格按照说明书,将HIF-1α野生型/突变型载体或/和miR-138-5p mimic转染入K562细胞中,培养48 h后,3 500 r/min离心2 min,小心吸弃培养基。PBS洗涤细胞后,再加入细胞裂解液,于室温下振荡5~10 min,收集并在3 000 r/min条件下离心5 min,取上清进行检测。
1.5 实时定量PCR检测miR-138-5p和HIF-1α mRNA相对表达水平
收集各组细胞,严格按照试剂盒说明书,提取细胞总RNA并反转成cDNA,然后用引物进行qRT-PCR。miR-138-5p引物,上游:5′-AGCTGGTGTTGTGAATCAGGCCG-3′,下游:5′-CAGTGCGTGTCGTGGAGT-3′;HIF-1α引物,上游:5′-TTGCTCATCAGTTGCCACTTCC-3′,下游:5′-AGCAATTCATCTGTGCTTTCATGTC-3′;GAPDH 引物,上游:5′-ATCAAGAAGGTGGTGAAGCA-3′,下游:5′-CAAAGGTGGAGGAGTGGGT-3′。按照试剂盒说明书进行检测,用公式2-ΔΔCt计算相对表达量。
1.6 CCK8实验检测细胞增殖
培养结束后,每孔加入10 μL CCK8溶液,继续孵育4 h,采用酶标仪在450 nm波长处检测各组细胞的吸光度。细胞生长倍数=各组目标时间吸光度/0 h吸光度。
1.7 Western blot检测HIF-1α、Ki67、PCNA、VEGF、N-cadherin和E-cadherin蛋白的表达水平
收集各组细胞,经PBS洗涤3次后,提取总蛋白,用BCA法定量蛋白,取等量变性后蛋白进行SDS-PAGE凝胶电泳分离,并转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜。然后用5%的牛血清蛋白(bull serum albumin,BSA)封闭1 h,再加入适当稀释浓度的一抗,4 ℃孵育过夜。第2天洗膜后加入适当稀释浓度的辣根过氧化物酶标记的相应二抗,室温孵育1 h。滴加发光液曝光,于凝胶成像仪中拍照,并统计灰度值以计算相对蛋白表达量。
1.8 统计学分析
2 结果
2.1 miR-138-5p与HIF-1α的靶向关系
生物信息学结果显示,miR-138-5p与HIF-1α的3′UTR端存在连续的结合位点,提示两者可能存在靶向关系。荧光素酶报告实验结果显示,结合位点突变前后,细胞荧光素酶活性差异无统计学意义(P>0.05),但野生型HIF-1α质粒与miR-138 mimic共转染细胞后,K562细胞荧光素酶活性显著降低(P<0.01),而突变型HIF-1α质粒与miR-138-5p mimic共转染细胞后,K562细胞荧光素酶活性无明显变化(P>0.05),见图1。上述结果提示,miR-138-5p能靶向HIF-1α。
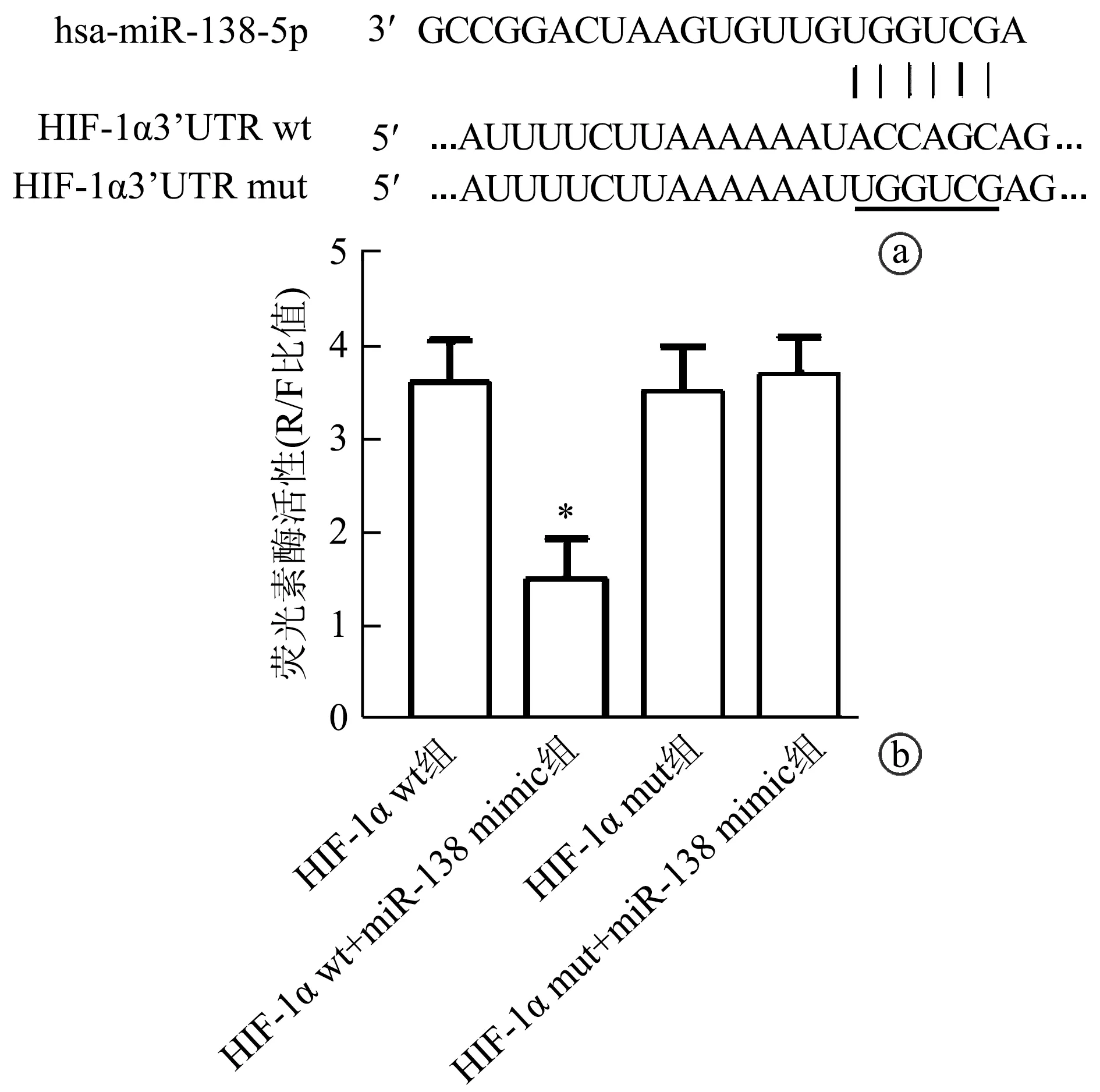
图1 miR-138-5p靶向HIF-1α
2.2 miR-138对K562细胞HIF-1αmRNA表达的影响
qRT-PCR实验结果显示,miR-138 mimic组miR-138-5pmRNA表达高于K562组,HIF-1α mRNA表达则低于K562组,差异具有极显著性统计学意义(P<0.01);而mimic-scramble组miR-138-5p和HIF-1α的mRNA表达水平与K562组比较差异无统计学意义(P>0.05),见图2。上述结果提示,miR-138 mimic能下调HIF-1αmRNA在人白血病K562细胞中的表达水平。
2.3 miR-138对K562细胞中HIF-1α蛋白表达的影响
Western blot结果显示,miR-138 mimic组HIF-1α蛋白表达水平显著低于K562组,而pc-HIF-1α组高于K562组,差异具有极显著性统计学意义(P<0.01);同时,mimic+pc-HIF-1α组HIF-1α蛋白表达少于pc-HIF-1α组,差异具有极显著性统计学意义(P<0.01),见图3。上述结果提示,miR-138-5p mimic能下调人白血病K562细胞中HIF-1α蛋白的表达。
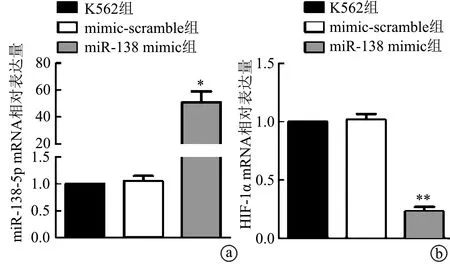
a:miR-138-5p mRNA相对表达量;b:qRT-PCR检测K562细胞中HIF-1α mRNA相对表达量 *:与K562组比较,P<0.01
图2 qRT-PCR检测K562细胞中miR-138-5p和HIF-1α mRNA表达水平
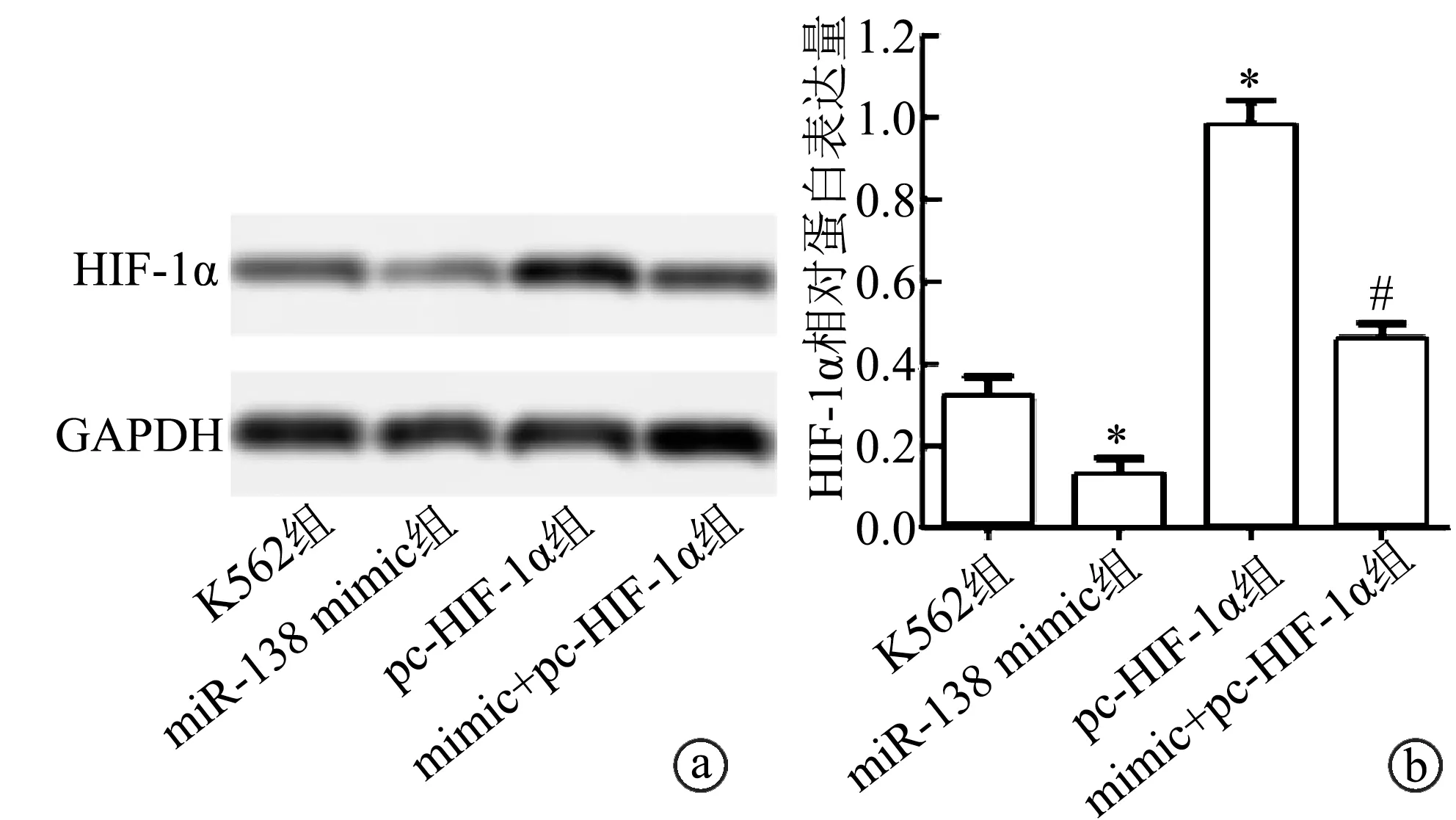
a:Western blot检测K562细胞中HIF-1蛋白表达的电泳图;b:相对表达量分析 *:与K562组比较,P<0.01;#:与pc-HIF-1α组比较,P<0.01
图3 Western blot检测K562细胞中HIF-1α蛋白的表达
2.4 miR-138-5p靶向HIF-1α对K562细胞增殖影响
CCK-8实验结果显示,miR-138 mimic组K562细胞增殖倍数低于K562组,差异具有极显著性统计学意义(P<0.01);pc-HIF-1α组K562细胞增殖倍数高于K652组,差异具有极显著性统计学意义(P<0.01);mimic+pc-HIF-1α组K562细胞增殖倍数低于pc-HIF-1α组,差异具有极显著性统计学意义(P<0.01),见图4。上述结果提示,miR-138-5p靶向HIF-1α对人白血病K562细胞增殖能力有抑制作用。
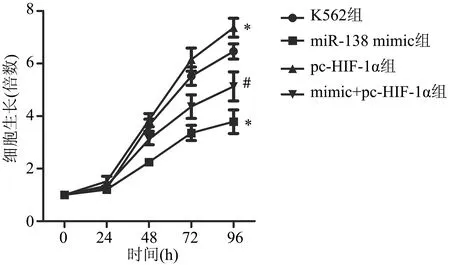
*:与K562组比较,P<0.01;#:与pc-HIF-1α组比较,P<0.01
图4 CCK-8法检测K562细胞增殖
2.5 miR-138-5p靶向HIF-1α对K562细胞侵袭能力的影响
Transwell实验结果显示,miR-138 mimic组侵袭细胞数量少于K562组,差异具有极显著性统计学意义(P<0.01);pc-HIF-1α组侵袭细胞数量多于K562组,差异具有极显著性统计学意义(P<0.01);mimic+pc-HIF-1α组侵袭细胞数量少于pc-HIF-1α组,差异具有极显著性统计学意义(P<0.01),见图5。上述结果提示,miR-138-5p靶向HIF-1α对人白血病K562细胞侵袭能力有抑制作用。
2.6 miR-138-5p靶向HIF-1α对K562细胞迁移能力的影响
划痕实验检测结果显示:miR-138 mimic组划痕闭合率低于K562组,差异具有极显著性统计学意义(P<0.01);而pc-HIF-1α组划痕闭合率高于K562组,差异具有极显著性统计学意义(P<0.01);mimic+pc-HIF-1α组划痕闭合率低于pc-HIF-1α组,差异具有极显著性统计学意义(P<0.01),见图6。上述结果提示,miR-138-5p靶向HIF-1α对人白血病K562细胞迁移能力有抑制作用。
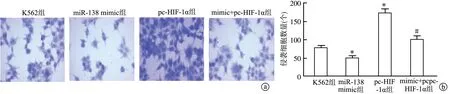
a:Transwell检测K562细胞侵袭能力(结晶紫染色×400);b:Transwell定量分析 *:与K562组比较,P<0.01;#:与pc-HIF-1α组比较,P<0.01
图5 Transwell检测K562细胞侵袭能力
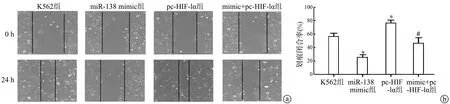
a:划痕实验检测K562细胞迁移能力(×200);b:划痕实验定量分析 *:与K562组比较,P<0.01;#:与pc-HIF-1α组比较,P<0.01
2.7 miR-138-5p靶向HIF-1α对K562细胞增殖和EMT相关蛋白表达的影响
Western blot结果显示,miR-138 mimic组增殖蛋白(Ki67、PCNA)、迁移标记蛋白(VEGF)和间质标记蛋白(N-cadherin)表达低于K562组,而上皮标记蛋白(E-cadherin)表达高于K562组,差异均具有极显著性统计学意义(P<0.01);pc-HIF-1α组则正好相反(P<0.01)。mimic+pc-HIF-1α组Ki67、PCNA、VEGF和N-cadherin表达低于pc-HIF-1α组(P<0.01),E-cadherin蛋白表达高于pc-HIF-1α组,差异均具有统计学意义(P<0.01),见图7。以上结果说明,miR-138-5p靶向HIF-1α可降低人白血病K562细胞的增殖和转移能力。
3 讨论
miR在癌症的发生发展中起着重要作用,参与调节多种肿瘤细胞增殖、凋亡、侵袭和迁移等,被认为是癌症靶向治疗的潜在作用靶点。寻找合适的靶点对癌症的靶向治疗具有重要作用,在针对肿瘤细胞起作用的同时减少机体毒副作用是靶向药物实现理想疗效的重要目标。本研究通过体外培养人白血病K562细胞,旨在探讨miR-138-5p与HIF-1α的靶向关系及其对人白血病K562细胞体外生长和转移特性的影响。
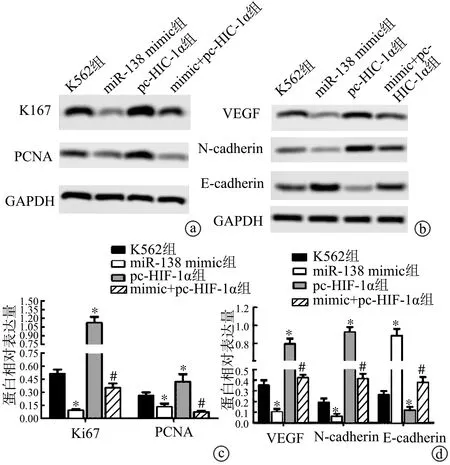
a:Western blot检测K562细胞增殖能力;b:Western blot检测K562细胞转移能力;c:Western blot检测K562细胞增殖能力定量分析结果;d:Western blot检测K562细胞转移能力定量分析结果 *:与K562组比较,P<0.01;#:与pc-HIF-1α组比较,P<0.01
图7 Western blot检测K562细胞增殖和转移能力
细胞异常增殖是肿瘤的一大特点,miR在调节癌细胞增殖方面具有重要作用。Wang等[16]的研究发现,miR-335在多种癌症中发挥癌基因或肿瘤抑制因子作用,能靶向抑制BCL-WmRNA的表达,从而降低透明细胞肾细胞癌786-O和CaKi-1细胞的增殖和侵袭能力。miR-34a靶向HMGB1从而促进急性髓细胞白血病细胞凋亡和抑制其自噬[17]。而Yu等[18]研究发现,miR-138-5p靶向抑制FOXC1从而减弱胰腺癌细胞的增殖能力;此外,miR-138-5p靶向抑制程序性细胞死亡配体1(programmed cell death ligand 1,PD-L1)可降低人结直肠癌细胞的增殖能力[19]。本研究通过生物学预测miR-138-5p与HIF-1α存在连续的结合位点,并进一步采用荧光素酶报告实验加以证实。之后我们采用CCK-8法发现,miR-138-5p靶向HIF-1α能显著降低人白血病K562细胞的体外增殖能力。Western blot结果也证明,miR-138-5p靶向HIF-1α能有效抑制人白血病K562细胞中增殖关键蛋白Ki67和PCNA的蛋白水平,从而实现对其体外生长能力的抑制作用。
癌细胞的侵袭转移能力在肿瘤的发生发展过程中至关重要,miR已被证明可调节多种肿瘤细胞的侵袭转移能力。研究发现,miR-141通过靶向调控促红细胞生成素产生肝细胞受体A2的表达,从而抑制肾癌786-O和A498细胞侵袭[20];miR-155调节BRG1表达从而抑制多种人白血病和淋巴瘤DLBCL细胞的增殖和转移[21]。值得注意的是,miR-138-5p对膀胱癌细胞侵袭能力的调节作用是通过靶向凋亡抑制蛋白家族关键成员Survivin实现的,而靶向上皮细胞自我更新关键蛋白δNp63则是miR-138-5p抑制口腔鳞状细胞癌细胞侵袭能力的机制[22-23]。本研究结果则发现,miR-138-5p可通过靶向并抑制HIF-1α蛋白和mRNA表达水平,进而减少体外培养的人白血病K562细胞的侵袭细胞数量和划痕闭合率,即降低K562细胞的体外侵袭转移能力。
上皮间质转化是指上皮细胞失去极性和细胞获得间质特性从而增加细胞转移和侵袭能力的过程,是多种肿瘤发生转移和侵袭的重要过程[24-25]。研究发现,VEGF的表达水平与肺癌预后有一定的相关性,其高表达能促进肿瘤浸润转移[26]。E-cadherin是一种重要的细胞黏附因子,参与并介导细胞之间相互黏附,维持细胞间的黏附及组织完整性,相当于一种抑癌因子,与多种肿瘤的侵袭转移密切相关,其低表达或者表达缺失被认为是肿瘤上皮间质转化的关键步骤[27]。Xiao等[28]研究发现,在小细胞肺癌中,miR-138-5p可靶向抑制Yes相关蛋白1,从而对细胞迁移起到抑制作用;Zhu等[29]研究发现,在骨肉瘤细胞中,miR-138-5p可靶向抑制组蛋白甲基化转移酶从而实现对肿瘤细胞迁移能力的抑制和对顺铂的敏感性。本研究发现,miR-138-5p靶向抑制HIF-1α表达同样抑制了人白血病K562细胞的迁移能力,同时Western blot实验也证实K562细胞迁移能力的抑制与抑制间质标记蛋白、迁移标记蛋白表达和促进上皮标记蛋白的表达水平相关。
综上所述,在体外培养的人白血病K562细胞中,miR-138-5p靶向并抑制HIF-1α表达水平,从而对K562细胞体外增殖、侵袭和迁移能力产生抑制作用。本课题组下一步计划建立人白血病移植瘤动物模型,探讨miR-138-5p对人白血病细胞体内生长和成瘤的影响,以期为白血病靶向治疗提供参考。