氯化钴诱导的N2a细胞缺氧损伤模型的机制研究
2020-05-06刘菲张昊刘博谭文
刘菲,张昊,刘博,谭文
(广东工业大学生物医药研究院,广东 广州 510006)
脑卒中是脑血管阻塞或破裂引起的急性缺血缺氧性脑病[1]。根据世界卫生组织(WHO)报道,在我国,脑卒中的致死率居各类疾病的首位,每年造成至少600万人死亡,而永久性缺血性脑卒中又是其中很重要的一部分[1-2]。N2a细胞是小鼠神经元母细胞瘤细胞株[3],是目前研究神经系统疾病的主要模式细胞。研究体外缺氧常用氯化钴(CoCl2)诱导N2a细胞缺氧损伤模型,该模型通过化学缺氧能够很好地模拟体内缺氧过程,但具体机制仍不十分明确。本研究拟采用CoCl2处理N2a细胞建立缺氧模型,并通过观察细胞缺氧损伤情况探讨细胞缺氧损伤的机制,为相关药物研发提供思路。
1 材料与方法
1.1 材料与试剂
细胞培养类试剂与JC-1试剂(T3168)、DAPI染色液(1217226)购于赛默飞世尔科技(中国)有限公司;DCFH-DA探针(SLBF6547V)购于Sigma-Aldrich公司;IKK(3416)、p-IKK(2697)、NF-κB(8242)、p-NF-κB(3033)购于CST公司;细胞增殖与凋亡检测试剂盒(C1098)购于上海碧云天生物技术有限公司。
1.2 方法
1.2.1 CoCl2诱导N2a细胞化学缺氧模型的建立 参考Gotoh等[4]的方法建立缺氧模型,将细胞分为正常组和CoCl2处理组,正常组用无糖DMEM培养基培养,CoCl2处理组用无糖培养基配制,浓度分别为:10 μmol/L、50 μmol/L、100 μmol/L、300 μmol/L、600 μmol/L、1 200 μmol/L,37 ℃培养24 h。
1.2.2 CCK-8方法检测N2a细胞活性 在96孔板上每孔加入1×105个细胞,按照“1.2.1”建立缺氧模型后检测细胞存活率,细胞存活率=(对照孔吸光度-实验空白孔吸光度)/(对照组吸光度-空白孔吸光度)。
1.2.3 TUNEL法检测体外细胞凋亡 根据试剂盒说明书收集细胞,染色后在荧光显微镜下选取10个视野计算细胞凋亡率,凋亡率=阳性细胞数/总细胞数。
1.2.4 线粒体膜电位的测定 按照“1.2.1”造模后,配制1 μg/mL 的JC-1工作液,37 ℃避光孵育20 min,PBS清洗后,放置于共聚焦显微镜下拍摄,每组选取10个视野,计算红色荧光与绿色荧光比值。
1.2.5 活性氧(ROS)检测 N2a细胞在CoCl2化学诱导缺氧24 h后,加入10 μmol/L的DCFH-DA探针,37 ℃避光染色20 min后置于激光共聚焦显微镜下拍摄,每组选取10个视野计算绿色荧光的含量。
1.2.6 细胞免疫荧光染色实验 在激光共聚焦专用皿上种1×105个细胞,建模后经多聚甲醛固定30 min后用TritonX-100通透,室温下用2%的BSA封闭80 min。在激光共聚焦专用皿中心滴加50 μL NF-κB抗体(1∶50),4 ℃过夜。第2天用PBST清洗后加入荧光二抗,室温下孵育90 min。用DAPI染核后在激光共聚焦显微镜下拍照。
1.2.7 Western blot测定实验 将细胞按照建模方法处理后,提取总蛋白,以β-actin为内参抗体,将各目标条带与内参做均一化处理,对比结果。

2 结果
2.1 不同浓度CoCl2化学诱导缺氧条件下对N2a细胞活性的影响
不同浓度的CoCl2处理N2a细胞24 h后,细胞存活率随着CoCl2浓度的增加而降低,由图1可知,10~100 μmol/L CoCl2损伤细胞相对存活率均大于80%,300 μmol/L的CoCl2处理后细胞活力为56.16%,600 μmol/L CoCl2损伤细胞相对存活率为32.10%,1 200 μmol/L CoCl2处理后,细胞存活率仅为10%左右。

与正常组比较:*P< 0.05,**P<0.01。
图1 不同浓度CoCl2对N2a细胞活性的影响
Figure 1 Effect of different concentrations of CoCl2on the activity of N2a cells
2.2 不同浓度CoCl2化学诱导缺氧条件下对N2a细胞凋亡的影响
不同浓度的CoCl2处理N2a细胞24 h后,细胞凋亡率随着CoCl2浓度的增加而增加,差异有统计学意义(P<0.05),其中,10 μmol/L和50 μmol/L的CoCl2对细胞的凋亡率都小于20%,100 μmol/L的CoCl2对细胞的凋亡率为23%左右,300 μmol/L的CoCl2对细胞的凋亡率为38%,而600 μmol/L的CoCl2对细胞的凋亡率达到67%,1 200 μmol/L的CoCl2对细胞的凋亡率达到88%。

与正常组比较:**P< 0.01。
图2 不同浓度CoCl2对N2a细胞凋亡的影响
Figure 2 Effect of different concentrations of CoCl2on apoptosis of N2a cells
2.3 CoCl2化学诱导缺氧条件下N2a细胞线粒体膜电位的影响
如图3所示,A图为模型建立后,经过1 μg/μL的JC-1处理后,confocal拍摄的N2a细胞线粒体膜电位图,其中红色的荧光是JC-1多聚体,绿色荧光为JC-1单聚体。由图3A中可以看出,正常组细胞多表达为JC-1多聚体,线粒体形态清晰,均匀分布在细胞核四周,300 μmol/L CoCl2处理后绿色荧光增强。B图为线粒体膜电位的统计图,从图中可以看出,经CoCl2处理后,红色荧光与绿色荧光比值降低,线粒体膜电位降低(P<0.05)。

A.激光共聚焦扫描显微镜拍摄的JC-1染色后的N2a细胞,红色为JC-1多聚体,绿色为JC-1单聚体; B.线粒体膜电位即A图中红色荧光与绿色荧光比值的统计结果图。与正常组比较:*P<0.05。
图3 300 μmol/L CoCl2化学诱导缺氧条件下N2a细胞线粒体膜电位的影响
Figure 3 Effect of 300 μmol/L CoCl2-induced hypoxia on MMP of N2a cells
2.4 CoCl2化学诱导缺氧条件下N2a细胞胞内ROS水平的影响
如图4所示,A图为10 μmol/L的DCFH-DA探针染色后用confocal拍摄的细胞内ROS的荧光图,其中ROS表达绿色荧光。B图为其对应的统计图。细胞缺氧损伤会诱导ROS的产生,过量的ROS会氧化损伤细胞多种DNA、蛋白和脂质,最后导致细胞的凋亡,对细胞造成不可逆损伤。绿色荧光的强弱代表细胞内ROS含量的多少,由图4可以看出,经过CoCl2刺激后,细胞中绿色荧光明显增多,与正常组比较,CoCl2组ROS含量为正常组的4倍左右,且差异有统计学意义(P<0.01)。

A.细胞拍摄的confocal图片,绿色荧光为细胞内ROS的含量; B.ROS含量的统计图。与正常组比较:**P< 0.01。
图4 300 μmol/L CoCl2化学诱导缺氧条件下N2a细胞内ROS水平
Figure 4 ROS level in N2a cells under hypoxia induced by 300 μmol/L CoCl2
2.5 CoCl2化学诱导缺氧条件下N2a细胞NF-κB表达的影响
由图5可以看出,正常培养的细胞,经过免疫荧光染色后可发现NF-κB蛋白(绿色荧光)集中在胞质中,胞核(蓝色荧光)清晰,Merge图可以明显看到NF-κB蛋白集中表达在细胞质中;而经过CoCl2缺氧培养24 h后,能明显看到绿色荧光均匀分布在整个细胞中,与正常组相比,细胞核中绿色荧光明显增多,说明CoCl2诱导促进了NF-κB的入核,而NF-κB信号通路的作用主要是基于NF-κB进入细胞核促进相应的促炎促凋亡基因的转录来达到相应的病理进程,进一步确定了CoCl2对细胞的损伤。
2.6 Western blot检测NF-κB信号通路的表达
由图6可以看出,正常组细胞IKK、p-IKK、NF-κB、p-NF-κB这两组蛋白条带不明显,蛋白含量较低,而经过CoCl2诱导刺激后各蛋白条带明显增宽(图6A),由统计图(图6B)可以看出,经过CoCl2诱导刺激后IKK、p-IKK、NF-κB、p-NF-κB蛋白含量均增加(P<0.01),说明CoCl2诱导激活了IKK信号通路,使p-IKK的磷酸化水平增加,同时被激活的还有NF-κB与p-NF-κB,NF-κB进入细胞核,从而诱导一系列反应。
2.7 CoCl2化学诱导缺氧条件下N2a细胞表达NF-κB信号通路激活后对下游凋亡因子表达的影响
由图7中可以看出,经过CoCl2处理后,Bcl-2蛋白表达降低,而Bax和 Cleaved caspase-3条带增宽,含量明显增加,且通过右图可以看出,各蛋白表达差别均有统计学意义(P<0.05或P<0.01),具体表现为细胞凋亡加剧,促凋亡因子显著增加,抗凋亡因子显著降低。
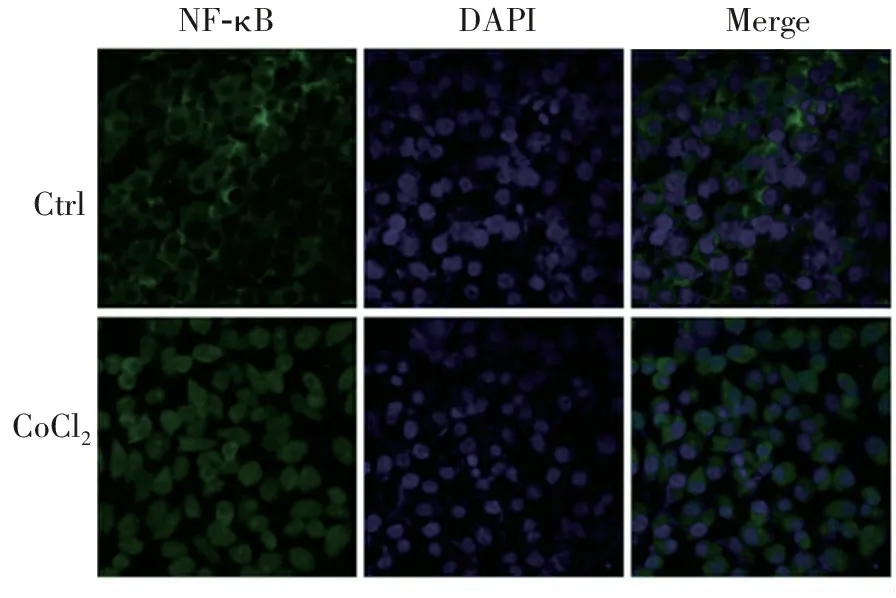
图5 免疫荧光法测CoCl2化学诱导缺氧条件下N2a细胞NF-κB蛋白的表达( 100×)
Figure 5 Expression of NF-κB in N2a cells under hypoxia induced by CoCl2(100×)

A.不同蛋白的蛋白印记图; B.对应的统计图。与正常组比较:**P<0.01。
图6 CoCl2化学诱导缺氧条件下N2a细胞NF-κB及其相关蛋白的表达
Figure 6 Expression of NF-κB and its related proteins in N2a cells under CoCl2-induced hypoxia

A.不同蛋白的蛋白印记图; B.对应的统计图。与正常组比较:*P<0.05,**P<0.01。
图7 CoCl2化学诱导缺氧条件下N2a细胞NF-κB下游凋亡因子的表达
Figure 7 Expression of NF-κB downstream apoptosis factors in N2a cells under CoCl2-induced hypoxia
3 讨论
目前体外模拟脑卒中的方式有2种,一种为低压氧舱培养法[5],通过建立氧糖剥夺模型来模拟缺氧缺糖的环境,另一种是化学诱导法[6],在细胞或者组织培养液中添加铁的螯合剂,阻断氧信号的转导。本实验的目的是评估永久性缺血造成的脑卒中,用氧糖剥夺模型需要特殊的缺氧培养设备来精确控制氧气浓度,且造模后由于环境因素容易造成复灌,实验的稳定性不好,限制了其在实验中的广泛使用。故用化学诱导法去模拟永久性缺血更适宜。虽然已经有研究应用CoCl2来诱导大鼠脑微血管内皮细胞(BMECs)、PC12细胞、 SH-SY5Y细胞等来评价缺血,但不同的研究中,CoCl2建模的量效关系是不同的,不同细胞的最适宜浓度分布在200~1 000 μmol/L之间[6-9],且N2a细胞是目前研究神经系统疾病的主要模式细胞,具有类似神经元形态和功能的特性,能够很好地反映脑卒中发生过程中神经细胞的变化。用CoCl2诱导N2a细胞来建立模型,模拟的是永久性缺血造成的脑卒中的病理生理变化,通过对该模型的具体机制研究,可以有针对地研发药物来解决永久性缺血所造成的脑损伤。本实验参照Gotoh等[4]设计永久性缺氧实验的方式选择化学诱导法建立模型并进行优化,摸索了最适宜的CoCl2诱导N2a细胞缺氧缺糖模型的最适宜条件,通过CCK-8法检测细胞活力和Tunnel测细胞凋亡2个实验,同时参考Miglio等[10]选择缺氧条件的标准,确定300 μmol/L CoCl2诱导缺氧符合构建永久性缺血稳定模型的要求。
线粒体膜电位是线粒体形态和功能完整性的重要指标,测量线粒体膜电位是探究缺氧模型机制的必要条件[11]。实验采用JC-1进行线粒体染色,正常组线粒体完整、膜电位较高;300 μmol/L CoCl2处理24 h后,线粒体膜电位降低到正常组的60%左右,线粒体膜电位降低,进而发生一系列级联反应,产生大量的ROS。同时,过量的ROS又可以造成线粒体损伤,ROS与线粒体损伤之间产生恶性循环,进而造成更严重的细胞损伤。同时过量ROS又能够激活下游的MAPK家族及caspase级联反应[12],最终导致细胞凋亡。因此,抑制细胞中过量的ROS、保护线粒体的形态和功能是开发治疗脑卒中药物考虑的重要方面。
NF-κB是由5个亚单位构成的同源或异源二聚体。在正常状态下与IκB结合以无活性的状态留于细胞浆[13]。当细胞受到刺激时,IKKs复合体磷酸化,使IκB发生构象改变而与NF-κB解离,NF-κB进入细胞核,细胞凋亡相关基因表达增高[14]。此外,有研究指出Bcl-2是通过抑制细胞膜中脂质过氧化反应、抑制活性氧的蓄积发挥作用的[15-16],也能够干扰NF-κB入核的迁移[17]。在本实验中,细胞经过CoCl2处理后,胞核内的NF-κB含量增加,NF-κB入核明显,同时下游的凋亡因子蛋白含量增多,抗凋亡因子Bcl-2含量降低。
综上所述,300 μmol/L CoCl2可以稳定诱导N2a细胞缺氧模型,可以显著抑制细胞活性、诱导细胞凋亡;其主要缺氧损伤机制是通过促凋亡作用产生,而胞内线粒体膜电位的下调、 ROS的含量的增加、NF-κB的入核和促凋亡蛋白含量的增加共同作用诱导了CoCl2对N2a细胞的损伤。
