茶籽皂苷调节高脂血症大鼠血脂的功效研究
2020-05-05刘芷君曾文治雷郑延林全女程福建杨江帆
林 玲,刘芷君,曾文治,雷郑延,林全女,程福建,杨江帆,*
(1.福建农林大学园艺学院,福建福州 350002;2.茶学福建省高校重点实验室,福建福州 350002)
高脂血症通常指血清中TC和(或)TG水平升高[1],是“三高”之一,时刻威胁着人类的生命和财产安全,我国血脂异常人数高达18.6%[2]。高脂血症使不利于机体健康的相关物质大量积累,导致肝脏负担过重、血管血栓沉淀等[3],同时,高脂血症还会引发动脉粥样硬化、糖尿病等多种并发症[2,4-5]。2010~2030年,我国心血管患者人数将因血清胆固醇水平的升高约增加920万[6]。高胆固醇血症患者也日趋低龄化[7]。目前市场上治疗高脂血症的药物繁多,如西药中的贝特类、烟酸类及他汀类的药物,但长期使用将产生副作用、耐药性及依赖性等反应[1]。因此研究与开发副作用低的保健产品势在必行。
20世纪60年代,茶叶的保健功效逐渐引起人们的关注,人们对茶叶中的生物活性成分进行了深入研究,主要包括茶多酚、黄酮类及茶氨酸等物质,但茶皂苷仍未引起关注。直到2005年,Yoshikawa等[8]发现茶花皂苷Floratheasaponin A-C有较好的抑制TG的作用。随后几年,国内外学者陆续开展对茶皂苷降血脂功效的研究。Ye等[9]用油茶皂苷及其水解产物喂食高脂血症小鼠,发现可降低TC、TG和低密度脂蛋白(low density lipoproteins,LDL),并增加高密度脂蛋白(high density lipoproteins,HDL)的含量。王延芳[10]的研究也验证了这一结论。吴文鹤等[11]发现茶树根皂苷可调控血脂水平。Afrose等[12]发现茶树根皂苷能显著降低血清中LDL、TG和TC的含量。目前,针对茶皂苷调节血脂的研究多选用油茶籽、茶树花、茶树根等部位的皂苷,尚未发现以茶籽皂苷为对象的研究,同时对肝脂肪变性、肝功能、抗氧化水平影响以及调节血脂机制的研究匮乏。
茶皂苷是一类齐墩果烷型五环三萜类皂苷的混合物,由皂苷元、糖体、有机酸三部分组成。科研工作者从同一物种中分离出不同的皂苷,到目前已从山茶属植物的根、茎、叶、花和种子中分离和鉴定了188种皂苷单体,其中,87种来自茶(CamelliasinensisL.),33种来自日本山茶(CamelliajaponicaL.),24种来自阿萨姆茶(CamelliasinensisL. var.assamicaPierre),37种来自油茶(CamelliaoleiferAbel.),7种来自茶梅(CamelliasasanquaThunb.);大部分皂苷(72种)分离于山茶属植物的种子,其中在茶籽中发现39种;在茶树花中发现16种、根茎中10种、茶叶中9种,其他13种。它们结构相似又有所不同,比如茶籽皂苷和茶叶皂苷:皂苷元结构众多,其中R1-黄槿精醇和A1-黄槿精醇是茶叶皂苷具备而茶籽皂苷不具备的;关于有机酸,茶叶皂苷为当归酸、惕各酸和肉桂酸,而茶籽皂苷中不具有肉桂酸;二者糖体相同[13-14]。对茶树的利用多集中在其叶片上,除了一小部分茶籽用于育种外,其余多被废弃。据农业部种植业管理司统计,2016年全国茶园面积2902100 hm2,按每亩茶园产茶籽50 kg,我国每年潜在茶籽资源约217. 7万t,茶皂苷作为茶籽主要有效成分,具有重大开发潜力。
因此本文选用茶籽皂苷进行动物实验,通过病理切片以及对大鼠血脂和抗氧化指标的检测研究其调节血脂的功效,为茶皂苷降血脂产品的开发提供理论支持,以期为茶深加工产业的发展提供支持。
1 材料与方法
1.1 材料与仪器
茶籽皂苷 湖南汉清生物技术有限公司;羧甲基纤维素钠(CMC) 上海源叶生物科技有限公司;辛伐他汀片 湖北广济药业股份有限公司;SPF级雄性Wistar大鼠60只,体重(200±20) g 上海斯莱克实验动物有限责任公司提供,生产许可证号:SCXK(沪)2012-0002;对硝基苯酚、水合氯醛(分析纯) 阿拉丁试剂(上海)有限公司;SOD、MDA试剂盒 南京建成生物工程研究所;高脂饲料(辐照) 北京博爱科贸有限公司(配方:蛋黄粉10%、猪油5%、胆固醇5%、胆盐0.5%、丙硫氧嘧啶0.2%、基础饲料79.3%);普通饲料 福建中医药大学实验动物中心。
KDC-2046低速冷冻离心机 安徽中科中佳科学仪器有限公司;日立7180全自动生化分析仪 株式会社日立制作所;TE601-L电子天平 德国赛多利斯公司;UV-2700紫外可见分光光度计 SHIMADZU Corporation。
1.2 实验方法
1.2.1 动物模型的建立与分组 本实验在福建中医药大学实验动物中心SPF级屏障动物实验室进行。大鼠饲养环境:室温22~26 ℃,相对湿度40%~70%,明暗交替条件为12 h/12 h。大鼠均在同一环境下随机分笼饲养,每笼5只,自由饮水摄食。
60只雄性Wistar 大鼠适应性喂养1周后随机分为10只正常组和50只造模组。正常组饲喂基础饲料,造模组饲喂高脂饲料。4周后禁食12 h断尾取血,检测TC 与正常组有显著差异(P<0.05),则造模成功,将造模组按体重随机分为模型对照组、阳性对照组和茶籽皂苷低、中、高剂量组。各组按照表1给药方式每日上午定时连续给药四周,末次给药后24 h(禁食不禁水12 h),10%水合氯醛麻醉(2 mL/kg,腹腔注射)大鼠取样保存待测。所用灌胃药物均使用0.5%羧甲基纤维素钠作为溶剂进行配制。

表1 动物分组与给药方法Table 1 Animal grouping and administration method
1.2.2 大鼠基础指标测定 实验开始的第一天、最后一天所有大鼠称重,期间每周定时称量大鼠体重,每日记录和观察大鼠精神状态、饮水、饮食量等情况。大鼠取样后计算大鼠肝脏指数,肝脏指数(%)=肝脏湿重(g)/体重(g)×100。
1.2.3 大鼠血清生化指标检测
1.2.3.1 常规生化指标测定 自大鼠腹主动脉取血,于3 000 r/min离心10 min后取血清,采用全自动生化分析仪测定血清中TC、TG、LDL-C、HDL-C、AST、ALT含量,计算AI指数:AI=([TC]-[HDC-C])/[HDL-C]。
1.2.3.2 MDA、SOD含量测定 分别采用硫代巴比妥酸(thiobarbituric acid,TBA)法和羟胺法,按各试剂盒说明测定MDA和SOD含量。
1.2.4 组织形态学观察 取各组大鼠部分肝脏用0. 9%氯化钠溶液冲洗,浸泡于通用型组织固定液过夜,经石蜡包埋及切片后得到约4 μm 的切片,用HE染色后至光镜观察细胞形态[15]。
1.3 数据处理
数据以均数±标准差(x±s)的形式表示。使用SPSS 17.0软件对数据进行统计分析,差异显著性用P<0.05(显著)或P<0.01(极显著)表示。
2 结果与分析
2.1 模型建立
造模4周后,造模组血清TC(2.10±0.09 mmol/L)明显高于正常组(1.36±0.03 mmol/L),有统计学意义(P<0.01),说明高脂血症模型已成功建立[1,16-18]。
2.2 大鼠状态行为分析
药物干预过程中,C组大鼠精神状态好,活泼好动且反应敏捷,H组大鼠体态变大,精神相对萎靡,活动量少。而摄入茶皂苷和辛伐他汀的TSL组、TSM 组、TSH组以及P组大鼠体态较H组小,精神状态较好,活动有所增多。如表2所示,各组大鼠每周平均每天饮水量和饮食量不存在显著差异(P>0.05),说明茶籽皂苷抑制大鼠体重增长并非通过减少其食物摄入实现的。

表2 各组大鼠饮水量和饮食量Table 2 Water consumption and diet of rats in each group
2.3 茶籽皂苷对高脂血症大鼠体重、肝脏指数的影响
肥胖与高脂血症及动脉粥样硬化关系密切,而体重是大鼠肥胖程度最直观的显示指标之一[19-20]。如图1所示,干预前,造模组各组大鼠的体重并无显著差异(P>0.05)。干预4周后,H组大鼠体重相比C组极显著提升(P<0.01);而P组、TSL组、TSM组、TSH组大鼠体重虽高于C组,但较H组都有所下降,其中P组、TSH组极显著降低(P<0.01),TSM组显著降低(P<0.05),TSL组也有所降低,但无统计学意义,说明茶籽皂苷能控制高脂血症大鼠的体重,与P组相一致,且呈量效关系。
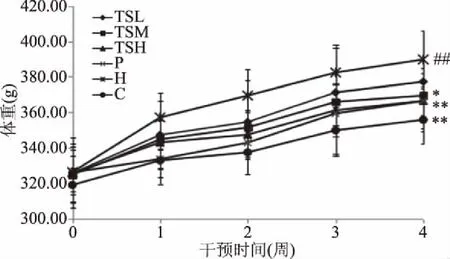
图1 大鼠体重变化趋势Fig.1 Variation of body weight of rats注:与C组比较,##表示极显著(P<0.01),#表示显著(P<0.05);与H组比较,**表示极显著(P<0.01),*表示极显著(P<0.05),图2、图4、表3、表4同。
肝脏指数变化可以较好地判断肝脏的损伤情况,增加表示肝脏有充血、水肿、增生及肥大等变化,下降则表示脏器萎缩、生长受阻或退行性变[21]。如图2所示,H组大鼠的肝脏指数比C组极显著提高(P<0.01),与H 组相比,P组、TSM 组、TSH组的肝脏指数极显著下降(P<0.01),TSL组没有显著性差异。H 组大鼠肝脏指数极显著地升高可能与一系列的病理变化有关,经过茶籽皂苷和辛伐他汀的干预可能对肝脏的病理性变化有所改善。

图2 茶籽皂苷对高脂血症大鼠肝脏指数的影响Fig.2 Effect of tea seed saponin on liver index in rats with hyperlipemia
2.4 茶籽皂苷对高脂血症大鼠血脂水平的影响
临床上血脂检测的基本项目为TC、TG、LDL-C和HDL-C。AI为医学中用以观察动脉硬化程度的指标,AI值的升高,能促进HDL-C将血液中的胆固醇运到肝脏进行转化和排泄,以降低血液中胆固醇浓度,促进大鼠外周组织细胞中的胆固醇向肝脏转运,从而减少其在外周组织中的聚集和对血管内皮细胞的广泛性损害[1,22]。由表3可知,给药4周后,与C组相比,H组大鼠血清中TC含量和AI指数极显著升高(P<0.01),HDL-C 含量极显著降低(P<0.01),TG、LDL-C含量显著升高(P<0.05);与H 组相比,TC含量P组、TSL组、TSM组、TSH 组均极显著降低(P<0.01);TG含量P组、TSH组极显著降低(P<0.01),TSL组、TSM组显著降低(P<0.05),以TSH 组效果最佳,甚至优于P组;HDL-C 含量P组、TSH组极显著升高(P<0.01),TSL组、TSM组显著升高(P<0.05);LDL-C含量P组极显著降低(P<0.01),茶籽皂苷各组有所降低,但无显著性差异;AI指数P组、TSM组、TSH 组极显著降低(P<0.01),TSL组显著降低(P<0.05)。研究结果表明,茶籽皂苷对由高脂饲料诱发的高脂血症大鼠的血脂水平具有较好的调节作用,对动脉硬化也有一定的改善作用,且呈量效关系,茶籽茶皂苷高剂量组对大鼠血脂的调节效果最佳。
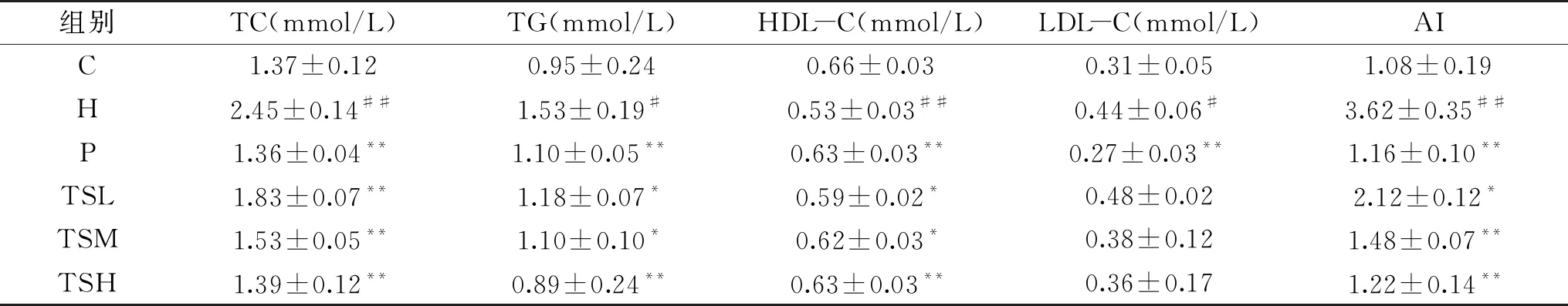
表3 茶籽皂苷对高脂血症大鼠血脂含量的影响Table 3 Effect of tea seed saponin on blood lipids in rats with hyperlipemia
2.5 茶籽皂苷对高脂血症大鼠肝功能的影响
肝为脂类、糖类以及蛋白质代谢的主要器官。ALT和AST是肝功能的代表性指标,其数值的高低直接地体现肝细胞的损伤程度,越高表明肝脏受损程度越大[23]。如表4所示,H组的ALT与AST含量比C组极显著提高(P<0.01);与H 组相比,P组、TSH组的ALT与AST含量显著下降(P<0.05),TSL组、TSM组无显著性差异,说明高脂血症会使大鼠肝功受损,而茶籽皂苷和辛伐他汀拥有一定的保肝功效,且茶籽皂苷以高剂量的效果最佳。
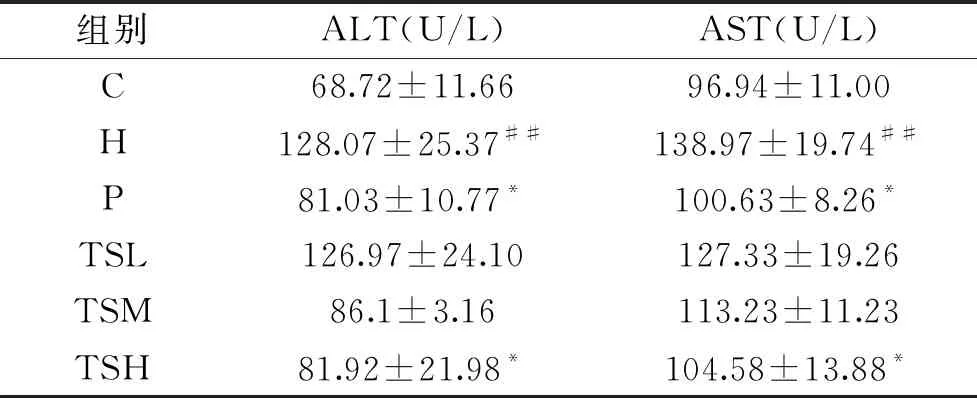
表4 茶籽皂苷对高脂血症大鼠ALT、AST含量的影响Table 4 Effect of tea seed saponin on ALT and AST content in rats with hyperlipemia
2.6 茶籽皂苷对高脂血症大鼠肝脏脂肪变性的影响
不同处理大鼠的肝组织HE染色切片如图3所示。C组大鼠肝脏细胞结构规则整齐,肝窦清晰可见,未出现肝细胞脂肪变性。H组大鼠肝脏细胞肿胀、体积增大,众多大小不一的脂滴出现在胞浆内,细胞间隙增大,完整性较差,结构轮廓模糊,部分细胞甚至解体,说明高脂血症可引起肝脏的病理性变化。与H组比,P组、TSL组、TSM组、TSH 组均可不同程度改善大鼠肝脏细胞脂肪变性,缩小胞浆内脂滴体积,减少其数量,肝窦更为清晰,且呈量效关系,以TSH组效果最佳,甚至优于P组。脂肪肝发生率随着TG浓度的增高而升高[24],肝脏切片的结果正好与血清TG的结果相呼应,因此推测是因茶籽皂苷能有效降低血清TG含量,致使其改善肝脏脂肪变性效果佳。
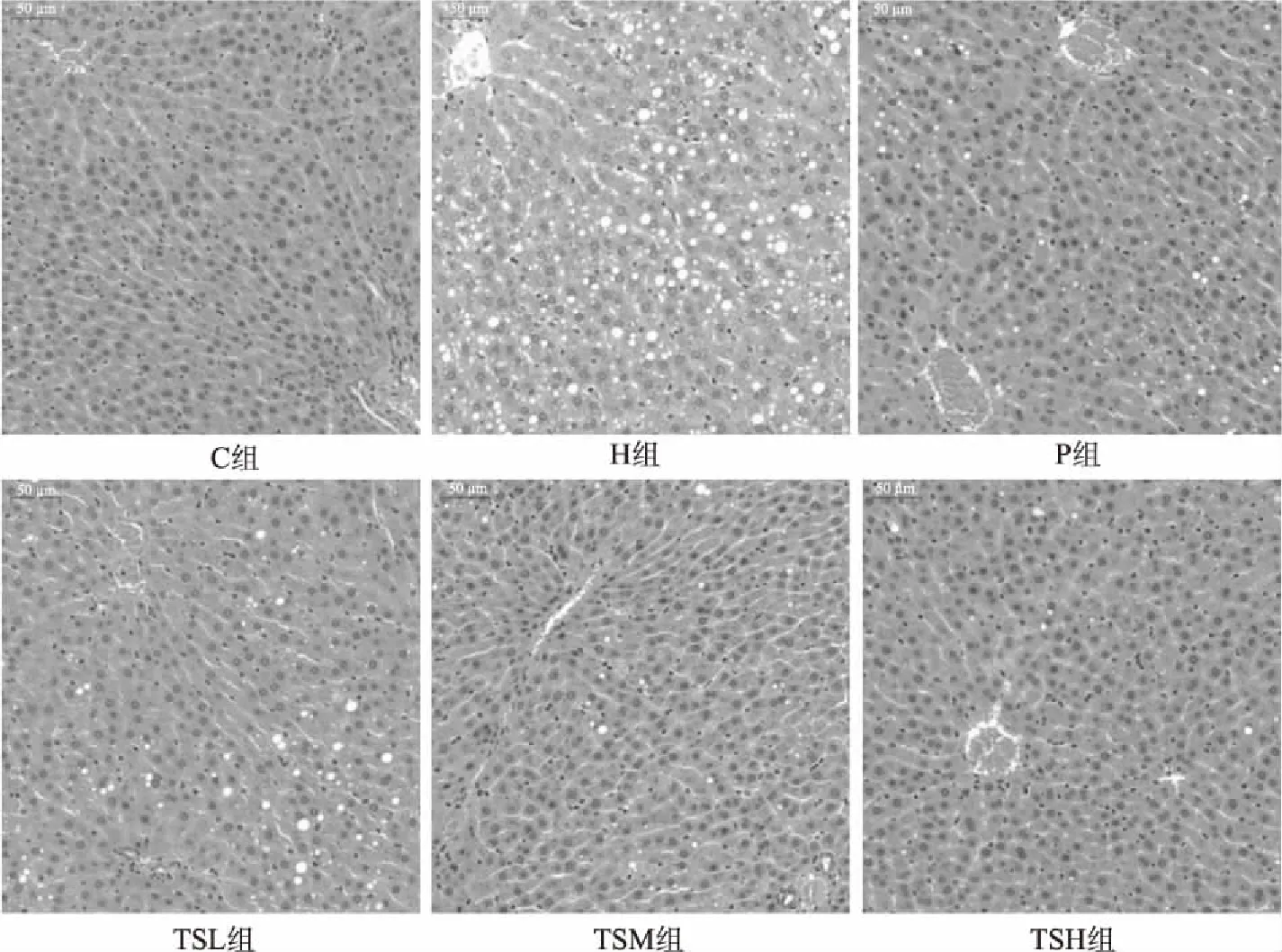
图3 茶籽皂苷对高脂血症大鼠肝脏脂肪变性的影响(200×)Fig.3 Effect of tea seed saponin on fatty degeneration of liver in rats with hyperlipemia(200×)
2.7 茶籽皂苷对高脂血症大鼠抗氧化水平的影响
MDA是脂质过氧化终产物之一,可间接反映过氧化损伤程度。SOD可清除超氧阴离子自由基,反映机体的抗氧化能力[25-26]。如图4所示,相比C 组,H组大鼠血清中SOD含量极显著降低(P<0.01)、MDA含量极显著升高(P<0.01);与H 组相比,P组血清SOD含量极显著升高(P<0.01),TSL组、TSM组、TSH组显著提高(P<0.05);P组、TSM 组、TSH 组的血清MDA含量极显著下降(P<0.01),TSL组无显著性差异。结果表明茶籽皂苷和辛伐他汀能提高高脂血症大鼠血清SOD活性,降低MDA活性,能提高抗氧化水平,改善高脂血症带来的氧化损伤,从而改善大鼠血脂水平。
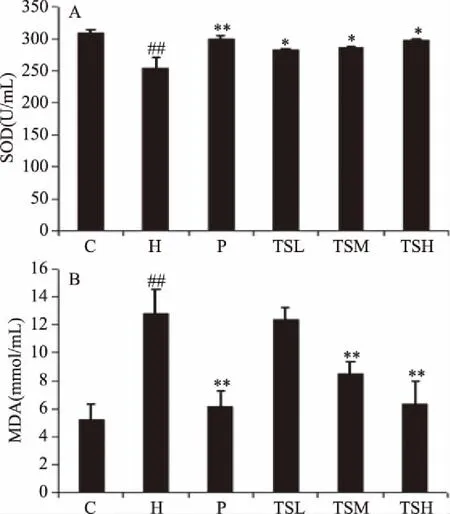
图4 茶籽皂苷对高血脂症大鼠抗氧化水平的影响Fig.4 Effect of tea seed saponins on antioxidant level in rats with hyperlipidemia
3 结论
本研究结果表明,适当剂量的茶籽皂苷(50~150 mg/kg)能有效调节高脂饲料诱导的高脂血症大鼠的血脂水平,且其效果与剂量浓度成正比。TSH组的体重、肝脏指数、血清TC、TG、AI指数极显著降低(P<0.01),HDL-C极显著升高(P<0.01),ALT与AST显著下降(P<0.05),肝脏脂肪变性的程度明显改善,SOD显著提高(P<0.05),MDA极显著下降(P<0.01);TSM组的体重、血清TG显著降低(P<0.05),肝脏指数、血清TC、AI指数、MDA极显著下降(P<0.01),HDL-C、SOD显著升高(P<0.05),肝脏脂肪变性的程度改善;TSL组的体重、肝脏指数、MDA没有显著性差异,血清TC极显著降低(P<0.01),TG、AI指数显著降低(P<0.05),HDL-C、SOD显著升高(P<0.05),肝脏脂肪变性的程度改善。综上所述,茶籽皂苷能调节喂食高脂饲料致大鼠高脂血症模型的血脂水平,减轻肝脏脂肪变性程度,同时还能改善高脂血症带来的氧化损伤和肝脏损伤,提高机体的抗氧化能力,有望成为安全有效的抗高脂血症候选药,但其机制有待进一步完善检验。
