发酵法提取青稞麸皮中β葡聚糖的工艺优化及其理化性质研究
2020-05-05刘新琦何先喆刘洁纯唐庆九顾飞燕
刘新琦,何先喆,刘洁纯,唐庆九,顾飞燕,俞 苓,*
(1.上海应用技术大学香料香精技术与工程学院,上海 201418;2.上海市农业科学院食用菌研究所,上海 201403;3.上海宏度精细化工有限公司,上海 201108)
青稞(Hordeumvulgare)为禾本科植物,大麦属[1],具有高蛋白质、高膳食纤维、低脂、低糖等特点[2]。青稞由于富含丰富的β-葡聚糖而备受国内外学者的关注[3]。有研究表明β-葡聚糖具有调节血糖[4]、提高免疫力[5-6]、抗肿瘤、抗病毒[7]等功效,除此之外其还具有良好的保湿性[8],可用作保湿化妆品添加剂[9]。
β-葡聚糖常用的提取工艺主要分为三类,分别为水提法[10]、碱提法[11]和酸提法[12]。水提法易操作且提取条件温和,但β-葡聚糖得率低[13];酸提和碱提法虽使得率有所提高,但要严格控制实验pH,而且实验过程中产生大量热量使实验难度增加[14]。有报道在传统水提工艺的基础上利用超声-微波协同[15]、超高压[16]等对提取工艺进行优化,可以进一步提高得率,但这些提取方法获得的β-葡聚糖需要进一步纯化[17],实验步骤较长。发酵法提取青稞麸皮β-葡聚糖,利用酵母菌丰富的酶系统,消耗青稞麸皮中的淀粉和蛋白质,有效释放青稞麸皮中β-葡聚糖。另外,由于酵母生长过程中不消耗发酵液中的β-葡聚糖,同时还能利用还原糖、蛋白质等其他物质作为营养物进行生长,从而达到对β-葡聚糖去杂纯化的效果[18],且提高β-葡聚糖得率。目前发酵法提取β-葡聚糖的报道只见于燕麦[19],尚未见发酵法提取青稞β-葡聚糖。因此本文研究了发酵法提取青稞β-葡聚糖,并通过单因素和正交试验对其工艺条件进行优化,并对得到的青稞β-葡聚糖进行分离、纯化以及理化性质分析,为青稞β-葡聚糖的开发利用提供科学基础。
1 材料与方法
1.1 材料与仪器
青稞麸皮 市售;高活性干酵母、酿酒干酵母、啤酒干酵母、葡萄酒干酵母 均为安琪酵母有限公司,属酿酒酵母(Saccharomycescerevisiae)类的不同类产品;β-葡聚糖标准品、无水葡萄糖、牛血清蛋白、酪蛋白、刚果红、无水乙醇、考马斯亮蓝G250、三氯乙酸、活性炭、硅藻土、碘试液 均为国产分析纯,国药(上海)化学试剂有限公司;标准单糖:D-半乳糖、D-葡萄糖、D-阿拉伯糖、L-岩藻糖、L-鼠李糖、D-甘露糖、D-木糖、三氟乙酸 美国Sigma公司。
L530型离心机、FD50冷冻真空干燥机、旋转蒸发仪 湘仪仪器公司;UV210紫外分光光度计 棱光技术公司;HPLC MALLS索映仪器设备公司;Waters 2695型高效液相色谱仪、VETEX 70红外光谱 美国Waters;DMAX-20射线衍射仪 美国TA;ICS2500离子色谱仪 Dionex公司;SK-GEL系列凝胶色谱柱G6000PWXL、G4000PWXL(7.8 mm×300 mm) TOSOH。
1.2 实验方法
1.2.1 发酵法提取青稞麸皮β-葡聚糖 青稞麸皮糊化液的制备:青稞麸皮经干燥、粉碎后过100目筛,将粉碎后的青稞麸皮粉末以一定的料液比加入一定量的水,58 ℃糊化20 min制成青稞糊化液。市售干酵母活化:将市售干酵母加入2%葡萄糖溶液,32 ℃,水浴20 min进行活化。在接菌发酵之前对青稞糊化液进行高温灭菌121 ℃,20 min[20]。
将青稞糊化液与活化过的活性干酵母混合搅匀,放入摇床,设置摇床转速110 r/min进行振荡发酵。经发酵后将发酵液放入离心机,设置转速4000 r/min离心10 min,收集上清液,缓慢加入3.5倍体积分数为85%的乙醇,并于4 ℃冰箱里醇沉多糖4 h,收集沉淀进行真空冷冻干燥,得到青稞β-葡聚糖粗品。将青稞β-葡聚糖粗品配制成10 mg/mL的溶液,加入5%活性炭,于45 ℃水浴下20 min,再将硅藻土均匀铺在滤纸上,抽滤除去溶液中的活性炭,收集滤液。将滤液旋转蒸发浓缩至原体积的1/3,通过真空冷冻干燥得到青稞β-葡聚糖粉末。真空冷冻干燥条件:冷冻温度为-85 ℃,真空度为0.95 Pa。
1.2.2 水提法提取青稞麸皮β-葡聚糖 参考董磊[21]关于水提青稞β-葡聚糖条件的优化方法并加以改进。工艺流程如下:料液比1∶22在52 ℃下提取3 h;4000 r/min离心10 min后取上清液后同1.2.1中实验方法,得到水提β-葡聚糖产品。
1.2.3β-葡聚糖含量测定及得率计算 根据刚果红法[22]测定β-葡聚糖含量,配制1 mg/mL的β-葡聚糖标准品溶液冷藏待用,将刚果红溶解于pH8.0的磷酸缓冲液中,配制0.1 mol/L的刚果红溶液。将β-葡聚糖标准品溶液稀释为20、40、60、80、100μg/mL,分别取2 mL不同浓度β-葡聚糖标准品溶液加4 mL刚果红溶液,25 ℃水浴30 min,以2 mL蒸馏水加4 mL刚果红溶液为空白对照,于545 nm处测定吸光值。吸光值与β-葡聚糖标品含量的线性方程为y=2.83x-0.002(R2=0.9966)。 式中纵坐标y代表吸光度值,横坐标x代表β-葡聚糖含量(μg/mL)。将冷冻干燥后的β-葡聚糖粉末溶于蒸馏水中,配成1 mg/mL的β-葡聚糖溶液,测定吸光值,计算β-葡聚糖含量,再按以下公式计算β-葡聚糖得率和纯度。
青稞β-葡聚糖得率(%)=β-葡聚糖粉末的质量/青稞麸皮粉的质量×100
式(1)
青稞β-葡聚糖纯度(%)=β-葡聚糖粉末中β-葡聚糖的质量/β-葡聚糖粉末质量×100
式(2)
1.2.4 蛋白质含量的测定 以牛血清蛋白为标准样,用考马斯亮蓝法[23]绘制蛋白质标准曲线。配制0.1 mg/mL的蛋白质标准溶液冷藏待用;称取10 mg考马斯亮蓝G250,加5 mL95%乙醇溶解,再加入10 mL 85%磷酸溶液,最后用蒸馏水定容至100 mL,置于棕色瓶中备用。将蛋白质标准溶液稀释为20、40、60、80、100 μg/mL,分别取1 mL不同浓度蛋白质标准溶液加5 mL考马斯亮蓝G250溶液混匀,常温静置10 min,以1 mL蒸馏水加5 mL考马斯亮蓝G250溶液为空白对照,于595 nm处测定吸光值。吸光值与蛋白质含量的相关性方程为y=8.7171x+0.0225(R2=0.9976),将冷冻干燥后的β-葡聚糖粉末溶于蒸馏水中,配成1 mg/mL的β-葡聚糖溶液,测定吸光值,通过测定样品吸光度值可计算得蛋白质含量。

式(3)
1.2.5 单因素实验 固定基本条件为接种量0.05%(酵母/麸皮,g/g),料液比1∶5,发酵时间36 h,发酵温度32 ℃。研究不同菌种(高活性干酵母、酿酒干酵母、啤酒干酵母、葡萄酒干酵母)、接种量(0.01%、0.03%、0.05%、0.07%、0.09%)、料液比(1∶3、1∶4、1∶5、1∶6、1∶7)、发酵温度(28、30、32、34、36 ℃)、发酵时间(6、12、18、24、36、42、48 h)等因素对青稞麸皮β-葡聚糖得率的影响。
1.2.6 正交优化试验 根据单因素实验结果,选择料液比(A)、接种量(B)、发酵时间(C)进行L9(33)正交试验,优化发酵法提取青稞麸皮β-葡聚糖的工艺,因素水平的选择见表1。

表1 发酵法提取β-葡聚糖正交试验因素水平表Table 1 Factors and levels table of orthogonal test for extracting β-glucan by fermentation method
1.2.7β-葡聚糖分子量的测定 参考文献[24-26]通过HPSEC-MALLS-RI联用分析发酵法优化工艺制备的样品和1.2.2实验所得到的两个样品的分子量分布。分别称取两种样品5 mg于1 mL流动相,过0.22 μL的水相微孔膜,上样分析。实验通过Waters2695型高效液相色谱仪连接MALLS、RI System。TSK-GEL系列凝胶色谱柱G6000PWXL、G4000PWXL串联使用,柱温30 ℃,进样量100 μL,流动相为0.15 mol/L 的硝酸钠和0.05 mol/L 磷酸二氢钠(pH=7,0.02%叠氮钠),流速0.5 mL/min进行等度洗脱分析。8角度激光光散射仪的光源波长选用623.8 nm,溶液中多糖折光指数增量(dn/dc)为0.146 mL/g进行计算。使用Astra(6.1.1版)进行数据分析软件收集和分析光散射数据,计算分子量。
1.2.8 单糖组成的测定 采用高效阴离子交换色谱分析法对所得的样品进行单糖组成测定[27-29]。称取2 mg样品溶于3 mL浓度为2 mol/L的三氟乙酸,加入反应瓶中。然后放置在110 ℃油浴中水解3 h。冷却至室温,加入3 mL甲醇,用氮气在 40 ℃下吹干,重复4~5次以完全除去三氟乙酸。将反应瓶中的样品用超纯水定容至25 mL待测。标准品:L-海藻糖、L-鼠李糖、D-阿拉伯糖、D-氨基葡萄糖、D-半乳糖、D-葡萄糖、D-木糖、D-甘露糖、D-果糖、D-半乳糖醛酸、D-葡糖醛酸混标。实验采用带脉冲安培检测器的ICS2500 离子色谱仪,连接阴离子交换分析色谱柱Carbo PacTMPA20(3 mm×150 mm),2.5 mmol/L的NaOH溶液和超纯水为流动相,流速为0.45 mL/min,上样量25 μL,柱温为30 ℃,进行等度洗脱分析。
1.3 数据分析
本研究中的试验均重复进行3次,运用Microsoft Excel 2003、Origin 8.0和SPSS 18.0数据处理软件对实验数据进行整理、图表绘制和显著性分析(以P<0.05为差异有统计学意义),实验结果采用平均值±标准差表示。
2 结果与分析
2.1 不同酵母菌发酵对青稞麸皮β-葡聚糖提取效果的影响
运用四种活性干酵母发酵获得的β-葡聚糖得率结果如图1。结果发现,发酵法获得β-葡聚糖的得率均较水提法高,这是由于酵母中含有丰富的酶系统,使青稞麸皮中的β-葡聚糖更好地溶解出来,四种酵母中高活性干酵母发酵得率最高,β-葡聚糖得率为4.78%±0.03%,较水提法高47.53%,因此选取高活性干酵母为发酵菌种。

图1 不同酵母菌对β-葡聚糖得率的影响Fig.1 Effects of different yeasts on extraction yield of β-glucan注:不同大写字母表示差异显著(P<0.05),图2~图5同。
2.2 发酵法提取青稞β-葡聚糖单因素实验
2.2.1 料液比对青稞麸皮β-葡聚糖提取效果的影响 随着料液比的提高,β-葡聚糖的得率先增加后稳定(图2),料液比太小时β-葡聚糖无法充分溶解,料液比增大后得率也随着增大;当料液比为1∶5时,β-葡聚糖得率为4.98%±0.03%,与料液比为1∶6、1∶7结果无显著性差异(P>0.05),但显著高于料液比1∶3、1∶4(P<0.05),根据液固相萃取的基本理论,增大料液比有利于溶质的溶出,但是过大的料液比不仅增加了水的消耗,而且增高了后续的浓缩成本[30],因此选取料液比1∶5。
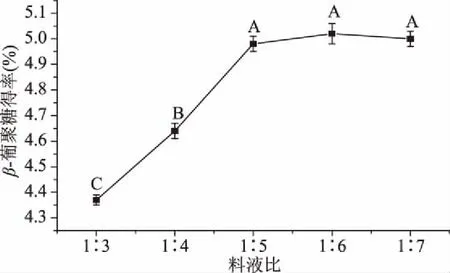
图2 料液比对β-葡聚糖得率的影响Fig.2 Effects of ratio of material to liquid on extraction yield of β-glucan
2.2.2 接种量对青稞麸皮β-葡聚糖提取效果的影响 接种量为0.01%~0.05%时,β-葡聚糖得率快速增加(图3),接种量为0.05%时,β-葡聚糖得率为4.48%±0.04%,与接种量为0.07%、0.09%无显著性差异(P>0.05),但显著高于接种量为0.01%、0.03%(P<0.05),这是由于0.05%接种量已经使发酵液达到饱和,虽然增加接种量β-葡聚糖还在不断析出,但是对实际生产意义不大,因此选择接种量为0.05%。
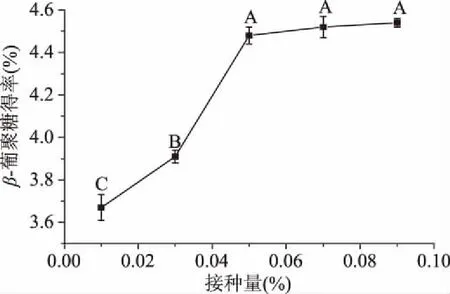
图3 接种量对β-葡聚糖得率的影响Fig.3 Effects of inoculation amount on extraction yield of β-glucan
2.2.3 发酵时间对青稞麸皮β-葡聚糖提取效果的影响 随着发酵时间的延长,β-葡聚糖的得率先增加后趋于平缓(图4),发酵时间为36 h时,β-葡聚糖得率为4.88%±0.03%,与42、48 h试验结果无显著性差异(P>0.05),但显著高于发酵时间为6、12、18、24 h(P<0.05)。这是由于在前18 h内酵母大量繁殖,利用自身酶系统通过发酵分解纤维素,到36 h时反应几乎完全,因此选取36 h为最适发酵时间。并且在36 h时通过淀粉碘试实验[28],发酵液未使得碘液变色,说明淀粉已被消耗完,规避了后续除淀粉的操作步骤。

图4 发酵时间对β-葡聚糖得率的影响Fig.4 Effects of fermentation time on extraction yield of β-glucan
2.2.4 发酵温度对青稞麸皮β-葡聚糖提取效果的影响 随着发酵温度在28~36 ℃升高,β-葡聚糖的得率先升高后略有下降(图5)。在32 ℃条件下获得的β-葡聚糖得率为4.76%±0.04%,与在34和36 ℃之间无显著性差异(P>0.05),但显著高于28、30 ℃(P<0.05),这可能的原因是在32 ℃时酵母内环境较稳定,新陈代谢所需的酶活性达到较高水平[31],因此选取32 ℃为最适发酵温度。
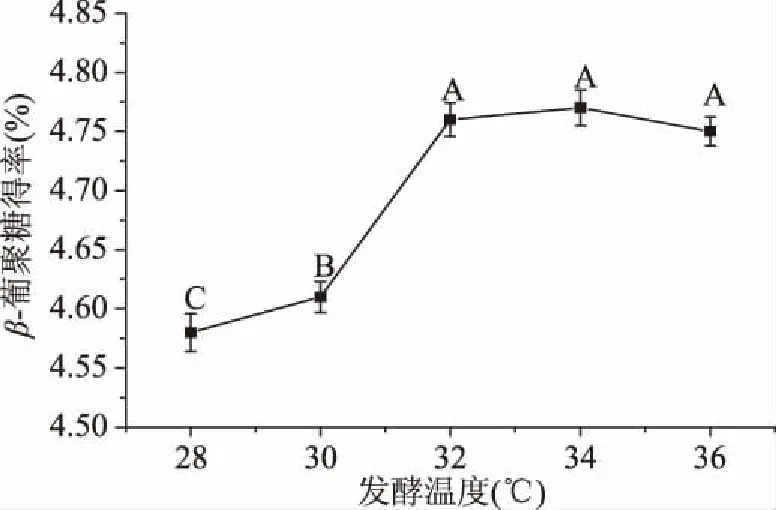
图5 发酵温度对β-葡聚糖得率的影响Fig.5 Effects of fermentation temperature on extraction yield of β-glucan
2.3 正交试验结果分析
基于单因素实验,进一步进行正交试验,结果见表2。由表2极差分析可知,影响因素强弱顺序为发酵时间>料液比>接种量。青稞β-葡聚糖提取的最佳工艺条件是A3B2C1,即提取效果最佳条件为料液比1∶6,接种量0.05%,发酵时间34 h。方差分析结果见表3,由表3也可以看出,影响青稞β-葡聚糖得率的三个因素排序为发酵时间、料液比和接种量,这与表2分析结论是一致的。通过实验验证最佳条件,结果显示发酵法提取的青稞β-葡聚糖的得率平均为5.21%±0.02%,优化条件可行。
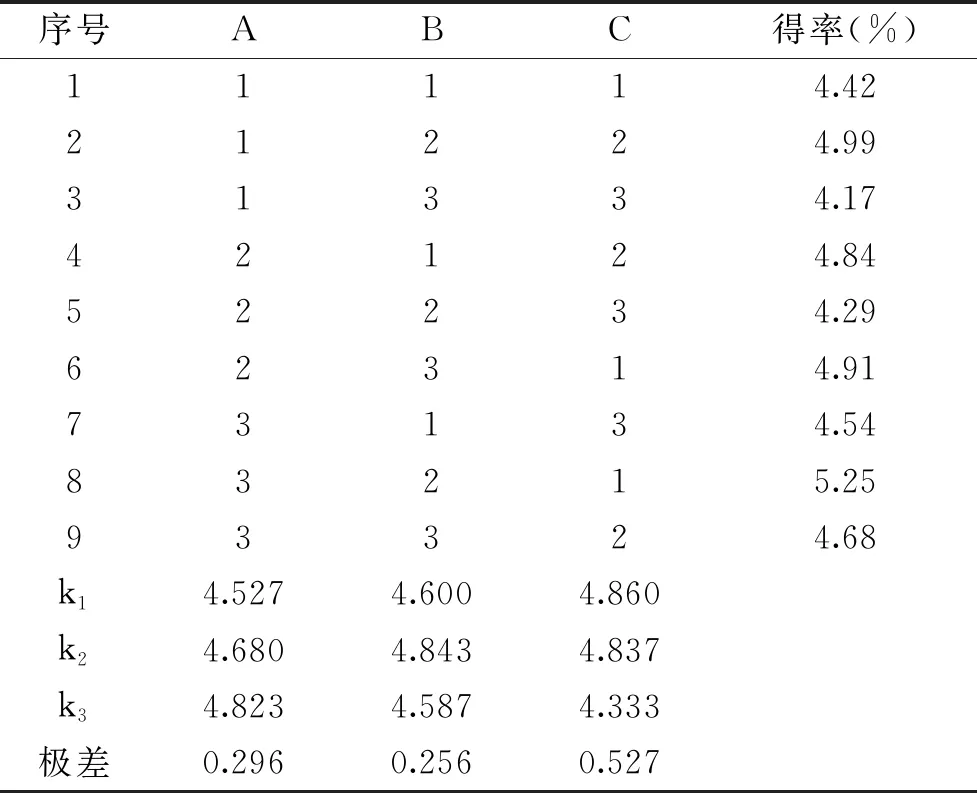
表2 发酵法提取β-葡聚糖正交试验表及实验结果Table 2 Orthogonal test table and experimental results of extraction of β-glucan by fermentation method

表3 方差分析表Table 3 Analysis of variance
2.4 发酵法提取β-葡聚糖的理化分析
2.4.1β-葡聚糖的保留率与纯度 比较了发酵法与水提法获得的青稞β-葡聚糖的保留率和蛋白质清除率,其结果见表4。发酵法得到的β-葡聚糖中含的蛋白质含量明显低于水提法得到的β-葡聚糖。两种方法得到的β-葡聚糖经过除蛋白处理后的β-葡聚糖保留率均在70%以上。

表4 活性炭吸附后β-葡聚糖保留率、纯度及蛋白质清除率Table 4 β-glucan retention,purity and protein clearance rate after activated carbon adsorption
2.4.2β-葡聚糖分子量的测定 用HPSEC-MALLS-RI联用法测定2种方法提取的β-葡聚糖分子量分布图(图6),运用激光检测器和 Astra 软件分析后所得结果为:水提的青稞β-葡聚糖平均分子量为7.759×105,与董磊[21]水提法提取青稞麸皮β-葡聚糖中结果相似;发酵法提取的青稞β-葡聚糖平均分子量为1.366×105,较水提法平均分子量小。

图6 两种提取方法得到的β-葡聚糖HPSCE图谱Fig.6 HPSCE profile of β-glucan obtained by two extraction methods
2.4.3β-葡聚糖的单糖组成分析 标准单糖组成(图7)与水提法β-葡聚糖单糖组成(图8)、发酵法β-葡聚糖单糖组成(图9)相比较发现:水提法提取的青稞β-葡聚糖中具有较多的杂糖,如D-阿拉伯糖、D-半乳糖、D-木糖、D-甘露糖,与文献[21]中结果相符,其产品需要额外加入除杂工艺;而发酵法提取的青稞β-葡聚糖中主要为D-葡萄糖以及少量D-木糖。
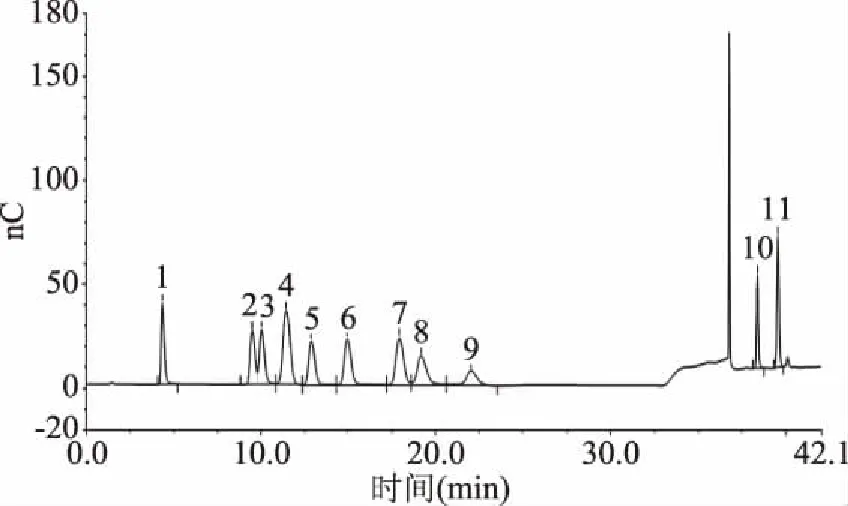
图7 标准单糖组成Fig.7 Standard monosaccharide composition注:1:L-海藻糖;2:L-鼠李糖;3:D-阿拉伯糖;4:D-氨基葡萄糖;5:D-半乳糖;6:D-葡萄糖;7:D-木糖;8:D-甘露糖;9:D-果糖;10:D-半乳糖醛酸;11:D-葡糖醛酸。
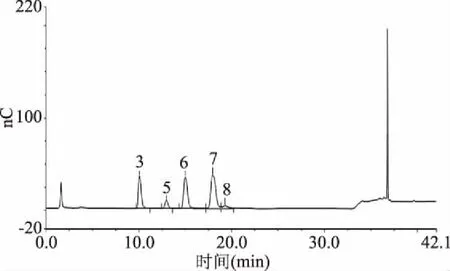
图8 水提法β-葡聚糖单糖组成Fig.8 Composition of the β-glucan monosaccharide by water extraction

图9 发酵法β-葡聚糖单糖组成Fig.9 Composition of the β-glucan monosaccharide by fermentation extraction
3 结论
通过单因素和正交实验得到的发酵法提取β-葡聚糖最佳工艺条件为:高活性干酵母为菌种、接种量0.05%、料液比1∶6,发酵温度32 ℃,发酵时间34 h,在该条件下β-葡聚糖平均得率为5.21%,与传统水提法提取的青稞β-葡聚糖相比,得率提高了60.8%。水提法提取的青稞β-葡聚糖单糖组成为D-阿拉伯糖、D-半乳糖、D-葡萄糖、D-木糖以及D-甘露糖。而通过发酵法得到的青稞β-葡聚糖单糖组成主要为D-葡萄糖,且与水提法相比含有更少量的蛋白质,通过活性炭吸附可以清除掉97.81%,纯度可达到91.21%。通过理化分析比较发现水提β-葡聚糖平均分子量为7.759×105,发酵法提取的β-葡聚糖平均分子量为1.366×105。
