2型糖尿病并发原发性骨髓纤维化及桥本氏甲状腺炎1例报告*
2020-04-29吴金银
吴金银 杨 杨
1 病例资料
1.1 第一次来本院就诊
患者,女,70岁,于2018-05-09因“血糖升高8年,双下肢水肿5天”就诊本院,既往史:高血压病2级(极高危)病史8年,规律服用硝苯地平缓释片和培哚普利,血压控制尚可;慢性胆囊炎、肝内胆管结石、脂肪肝多年。门诊查体:体温37.8℃,呼吸24次/min,脉搏90次/min,血压132/78mmHg,神清,精神尚可,颈软,无抵抗,双肺呼吸音清,未闻及干湿性啰音,心律齐,未闻及杂音,腹软,无压痛及反跳痛;双下肢轻度凹陷性水肿,胫前可见边界清晰的对称性红斑,局部皮温稍高,余未查及阳性体征。住院后检查,血常规:白细胞(WBC)升高14.69×109/L (参考范围3.5-9.5×109/L),中性粒细胞(NE)增加11.64×109/L(参考范围1.8-6.3×109/L),红细胞(RBC)、血红蛋白(HGB)和血小板(PLT)均在正常范围;C反应蛋白(CRP)水平升高9.3mg/L(参考范围0—8mg/L);血生化:丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)和肌酐(CREA)均正常,B型脑钠肽(BNP)升高183pg/ml(参考范围0—100pg/ml);甲状腺功能:游离三碘甲腺原氨酸(FT3)、游离甲状腺素(FT4)、抗甲状腺球蛋白抗体(ATG)均正常,促甲状腺素(TSH)升高10.77μIU/ml(参考范围0.3—4.6μIU/ml),抗甲状腺过氧化物酶抗体(A-TPO)>1 300.0IU/ml(参考范围0-16IU/ml),明显升高;血电解质:钾 2.8mmol/L(参考范围3.5—5.3mmol/L), 钙 2.06mmol/L(参考范围2.11—2.52mmol/L),镁0.68mmol/L(参考范围0.75—1.02mmol/L),均低于正常;血糖:空腹血糖(FPG)8.26mmol/L(参考范围3.9—6.1mmol/L),30min血糖10.41mmol/L(参考范围6.1—9.5mmol/L),60min血糖12.84mmol/L(参考范围6.7—9.0mmol/L),120min血糖17.50mmol/L(参考范围3.9—6.9mmol/L),180min血糖20.14mmol/L(参考范围3.9—6.1mmol/L),均显著大于正常参考值;胰岛素释放试验:空腹胰岛素(FINS)15.2μIU/ml(参考范围2.6—24.9μIU/ml),30min FINS 38.5μIU/ml(参考范围19—73μIU/ml),60min FINS 70.4μIU/ml(参考范围18—68μIU/ml),120min FINS 96.2μIU/ml(参考范围9—53μIU/ml),180min FINS 103.00μIU/ml(参考范围2.6—24.9μIU/ml),存在早期胰岛素分泌不足,胰岛素分泌峰值后移现象;抗核抗体(ANA):弱阳性(滴度为1∶100);其它风湿免疫学指标均阴性(-);血沉,类风湿因子,抗链球菌O,甲、乙、丙、戊肝炎抗体等未见明显异常。心脏彩超示升主动脉增宽,内径4.0cm(参考范围2.7-3.5cm);肝胆脾胰彩超示肝内胆管结石,胆囊炎性改变,脾大。电子胃镜示食管胃底静脉曲张,门脉高压性胃病。胸部CT示心脏增大、主动脉及冠状动脉粥样硬化,肝硬化可能,脾大、食管胃底静脉迂曲扩张,甲状腺密度不均匀。综合患者症状、体征及以上的检查,考虑以下诊断:(1)丹毒[1];(2)2型糖尿病(T2DM)[2];(3)桥本氏甲状腺炎(HT)并亚临床甲减[3];(4)高血压病2级(极高危)[4];肝硬化并食管胃底静脉曲张、电解质紊乱、水肿等原因待查。给予胰岛素降糖、头孢他啶抗感染、硫酸镁湿敷、呋塞米利尿、维持水电解质平衡等治疗8天后,患者体温正常,双下肢红肿等症状较前明显好转出院。出院前仅复查血常规,WBC(13.42×109/L)和NE(10.50×109/L)仍明显超出正常范围。出院后,继续维持降糖、降压治疗。
1.2 第二次来本院就诊
6个月后患者再次因“双下肢进行性水肿1月”入院,查体:眼睑及颜面部水肿,双侧颈静脉怒张,双下肺可闻及湿性啰音,右侧较明显,心尖部可触及抬举样搏动,律齐,三尖瓣听诊区可闻及全收缩期3/6级杂音,主动脉第一听诊区2/6级收缩期杂音,脾肿大超过肋下2cm,未到脐水平线,有压痛,脾区叩痛阳性,移动性浊音阳性,双下肢腹股沟以下部位重度凹陷性水肿。其临床症状和体征比第一次就诊时明显加重。实验室检查指标也较第一次就诊时异常程度加重,如WBC(20.05×109/L)、NE(15.49×109/L)、BNP(464.91pg/ml)更高。增加相关检查项目中,乳酸脱氢酶(LDH, 1 346U/L)超过正常,甲胎蛋白、抗平滑肌抗体、抗线粒体M2抗体、抗肝肾微粒体抗体、抗肝溶质抗原Ⅰ型抗体、抗可溶性肝抗原抗体、抗心凝脂相关抗体、抗中性粒细胞胞浆抗体等未见明显异常。腹部磁共振显示肝实质内未见明显异常信号,但脾肿大,胆囊壁增厚、水肿(图1)。心脏彩超不仅提示升主动脉仍增宽,而且双房增大,三尖瓣重度关闭不全,主动脉瓣退行性变,瓣叶轻度狭窄并轻至中度关闭不全,二尖瓣轻度关闭不全,肺动脉增宽并重度肺高压,下腔静脉增宽,左室舒张功能减低,少量心包积液(图2)。

图1 治疗前脾脏MRI显像图
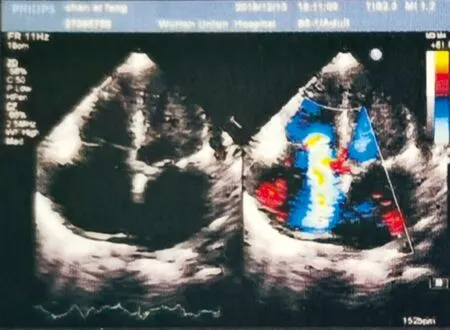
图2 治疗前心脏超声心动图
多普勒超声检查结果提示,下肢深浅静脉回流通畅,排除下肢静脉血栓。综上,继续维持T2DM、桥本氏甲状腺炎并亚临床甲减和高血压病2级(极高危)诊断,并积极治疗;继续排查心力衰竭、脾大、白细胞增多原因。经利尿、扩管、改善心肌供血、降压、降糖、护肝等对症治疗后,症状无明显好转。进一步分析认为,患者病情进展迅速,不能用心功能不全解释;患者WBC进行性升高,但无发热,无相关炎性症状、体征,不能用感染解释;患者长期脾大,但无基础疾病、肝病(包括肝硬化)及不良生活习惯等病史支持。于是考虑是否为血液系统疾病,如骨髓增生异常综合征、白血病等所致。因而建议骨穿和基因检测,骨髓象及血象结果为髓系分叶核粒细胞比值偏高,外周血可见幼稚粒细胞,中性粒细胞碱性磷酸酶(NAP)阳性率97%,积分363分,三系增生伴粒系感染,提示骨髓增生异常(图3)。
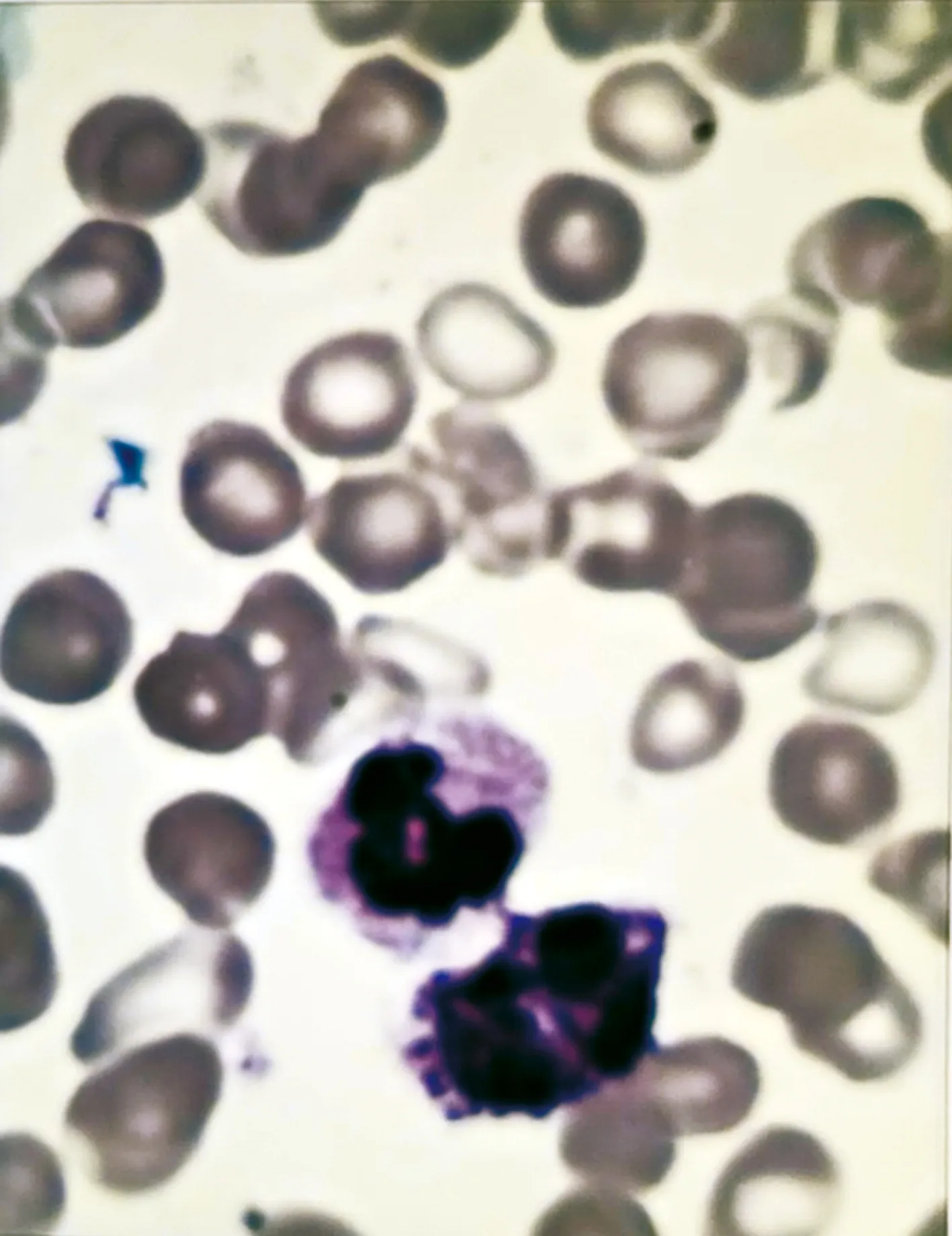
图3 骨髓细胞形态图
免疫分型显示CD34+和CD117+髓系原始细胞占有核细胞1.10%,比例稍高,表型未见明显异常,粒系发育模式异常,可见髓系及嗜碱性粒细胞,表型成熟,单核细胞以成熟阶段为主。骨组织形态学结果为巨核细胞增生明显,且局限区域可见成纤维细胞增生以及骨小梁增多(图4)。染色体核型分析未见异常染色体克隆(图5)。常见基因突变分析提示该样本JAK2V617F基因错义突变;白血病融合基因定量检测提示BCR-ABL (p210型)基因表达阴性,BCR-ABL (p210型)拷贝数0,BCR-ABL/ABL 0.00%。结合病史及以上检查,尤其是骨髓细胞学及基因检测结果,提示该患者符合原发性骨髓纤维化(PMF)诊断标准[5]。至此,本病例最终诊断为T2DM并PMF和HT。
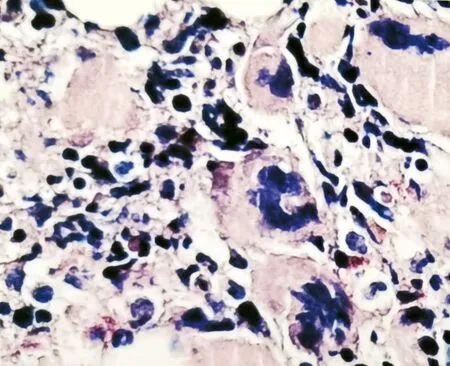
图4 染色体核型分析图
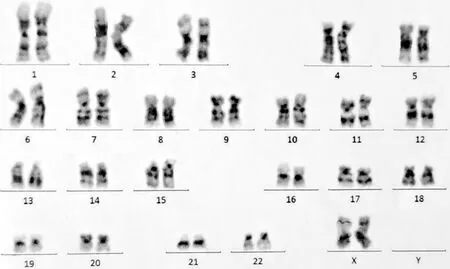
图5 骨髓增殖性肿瘤(Myeloproliferative Neoplasms, MPN)
患者于2018-12-13开始给予磷酸芦可替尼、羟基脲、反应停、达那唑治疗2个月,双下肢水肿明显好转,心功能改善;2019-02-18再次复查血常规,WBC(7.68×109/L)和NE(3.68×109/L)较前明显下降,恢复至正常参考值范围;复查腹部CT见脾肿大较前明显缩小(图6);血糖稳定;精神和生活状态良好。顺利出院。

图6 治疗后脾脏CT显像图
2 讨 论
T2DM的常见并发症包括微血管病变(DM肾病、DM视网膜病变、DM心肌病)、大血管病变(动脉粥样硬化)、神经系统病变(中枢神经病变、周围神经病变、自主神经病变)、DM足,近年来关于DM并发癌症的相关报道也屡见不鲜,如乳腺癌、膀胱癌、胰腺癌等。但国内外尚无文献报道T2DM同时并发PMF和HT。本文报道一例老年T2DM并发PMF及HT患者的诊疗过程,以飨读者。对于T2DM-PMF-HT三者之间是否有内在联系,目前尚难肯定。相关研究认为,T2DM多发生于中老年人群,他们多有慢性炎症(年龄相关性慢性炎症或炎症衰老),即在自然衰老进程中,体内促炎因子,如肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)和C反应蛋白(CRP)等可能慢性进行性升高,因此与部分年龄相关性疾病,如T2DM、自身免疫性疾病-桥本氏甲状腺炎等的发生发展存在联系[6,7]。胰岛素不仅能治疗T2DM,还能通过抑制促炎转录因子相关基因的表达发挥抗炎效应[8],但当机体出现胰岛素抵抗,包括炎性因子长期刺激引起胰岛素抵抗时,促炎转录因子相关基因表达增加,使胰岛素降糖和抗炎作用减弱,抑或加重慢性炎症[9]。此外,胰岛素抵抗还能够通过激活JAK2基因,激活细胞因子信号转导抑制因子(SOCS),从而抑制细胞因子,包括胰岛素受体底物1和胰岛素受体底物4(IRS),进一步加重胰岛素抵抗[10]。胰岛素抵抗越严重,被其激活的JAK2越多,JAK2发生突变的几率也会越大,可能导致各种疾病,如JAK2突变中,JAK2V617F基因突变被证实为PMF主要病因[11],故临床应高度关注胰岛素抵抗及其引发的基因突变。
PMF属于骨髓增殖性肿瘤(MPS)中的一种,以多功能造血干细胞的克隆性增殖为特征,表现为异常干细胞产生并释放细胞因子和生长因子进入骨髓微环境,刺激骨髓纤维组织增生以及基质改变,并累及髓外器官如肝、脾等,出现一系列临床表现,如脾肿大、发热、呼吸困难、贫血、体重减轻、骨痛和腹泻等[12,13]。本文报道的患者即表现为脾肿大及其伴发病理改变,久治不愈,关键在于诊断不明确。第二次来本院就诊时采用骨穿和基因检测发现患者骨髓象和骨组织病理改变明显,再经MPN常见基因突变分析发现JAK2V617F错义突变,结合其它病史和检查,确诊为T2DM并PMF和HT,经对症治疗,收效显著。
PMF的发病率为0.58/10万,无明显性别差异,发病年龄中位数为67岁[14];中位生存期为3.5年-5.5年,约20%的患者死于PMF转化为急性髓性白血病,另一部分患者死于感染、血栓或出血等并发症[15]。国人PMF的诊断以2015年中国专家共识[5]为标准,共识中指出50%—60%的PMF患者有JAK2V617F突变,另外两个突变基因为MPL和CALR,突变率分别为5%-10%及15%—20%[16,17]。但有报道10%的PMF患者并未检测出这三种突变基因,称为三阴性PMF,预后较差[18],应引起临床重视。
综上所述,慢性炎症时体内增多的促炎因子,容易引起胰岛素抵抗、T2DM、桥本氏甲状腺炎等,大部分T2DM且胰岛素抵抗患者存在JAK基因突变,可能是PMF的病因,这种联系或机制尚需深入研究以确证。本文报道的T2DM老年患者并发PMF及HT,其诊疗过程提示临床相关对症治疗无明显疗效时,应拓宽思维,多研究临床表现和已有资料,进行全面检查,尤其是骨髓检查及基因检查,以求确诊,避免误诊和漏诊。
◀
