参附注射液联合去甲肾上腺素对脓毒症休克兔舌下微循环的影响
2020-04-29廉应涛陆礼萍冯丽芝
徐 松 姚 兰 侯 果 廉应涛 陆礼萍 冯丽芝 余 追
脓毒症(Sepsis)是因感染引起的宿主反应失调导致的危及生命的器官功能障碍,是一种全身炎症反应综合征(Systemic Inflammatory Response Syndrome,SIRS)[1]。在美国,严重脓毒症的发生率约为300/10万,院内死亡率高达25%,其中脓毒症休克(Septic Shock)的死亡率最高,接近50%[2]。在我国,每年约有71万例严重脓毒症和55万例脓毒症休克,其中约有45万人死于脓毒症休克[3]。脓毒症休克是在脓毒症的基础上,出现与器官功能障碍相关的细胞与代谢紊乱,同时伴有严重的血流动力学改变。目前关于脓毒症休克的治疗除补液、抗感染与营养支持等基础治疗外,主要通过血管升压药物改善脓毒症休克患者的循环状况,有研究显示,血管升压药物虽然改善了脓毒症患者的大循环,但其微循环并未得到改善[4]。微循环是进行组织氧气交换的场所,是由直径小于100μm的小动脉、毛细血管和小静脉组成。研究表明脓毒症休克时伴随着严重的、复杂的且不均匀的微循环变化,微循环低灌注可能导致脓毒症或脓毒症休克患者预后不良或死亡率增加[5]。因此纠正微循环功能障碍成为脓毒症休克复苏的关键。近年来国内关于中药治疗脓毒症的研究颇多,特别是参附注射液(Shenfu Injection,SFI),有研究表明SFI能够抑制炎症,调节免疫[6]。本文结合SFI在脓毒症方面的一些研究,观察SFI联合去甲肾上腺素(Norepinephrin,NE)对脓毒症休克兔舌下微循环功能障碍的影响。
1 材料与方法
1.1 实验动物、药剂和仪器
1.1.1实验动物:雄性新西兰兔30只,普通级,购于湖北逸挚诚生物科技有限公司,体重(2.5±0.5)kg,许可证号SCXK(鄂)2016-0020。实验开始前禁食12h,自由饮水。
1.1.2药品和试剂: SFI (四川雅安三九药业有限公司,批号111232),重酒石酸NE注射液(远大医药中国有限公司,批号:141204),乌拉坦(国药集团化学试剂有限公司,批号:20180308),脂多糖(LPS,SIGMA-ALORICH, 批号:63103),乳酸钠林格注射液(石家庄四药有限公司,批号:1903071703),氯化钠注射液(上海百特医疗用品有限公司,批号:S1807029),葡萄糖注射液(上海百特医疗用品有限公司,批号:S1903016)。
1.1.3仪器:PowerLab多导电生理记录仪(ADInstruments埃德仪器),Microsee舌下微循环成像系统(广州医软智能科技有限公司),微量注射泵(深圳瑞沃德生命科技有限公司,规格R452)。
1.2 动物分组和处理
随机将30只新西兰兔分为5组,即对照组(Sham组)、模型组(Model组)、NE组、SFI组和SFI+NE组,每组6只。5组动物均给予乌拉坦(浓度20%,剂量3-4ml/kg)静脉注射麻醉,股动脉置管(PE50),通过多导生理记录仪监测平均动脉压(MAP)和心率(HR)。稳定20min,记录基线状态MAP和舌下微循环各指标,包括:血管密度(Total Vessel Density,TVD)、微血管血流指数(Microvascular Flow Index,MFI)、异质性指数(Flow Heterogeneity Index,HI)、灌注血管比例(Proportion of Perfused Vessels,PPV)、灌注血管密度(Perfused Vessel Density,PVD)。除Sham组不进行脓毒症模型的建立外,其余各组建立脓毒症休克模型[5]:通过耳缘静脉给予LPS(2mg/kg),当MAP较基础值下降35%并持续时间达10min以上为造模成功。模型复制成功后各组均给予乳酸钠林格注射液30ml/kg补液1h。NE组在模型建立后通过微量注射泵以2.0μg/kg.min的速度给予去甲肾上腺素(40μg/ml)6h;SFI组分别造模前、休克时、休克后1h和休克后2h给予SFI(2.5ml/kg); SFI+NE组同时按NE组和SFI组处理方法进行干预;Model组和Sham组给予等体积的生理盐水,分6h持续泵入。
1.3 观测指标和方法
通过PowerLab电生理记录仪记录基线状态和休克0h、1h、3h、6h的MAP、HR,利用Microsee舌下微循环成像系统采集基线状态及休克0h、1h、3h、6h的舌下微循环侧流暗视野成像技术(SDF)视频片段,并通过该仪器自动分析系统分析计算舌下微循环TVD、MFI、HI、PPV和PVD。
1.4 统计学处理
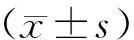
2 结 果
2.1 各组MAP比较
基线状态时各组MAP无明显统计学差异(P>0.05),其余时间点各组MAP差异具有统计学意义(P<0.05)。休克时和休克后1h,与Sham组比较,Model组、NE组、SFI组和SFI+NE组MAP均降低(t均>5.87,P<0.05),且Model组、NE组、SFI组、SFI+NE各组间MAP无明显统计学差异(t均<1.74,P>0.05)。休克后3h,各组MAP较Sham组降低,且差异有统计学意义(t均>3.14,P<0.05),SFI+NE组MAP较Model组、NE组、SFI组均有明显改善(t均>2.96,P<0.05),而Model组、NE组和SFI组各组间MAP无统计学差异(t均<1.18,P>0.05)。休克后6h,Model组、NE组、SFI组和SFI+NE组MAP均低于Sham组,且差异具有统计学意义(t均>2.59,P<0.05),NE组、SFI组、SFI+NE组MAP较Model组升高,差异有统计学意义(t均>2.50,P<0.05),同时SFI+NE组MAP较NE组和SFI组明显改善(t均>2.87,P<0.05)。见表1。

表1 各组不同时间点兔MAP比较
注:与Sham组比较,1)P<0.05;与Model组比较,2)P<0.05;与NE组比较,3)P<0.05;与SFI组比较,4)P<0.05
2.2 各组舌下微循环指标比较
基线状态时各组TVD、MFI、HI、PPV、PVD指标均无明显统计学差异(P>0.05),休克模型建立后各时间点Model组、NE组、SFI组、SFI+NE组TVD、MFI、HI、PVD指标均较同时间点Sham组差(t均>3.02,P<0.05),休克时,Model组、NE组、SFI组、SFI+NE组各组间各指标无显著统计学差异(t均<0.08,P>0.05)。休克后1h,MFI、HI、PPV各指标在Model组、NE组、SFI组、SFI+NE组间均无明显统计学差异(t均<1.62,P>0.05),与Model组相比,SFI组和SFI+NE组TVD指标、SFI组和NE组PVD指标均有明显改善(t均<2.43,P<0.05),休克后3h,TVD、HI、PPV各指标在Model组、NE组、SFI组和SFI+NE组间差异无明显统计学差异(t均<1.45,P>0.05),SFI组MFI较Model组有明显改善(t=2.38,P<0.05),同时PVD指标方面,SFI组较Modle组、NE组、SFI+NE组有明显改善(t均>2.52,P<0.05)。休克后6h,Model组、NE组、SFI组和SFI+NE组TVD、HI、PPV、PVD差异无统计学意义(t均<1.88,P>0.05),SFI组MFI较Model组、NE组、SFI+NE组均有明显改善,且差异有统计学意义(t均>2.86,P<0.05)。其余各指标在各时间点各组间无统计学差异(P>0.05)。见表2-表6。

表2 各组不同时间点兔舌下微循环TVD比较
注:与Sham组比较,1)P<0.05;与Model组比较,2)P<0.05
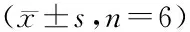
表3 各组不同时间点舌下微循环MFI比较
注:与Sham组比较,1)P<0.05;与Model组比较,2)P<0.05;与NE组比较,3)P<0.05;与SFI+NE组比较,4)P<0.05
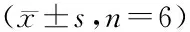
表4 各组不同时间点兔舌下微循环HI比较
注:与Sham组比较,1)P<0.05
3 讨 论
由于脓毒症期间机体炎性介质、一氧化氮(NO)和活化的白细胞过度释放,导致周围血管舒张、血管通透性增加和低血容量,从而进展为脓毒症休克[7]。
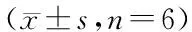
表5 各组不同时间点兔舌下微循环PPV比较

表6 各组不同时间点兔舌下微循环PVD比较
注:与Sham组比较,1)P<0.05;与Model组比较,2)P<0.05;与NE组比较,3)P<0.05;与SFI+NE组比较,4)P<0.05
在脓毒症休克中,NE是推荐用于将MAP恢复至65mmHg的首选血管升压药物[8]。NE通过α肾上腺素能受体介导血管收缩,增加脓毒症休克患者的MAP[9,10]。本研究结果显示,在兔脓毒症休克后6h,单独应用NE或SFI均改善了脓毒症休克兔的MAP,但两种药物联合应用对改善脓毒症休克兔MAP的效果更好,这与2018年中国脓毒症/脓毒症休克急诊治疗指南中提出的在使用血管活性药物的基础上加用SFI能够增加提升血压的效果和稳定血压观点一致[8]。
SFI来源于中医经典方剂,由红参与附子组成,主要活性成分含人参皂苷和乌头碱,具有提高血压和增强心肌收缩力等多种药理作用[11]。本文研究发现,SFI注射后1h,脓毒症休克兔TVD和PPV微循环指标能够得以改善,在注射3h/6h后,MFI、PVD亦得到改善。
脓毒症休克时,在各种炎性因子的影响下,微循环发生复杂的改变。首先,血管收缩和血管舒张物质之间的平衡改变,导致血管收缩张力及血流调节可能发生改变。血管收缩在缩血管物质(如内皮素)过度释放的影响下发生,同时舒血管物质NO局部释放也可能受损,从而内皮细胞间的相互作用发生改变,使得调节微血管血流的网络信号受损[12]。其次,微血栓以及更常见的白细胞、红细胞暂时阻塞微血管官腔,黏附于内皮表面从而阻止微循环的血流流动[13,14]。有研究表明, SFI可改善微循环,抑制炎症反应,保护缺血心肌细胞[15]。现代药理研究表明,SFI主要成分之一的人参皂苷具有抑制炎性介质和清除自由基的作用,能够调节血压和血管舒缩功能[16,17],SFI可能通过减少炎性介质的表达改善全身微循环。
本研究结果显示,SFI联合NE在休克后6h时对MAP的改善效果,优于单独应用NE或SFI,但对微循环各指标并未显示出相似的改善趋势,这可能是高剂量的NE会增加免疫抑制。研究表明,为了维持目标MAP所需的高剂量NE可能会增加免疫抑制以及导致危及生命的心率失常[18,19],还可能增强凝血功能[20]。脓毒症的典型特征是初始细胞因子介导的过度炎症反应,之后是免疫抑制[21]。张宁等[22]研究表明,在接受SFI治疗后,脓毒症患者释放促炎因子(如肿瘤坏死因子α和白介素6)的免疫能力明显减弱,且患者CD4+和CD8+淋巴细胞显著增加。SFI能够调节宿主免疫反应[23,24]。
SFI联合NE使用,一方面可能由于NE增强凝血功能,减缓了微循环血液流动;另一方面可能由于NE增加免疫抑制而降低SFI的免疫调节作用,从而抑制免疫反应降低SFI对部分微循环指标的改善作用。
综上所述,SFI联合NE与单独应用NE或单独应用SFI比较,可明显改善MAP,但并未发现联合用药可以更有效的改善微循环血流供应和促进微循环的灌注。
◀
