不同初始补液速率对内毒素休克猪肺损伤的影响*
2020-04-29赵玉乾史川川李建国
赵玉乾 胡 波 李 琪 史川川 项 辉 李建国
内毒素性休克是由全身炎性反应和失控宿主反应导致以外周血管舒张为特征的休克类型,脓毒症是其最常见的原因[1]。随着休克情况的加重,机体各个脏器会出现不同程度的损伤,而肺是最常见也是最先受损的器官之一[2]。早期恰当充分的液体复苏是内毒素性休克治疗的基石,但过量的液体输注又与临床不良结局相关[3]。因此早期液体复苏的启动时机、输注量和输注速率一直是研究热点,但却没有明确的相关建议指导临床治疗。本研究致力通过观察初始不同液体复苏速率对内毒素性休克猪肺损伤的影响,以期为内毒素性休克早期液体复苏的速率设定提供数据支持。
1 材料与方法
1.1 实验动物与试剂
普通级巴马香猪24头,体质量为30±3kg,雌雄不拘(由武汉大学中南医院动物中心提供,动物许可证号:4207470736)。主要试剂:大肠埃希菌内毒素(LPS,0111:B4,Sigma,USA),10%戊巴比妥钠、Tunel试剂盒、BSA牛血清白蛋白(美国Roche公司),蛋白酶K、DAPI染液、细胞破膜液、抗荧光淬灭封片剂(武汉阿斯本生物技术有限公司)。
1.2 动物分组及处理
1.2.1动物饲养与麻醉置管:实验猪手术前在动物房饲养2天以适应环境,操作前一天禁食12h,不禁水。实验当天,首先以3%戊巴比妥钠(30mg/kg)肌肉注射行诱导麻醉。诱导后动物取仰卧位,连接心电监护仪记录生命体征基线水平。行气管切开连接呼吸机机械通气,置入颈内静脉导管(双腔)和股动脉导管。颈内静脉置管后持续给予3%戊巴比妥钠(2mg/kg/h)和地西泮(0.2mg/kg/h)维持麻醉。置管操作完成后观察1h至生命体征恢复至基线水平。
1.2.2内毒素休克模型制备:参考张家瑛等[4]的方案,每头猪均给予LPS,总量20μg/kg,30min内通过静脉输液泵泵注完毕。当动脉收缩压较基础水平下降40%时界定为模型制备成功。
1.2.3动物分组和初始液体复苏(3h内)策略:依照随机对照表法将实验动物分为4组,内毒素休克组(n=6),造模成功后的头3h内不进行液体复苏;慢速补液组(n=6):造模成功后即开始液体复苏,并将此时记录为零时,经颈内静脉导管按照10ml/kg/h速率匀速输注30ml/kg乳酸林格氏液,3h输注完毕;中速补液组(n=6):造模成功后以30ml/kg/h速率匀速输注30ml/kg乳酸林格氏液,1h输注完毕,随后2h不进行液体复苏;快速补液组(n=6):造模成功后以120ml/kg/h速率匀速输注30ml/kg乳酸林格氏液,15min输注完毕,随后2h 45min不进行液体复苏。各组从零时(造模成功)即开始静脉泵入去甲肾上腺素维持血压,目标血压为基线水平。
1.2.43-12h的复苏策略:3h后各组均按照以下流程进行复苏,如血压水平降至基线值80%以下,重新启动乳酸林格氏液复苏,以10ml/kg/h速率输注,同时联合去甲肾上腺素泵入,一旦血压恢复至基线水平则停止液体复苏。这一策略持续至复苏后12h。12h后以过量镇静剂联合呼吸抑制方式处死动物。
1.3 观察指标和方法
1.3.1动脉血乳酸水平监测:实验中各组动物注射LPS前及液体复苏0h、3h、6h、9h及12h分别采集动脉血0.3ml进行乳酸检测并计算乳酸清除率。6h乳酸清除率=(0h乳酸值-6h乳酸值)/0h乳酸值×100%;12h乳酸清除率=(0h乳酸值-12h乳酸值)/0h乳酸值×100%。
1.3.2肺组织病理学检测:动物处死后,迅速留取适量肺组织,4%多聚甲醛固定,常规石蜡包埋切片行苏木精-伊红染色,光学显微镜下观察病理变化。参考Mrozek等[5]的方法,根据肺组织是否出现水肿、坏死、出血和脂肪坏死及血管炎性细胞浸润等对肺组织进行病理学评分。
1.3.3肺组织髓过氧化物酶(MPO)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)水平检测:取猪肺组织约0.3cm见方的组织块,用4%多聚甲醛液固定24h,石蜡包埋切片,行免疫荧光法检查MPO、IL-1β、IL-6,阳性表达为视野内组织被染成红色,对红色染色细胞进行计数。
1.3.4肺组织凋亡细胞分析:采用Tunnel染色法检查肺内皮、肺上皮细胞凋亡,阳性表达为视野内组织被染成绿色,并记录阳性染色细胞数和细胞总数,计算凋亡指数=阳性细胞数/总细胞数×100%。
1.4 统计学处理
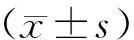
2 结 果
2.1 血清乳酸值和乳酸清除率
血气分析检查乳酸结果显示(表1),内毒素休克组及各补液组乳酸基础值和补液0h值组间均无明显差异(P>0.05)。各组间3h-12h乳酸水平差异有统计学意义(P<0.05);与内毒素休克组相比,各补液组在补液3h-12h的乳酸值均显著降低(P<0.05);在不同补液速率组中,中速补液组及快速补液组在补液3h-12h的乳酸值显著低于慢速补液组(P<0.05),中速补液组及快速补液组两者乳酸值差异无统计学意义(P>0.05)。各补液组6h及12h乳酸清除率差异有统计学意义(P<0.05);与慢速补液组相比,中速补液组及快速补液组6h及12h乳酸清除率明显增高,差异有统计意义(P<0.05);与快速补液组相比,中速补液组6h及12h乳酸清除率差异无统计学意义(P>0.05),见表2。
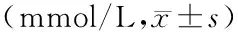
表1 各组各测量时间点乳酸值
注:与内毒素休克组比较,1)P<0.05;与慢速补液组比较,2)P<0.05;与同组基础值比较,3)P<0.05
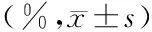
表2 各补液组6h和12h乳酸清除率
注:与慢速补液组比较,1)P<0.05
2.2 肺组织病理学改变
肺组织HE染色结果显示(图1),内毒素休克组猪肺泡结构破坏明显,肺间质增厚,肺泡腔和肺间质内弥漫性出血、广泛炎性细胞浸润;慢速补液组猪肺可见肺泡正常结构被破坏,肺泡腔和肺间质内大量出血和炎性细胞浸润,但相较于内毒素休克组轻;中速补液组猪肺可见肺泡结构破坏,肺泡腔和肺间质内少量出血和炎性细胞浸润;快速补液组猪肺可见肺泡结构破坏, 肺泡腔和肺间质内少量出血和炎性细胞浸润,但较中速补液组重。各组肺组织病理评分差异有统计学意义(F=19.26,P<0.05)。相较于内毒素休克组,早期补液组肺组织病理评分均明显下降,差异具有统计学意义(P<0.05);在不同速率的补液各组中,中速补液组的肺组织病理评分显著小于慢速补液组和快速补液组,同时快速补液组小于慢速补液组,差异具有统计学意义(P<0.05)。
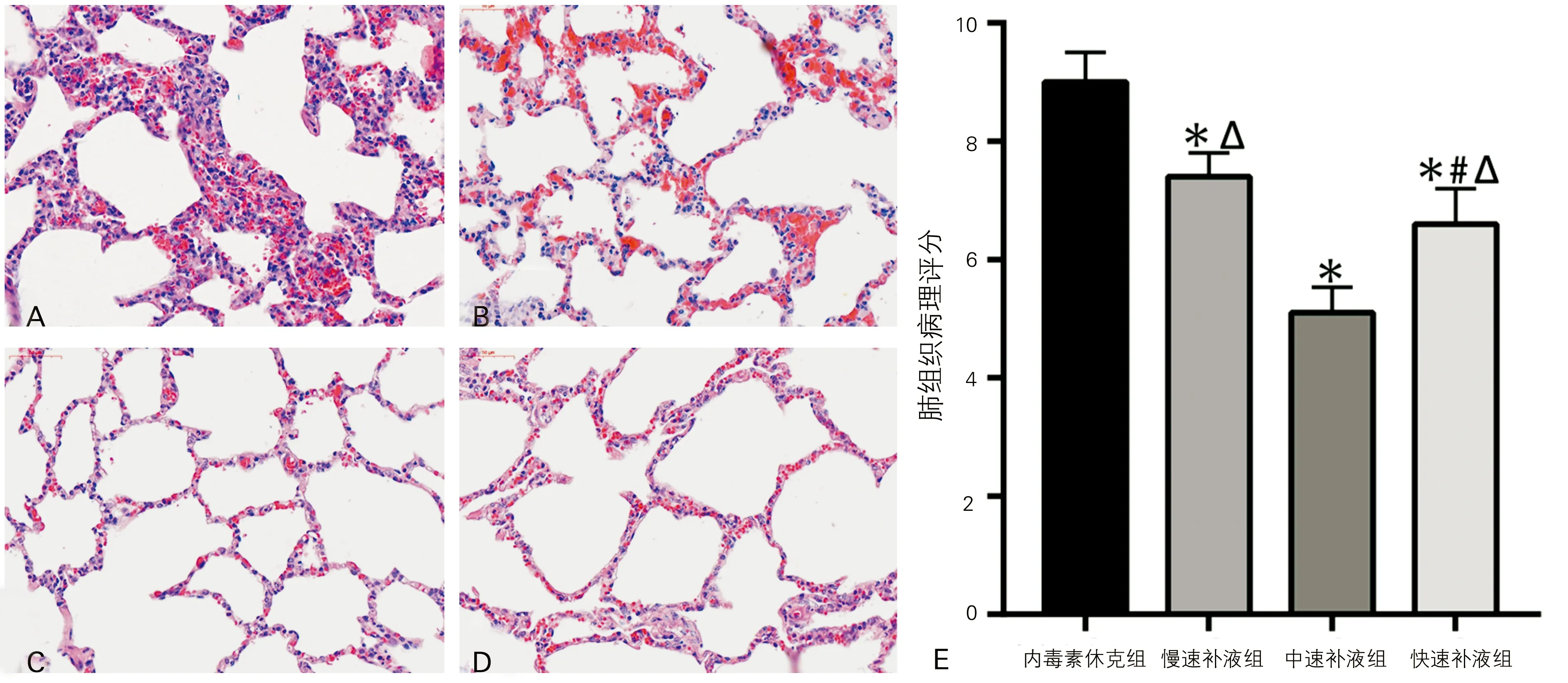
A:内毒素休克组;B:慢速补液组;C:中速补液组;D:快速补液组;E:各组肺组织病理评分(与内毒素休克组比较,*P<0.05;与慢速补液组比较,#P<0.05;与中速补液组比较,ΔP<0.05)
图1 各组猪肺组织HE染色(光学显微镜,×400)
2.3 肺组织MPO水平检测
猪肺组织免疫荧光染色显示(图2),各组肺组织MPO阳性细胞计数差异有统计学意义(F=30.74,P<0.05);相较于内毒素休克组,早期补液各组MPO阳性细胞计数都明显下降,差异具有统计学意义(P<0.05);在不同速率的补液组中,中速补液组的MPO阳性细胞计数显著小于慢速补液组和快速补液组,同时快速补液组小于慢速补液组,差异均具有统计学意义(P<0.05)。
2.4 肺组织IL-6水平检测
猪肺组织免疫荧光染色显示(图3),各组肺组织IL-6阳性细胞计数差异有统计学意义(F=50.82,P<0.05);相较于内毒素休克组,早期补液各组IL-6阳性细胞计数都明显下降,差异具有统计学意义(P<0.05);在不同速率的输液组中,中速补液组的IL-6阳性细胞计数显著小于慢速补液组和快速补液组,同时快速补液组小于慢速补液组,差异均具有统计学意义(P<0.05)。
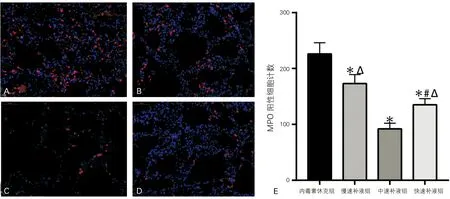
A:内毒素休克组;B:慢速补液组;C:中速补液组;D:快速补液组;E:各组肺组织MPO阳性细胞计数(与内毒素休克组比较,*P<0.05;与慢速补液组比较,#P<0.05;与中速补液组比较,ΔP<0.05)
图2 各组猪肺细胞MPO免疫荧光染色(荧光显微镜, ×400)
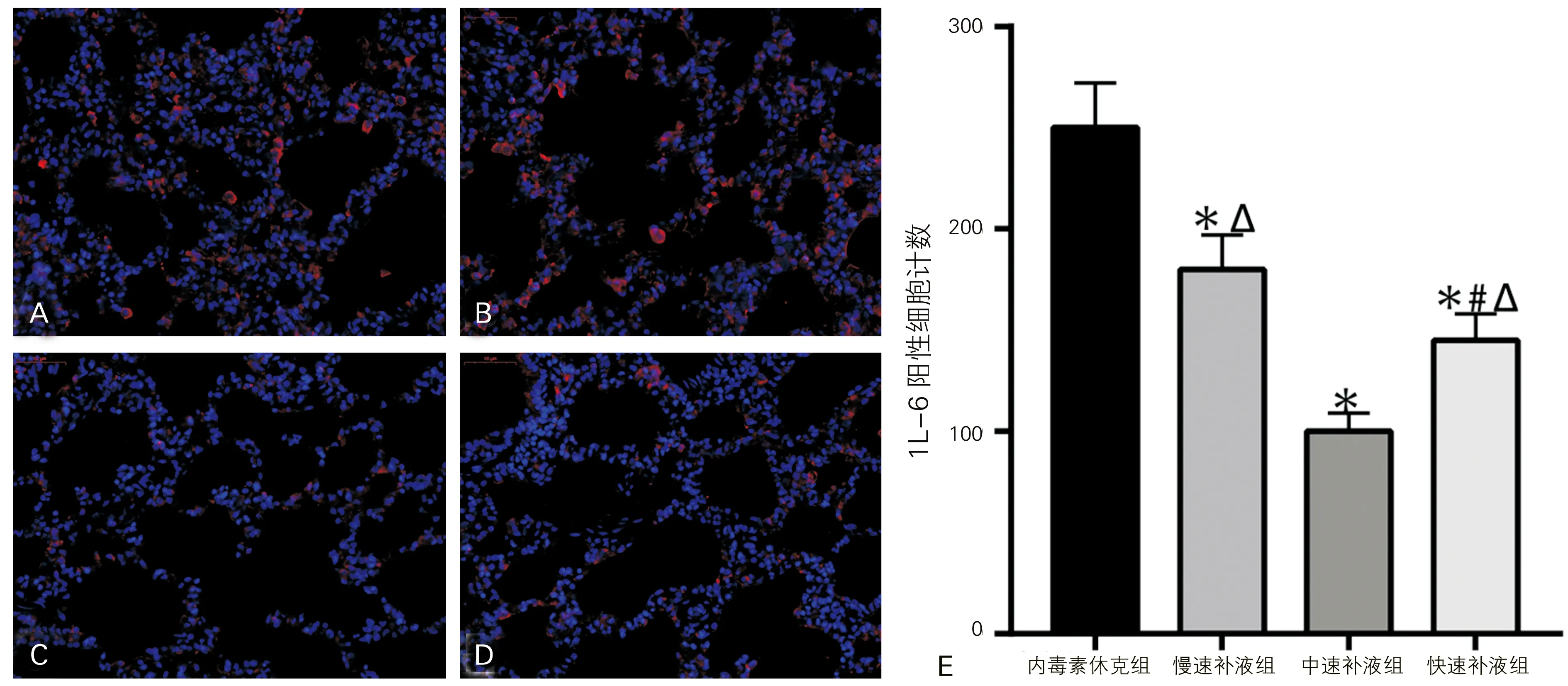
A:内毒素休克组;B:慢速补液组;C:中速补液组;D:快速补液组;E:各组肺组织MPO阳性细胞计数(与内毒素休克组比较,*P<0.05;与慢速补液组比较,#P<0.05;与中速补液组比较,ΔP<0.05)
图3 各组猪肺细胞IL-6免疫荧光染色(荧光显微镜, ×400)
2.5 肺组织IL-1β检测
猪肺组织免疫荧光染色显示(图4),各组肺组织IL-1β阳性细胞计数差异有统计学意义(F=20.18,P<0.05);相较于内毒素休克组,早期补液各组肺组织IL-1β阳性细胞计数都明显下降,差异具有统计学意义(P<0.05);在不同速率的输液组中,中速补液组的IL-1β阳性细胞计数显著小于慢速补液组和快速补液组,同时快速补液组小于慢速补液组,差异均具有统计学意义(P<0.05)。
2.6 肺组织细胞凋亡水平检测
猪肺组织Tunnel荧光染色显示(图5),各组肺组织IL-1β阳性细胞计数差异有统计学意义(F=25.64,P<0.05);相较于内毒素休克组,早期补液各组凋亡细胞指数均明显下降,差异具有统计学意义(P<0.05);在不同速率的补液组中,中速补液组的凋亡细胞指数显著小于慢速补液组和快速补液组,同时快速补液组小于慢速补液组,差异均具有统计学意义(P<0.05)。
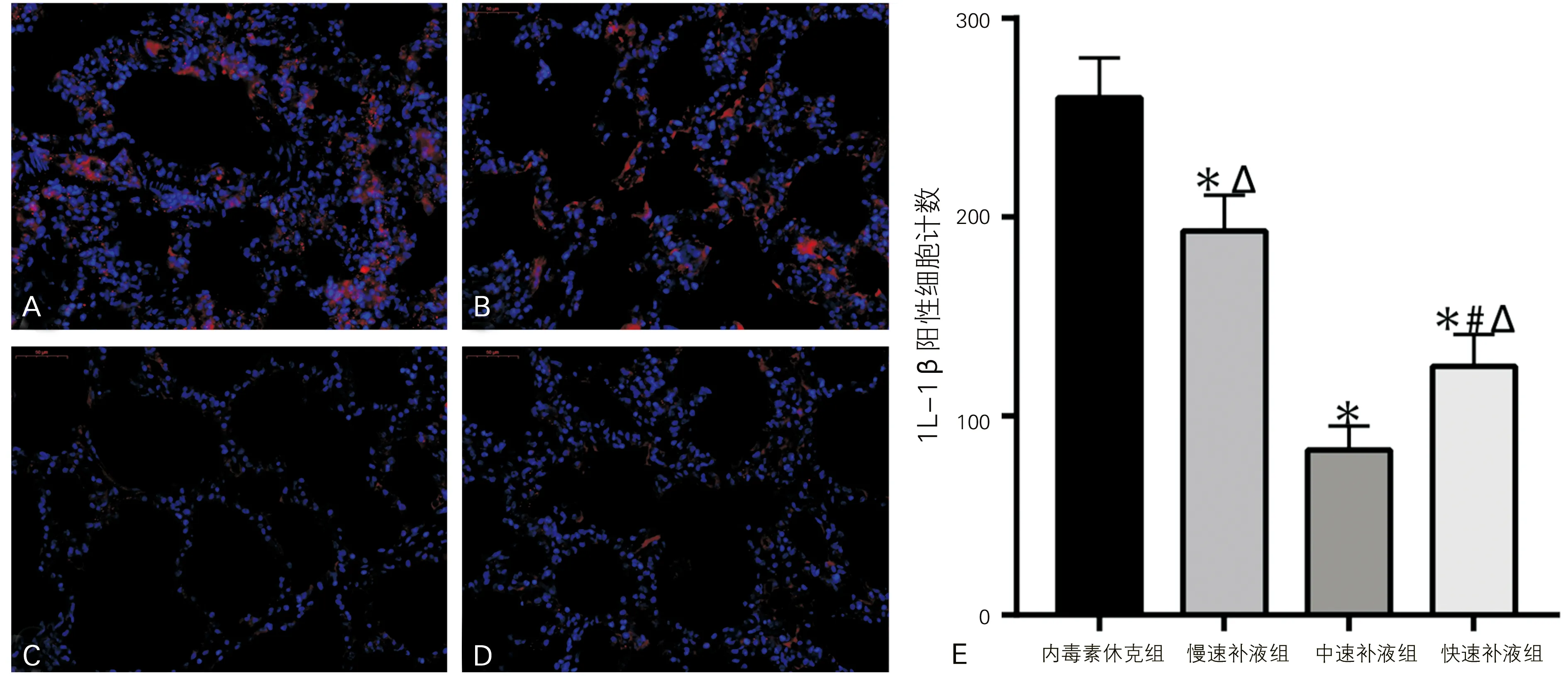
A:内毒素休克组;B:慢速补液组;C:中速补液组;D:快速补液组;E:各组肺组织IL-1β阳性细胞计数(与内毒素休克组比较,*P<0.05;与慢速补液组比较,#P<0.05;与中速补液组比较,ΔP<0.05)
图4 各组猪肺IL-1β免疫荧光染色(荧光显微镜,×400)

A:内毒素休克组;B:慢速补液组;C:中速补液组;D:快速补液组;E:各组肺组织IL-1β阳性细胞计数(与内毒素休克组比较,*P<0.05;与慢速补液组比较,#P<0.05;与中速补液组比较,ΔP<0.05)
图5 各组猪肺细胞凋亡tunnel染色(荧光显微镜,×400)
3 讨 论
内毒素性休克在临床的主要体现就是脓毒症。脓毒症是由于感染引起的失调宿主反应导致的危及生命的器官功能障碍。脓毒症患者由于细菌、病毒等病原体的作用,其血管张力降低,血容量不足,组织器官出现缺血缺氧,同时由于感染导致机体大量炎性因子的释放,氧化与抗氧化机制的失衡,共同导致各器官出现损伤[6, 7]。
在脓毒症中,由于外周血管张力的降低和血管渗透性增加导致有效循环血容量不足,许多器官组织处于低灌注状态出现缺血、缺氧损伤[8, 9]。早期的液体复苏治疗作为脓毒症治疗中的重要方法,可有效纠正循环血容量不足,提高脓毒症患者氧输送能力,改善组织器官灌注,稳定及改善脓毒症患者内循环及微循环缺氧状态,减轻器官损伤,降低病死率[10-12]。本研究结果显示,内毒素休克动物模型建立后动物血乳酸水平明显升高,补液组经过液体复苏后,3h时其乳酸水平较休克值有所降低,但乳酸清除率有所差别,快速及中速补液组乳酸清除率水平显著高于慢速补液组。这一结果也验证了早期的液体复苏治疗有助于改善脓毒症患者器官组织低灌注状态,改善组织微循环。同时快速的液体复苏策略在改善组织灌注这一方面效果更加显著,这与林敏等[13]的研究结果相一致。分析其原因,可能是早期快速的液体复苏策略能更快的补充血容量,恢复由于血管张力改变导致的循环血容量相对不足的状况,保证了足够的灌注压和灌注血流,从而助于改善组织器官缺血缺氧的低灌注状态。
此外炎性因子介导的细胞损伤及氧化应激反应也是脓毒症肺损伤的重要机制之一。脓毒症时炎性细胞被激活,IL-1β、IL-6等炎性介质大量释放,在其与趋化因子的共同作用下,中性粒细胞通过吞噬、脱颗粒等反应造成肺泡上皮细胞及血管上皮细胞的损伤。同时中性粒细胞内的MPO在炎性介质的激活下催化过氧化氢生成次氯酸,次氯酸又与巯基及甲琉酰基反应,启动脂质过氧化反应,损伤肺组织及肺血管内皮细胞[14,15]。炎性介质作为决定肺损伤是否发生的关键,相关研究表明减少炎性因子及炎性介质的释放,可减轻其介导的细胞及氧化应激损伤进而减少脓毒症时肺损伤[ 14-18]。本研究结果发现,与内毒素休克组相比,补液组的肺组织病理评分、IL-1β和IL-6等炎性介质指标、氧化指标MPO及肺凋亡指数均明显降低。在补液组中,相较于快速及慢速补液组,中速补液组其肺组织病理评分、IL-1β、IL-6、MPO阳性细胞数及肺凋亡指数降低更明显。这一结果说明在脓毒症发生时,早期的液体复苏治疗可减轻脓毒症时的炎症反应,减少作用于肺组织的炎性介质的释放,降低肺组织氧化应激反应。复苏策略对其损伤程度也有所不同,相较于快速及慢速补液,以30ml/kg/h的中等速率进行液体复苏减轻肺损伤的效果更加显著,而这与感染性休克指南所提出的3h内输注至少30ml/kg晶体液建议相比速率会更快(1h完成),提示指南的早期复苏速率的设定可能存在提升的空间。
综上所述,早期的液体复苏治疗确实有助于减轻内毒素休克猪的早期肺损伤,这一作用可能是与早期及时逆转机体低灌注状态,减轻炎性介质的释放,减少炎性细胞及其氧化应激作用对肺泡细胞及血管内皮细胞损伤有关,同时不同的初始复苏速率减轻肺损伤的程度也有所不同,以30ml/kg/h的中等速率进行液体复苏效果最佳。
◀
