正负电荷改性乙肝病毒样颗粒的构建及性能评价
2020-04-27张 麟,陈 衡
张 麟,陈 衡
正负电荷改性乙肝病毒样颗粒的构建及性能评价
张 麟,陈 衡
(天津大学化工学院,天津 300072)
乙肝病毒核心蛋白(hepatitis B virus core protein,HBc)可在体外自组装成二十面体的病毒样颗粒(virus-like particles,VLPs),但是其较低的自组装效率及稳定性制约其应用.通过蛋白质改造修饰,在野生型HBc(wtHBc)的免疫显性区(major immunodominant region,MIR)分别插入带电多肽序列RRRRRRRR和DDDDDDDD,以通过荷电基团及静电相互作用的引入提高VLPs稳定性.经大肠杆菌重组表达,成功获得携带额外电荷的HBc突变体(mHBc),包括携带额外正电荷的m+HBc和负电荷的m-HBc.结果表明,mHBc的二级结构富含α-螺旋,与wtHBc一致.m+HBc和m-HBc等比例混合可在体外实现自组装,所得mHBc VLPs粒径为(30.44±2.23)nm,与野生型一致.该自组装过程及组装体稳定性受离子强度和pH值影响.使用尺寸排阻色谱、原子力显微镜、动态光散射等方法表征和分析VLPs在不同缓冲液中的稳定性差异.发现wtHBc VLPs可稳定存在于0.3~0.7mol/L NaCl溶液中,盐浓度过高或过低均会使其稳定性降低.pH响应性实验表明,wtHBc VLPs的最佳组装及稳定pH值为7.4,偏离此pH值使其稳定性降低.在低于pH=5.5的环境下,其相对稳定性明显降低,只达到pH=7.4的64.2%.而mHBc VLPs的稳定性差异随pH值变化不大,在pH测试范围5.5~9.5的相对稳定性均高于88.3%.以上研究结果表明,正、负电荷基团的引入可提高HBc VLPs对pH值变化的耐受性,拓宽稳定pH值区间,增强VLPs的稳定性,利于其实际应用.
乙肝病毒核心蛋白;电荷;病毒样颗粒;纳米结构;蛋白质修饰
乙型肝炎病毒(HBV)是一种DNA病毒,属于嗜肝DNA病毒科,具有部分双链和环状DNA基因 组[1].HBV有3种结构蛋白,分别为乙型肝炎病毒核心抗原(HBcAg)、乙型肝炎病毒表面抗原(HBsAg)和乙型肝炎病毒E抗原(HBeAg)[2].HBc是HBV的核衣壳蛋白,具有183个氨基酸残基(aa),相对分子质量为21000[3].Yu等[4]通过对野生型HBc(aa 1~183)序列的研究,发现其序列主要可分为两部分:N-末端自组装域(SA,aa 1~150)和C-末端聚精氨酸域(CTD,aa 151~183).SA主要执行自组装功能,且其二级结构主要由α螺旋构成.CTD是一段无规则序列,对HBc的组装无影响[5-6].180个或240个HBc单体可在体外分别自组装为=3或=4两种形式的二十面体对称VLPs,粒径分别为30nm、34nm[7].Ceres等[8]已证明HBc VLPs的组装是HBc疏水结构域包埋的过程.在体外组装过程中,HBc单体之间的疏水相互作用可以通过控制盐浓度来调节.此外,钠盐已被视为HBc VLPs组装的优异诱导剂[9-10].HBs是具有226个aa的糖基化蛋白质,在内质网上合成,可在腔膜上形成22nm的VLPs[11].目前,研究人员已经从常见的表达系统中合成并分离出HBV VLPs[12].Lu等[13]使用无细胞表达系统成功合成并分离出HBc VLPs.由于表达产物对大肠杆菌的毒性,几乎不用大肠杆菌表达系统表达HBs VLPs.
HBc VLPs已在疫苗研制[14]、疾病诊断[15]、药物输送[16]和材料科学[17]等方面广泛应用.例如,VLPs疫苗可有效地预防HBV感染,且其安全性已获得证明[18].此外,由于具有良好的生物相容性和均一结构,HBc VLPs也可作为一种理想的纳米级载体[19].然而,以液相形式存在的HBc VLPs在改性、装配、储存和转移过程中出现的低组装性和低稳定性限制其应用[20].Schumacher等[21]通过在截断的HBc(aa 1~150)的C-末端引入不同长度的聚组氨酸多肽,成功提高HBc VLPs对物理和化学应力的耐受性.Lu等[13]研究在HBc单体和二聚体之间引入额外二硫键对HBc VLPs整体结构稳定性的影响,发现成功组装的HBc VLPs具有紧密的二硫键网络,其组装和稳定性明显提升,并且可以抵抗某些还原环境,如低于10mmol/L的谷胱甘肽(GSH).Newman等[22]通过对HBc富含精氨酸的C末端进行不同程度的截断,建立体外解组装和再组装系统,研究“电荷平衡假 说”[23]对HBV衣壳稳定性的影响.结果发现,聚阴离子有助于减少由富含精氨酸的CTD域在近距离接触时产生的亚基间电荷排斥,从而加强HBV衣壳的组装和完整性.
因此,本文拟通过电荷引入调控HBc自组装性能.在HBc的MIR区域中的Pro79和Ala80之间分别插入带电多肽RRRRRRRR和DDDDDDDD,构建两种突变型HBc(mHBc),包括m+HBc和m-HBc,以在m+HBc单体和m-HBc单体间引入额外静电相互作用促进其稳定.进而,通过圆二色性光谱(CD)、尺寸排阻色谱(SEC)、原子力显微镜(AFM)和动态光散射(DLS)等系统分析HBc的结构、组装性能和稳定性.
1 材料和方法
1.1 实验材料
编码亚型adyw(1)人类乙型肝炎核心抗原的基因序列来自于UniProt(登录号:P03147),并在C-末端149位氨基酸进行截断(wtHBc(aa 1~149),以下简称wtHBc).含有wtHBc、m+HBc和m-HBc(以下总称HBc)的表达质粒pET-28a(+)-wtHBc、pET-28a(+)-m+HBc和pET-28a(+)-m-HBc由生工生物工程(上海)股份有限公司构建并转入大肠杆菌BL21(DE3)中表达.1mL HisTrapTMHP亲和色谱柱购自于北京中原公司.Sepharose 6Fast Flow、Sephadex G-25介质以及蓝色葡聚糖2000均购自于GE Healthcare(Uppsala,Sweden).微生物培养所用的胰蛋白胨、酵母提取物为英国Oxoid公司产品.蛋白质分子标准Blue Plus Protein Maker(14000~100000)、限制酶Sal I和Sac I购于北京全式金生物技术有限公司.Trans2K Plus Ⅱ DNA marker购自于鼎国生物科技有限公司(天津).其他化学试剂除特殊说明外均为分析纯.
1.2 HBc VLPs的构建
mHBc的设计机理如图1所示.其中,带电多肽RRRRRRRR或DDDDDDDD按图1(a)所示方式插入至wtHBc序列中,获得m+HBc及m-HBc突变体.m+HBc与m-HBc通过α-螺旋束之间的相互作用形成mHBc二聚体.进而120个mHBc二聚体组装形成mHBc VLPs,且带电基团分布于其外表面(见图1(b)).

图1 HBc VLPs设计机理示意
1.3 目的基因的双酶切验证
将从生工生物工程(上海)股份有限公司购得的3种重组质粒使用限制酶Sal I和Sac I按照标准操作手册进行双酶切,37℃反应1h.酶切产物使用1.2%的琼脂糖凝胶电泳检测.
1.4 HBc的培养
HBc由大肠杆菌BL21(DE3)表达.首先,将接种有靶标大肠杆菌的LB固体培养基于37℃过夜培养.接着挑取单菌落接种于25mL LB液体培养基中,并在恒温振荡培养箱中温育12h(170r/min,37℃).然后以1∶1000的体积比转移至LB扩大培养基,37℃温育5h后,加入1mmol/L异丙基-β-d-硫代半乳糖苷(IPTG)诱导10h.最后,于4500r/min、4℃离心30min收集菌体.收集的菌体使用平衡缓冲液(10mmol/L Tris-HCl,pH=7.4,0.5mol/L NaCl,40mmol/L咪唑)重悬,于冰浴中超声破碎.细胞破碎液于12000r/min、4℃离心20min,收集上清液.上述所有培养基均含有50μg/mL卡那霉素.
1.5 HBc的纯化
通过镍离子亲和色谱和尺寸排阻色谱纯化HBc VLPs.色谱操作均于ÄKTA Start(GE Healthcare,Uppsala,Sweden)仪器上进行,检测波长为280nm.使用1mL HisTrapTMHP亲和色谱柱,洗脱缓冲液(10mmol/L Tris-HCl,pH=7.4,0.5mol/L NaCl,500mmol/L咪唑)选择性纯化HBc VLPs.向纯化获得的mHBc样品中加入终浓度为10mmol/L的二硫苏糖醇(DTT),打开二硫键.使用填充有Sephadex G-25介质的XK 16/26色谱柱,运行缓冲液Ⅰ(10mmol/L Tris-HCl,pH=7.4,0.5mol/L NaCl)和运行缓冲液Ⅱ(10mmol/L Tris-HCl,pH=7.4,0.5mol/L NaCl,2mmol/L DTT)分别除去纯化后wtHBc和mHBc样品中的咪唑.
1.6 HBc VLPs的组装与纯化
将除咪唑后的m+HBc与m-HBc等摩尔比混合,与wtHBc样品分别加入14000的透析袋中,于运行缓冲液Ⅰ中透析(4℃),每8h置换一次缓冲液,共透析24h.之后将透析反应物加载到装有Sepharose 6Fast Flow介质的SEC凝胶柱上,使用运行缓冲液Ⅰ洗脱并收集VLPs样品.最后将收集到的VLPs样品使用3000截留分子量的再生纤维素膜超滤浓缩,4℃保存备用.
1.7 SDS-PAGE检测
使用还原性SDS-PAGE分析目的蛋白质.将纯化得到的蛋白样品与2×SDS loading buffer (100mmol/L Tris,pH=6.8,4%SDS,20%甘油,0.2%溴酚蓝,100mmol/L DTT)以相同比例混合后煮沸5~10min,然后于12000r/min离心1~2min.吸取上清液点样到5%浓缩胶的点样孔中,运行电流为10mA.当loading buffer刚好移动至12%分离胶边缘时,将电流调为25mA.当loading buffer移动到合适位置时终止电泳操作.电泳胶经染色和脱色处理后,使用分子成像仪(Vilber Lourmat,UK)拍摄照片.上述所有操作均按照操作手册进行.Blue Plus Protein Marker用于蛋白质相对分子质量的标定.
1.8 圆二色性光谱分析
使用JASCO J-180圆二色性光谱分析HBc的二级结构.使用填充有Sephadex G-25介质的XK 16/26色谱柱将3种蛋白样品置换到20mmol/L PB(pH=7.0)缓冲液中,并配制为相同的质量浓度(0.07mg/mL). CD光谱在25℃以50nm/min的速度连续扫描,扫描波长范围为250~190nm.测试中每种样品重复3次,样品缓冲液作为参照扣除背景干扰.
1.9 尺寸排阻色谱
使用填充有Sepharose 6Fast Flow介质的SEC色谱柱表征HBc VLPs,蓝色葡聚糖2000用于分子质量标定.其步骤如下:使用透析法将VLPs样品配制在运行缓冲液Ⅰ中,并加载到色谱柱上.样品加载后,使用运行缓冲液Ⅰ洗脱VLPs.对于纯化的VLPs在不同盐浓度及pH值缓冲液中稳定性差异的表征,VLPs最初在运行缓冲液Ⅰ中配制,加载到色谱柱上后,使用不同的缓冲液作为流动相,洗脱HBc VLPs.
1.10 动态光散射
使用纳米粒度电位分析仪Zetasizer Nano ZS检测在第1.5节中获得的HBc VLPs的粒径.收集系统软件ZetaSizer测出的强度和粒径参数,用origin软件做图并分析数据.
1.11 原子力显微镜
VLPs样品形貌经原子力显微镜(本元纳米仪器有限公司,北京)分析.采用轻敲模式和探头S1145.于室温下将样品滴加覆盖在光滑的云母片表面,使其被动吸附,然后用去离子水缓慢冲洗.采集样品的AFM图像,并使用Imager图像软件进行定量统计评价.
2 结果与讨论
2.1 目的基因的双酶切验证
双酶切结果显示,HBc在400~500bp之间有较为清晰的条带,且在5000~6000bp之间有明亮条带(见图2).因为本文使用的是149位截断的wtHBc,加上由于酶切位点以及带电氨基酸基团的引入带来的碱基增加,wtHBc和mHBc的理论大小分别为460bp和480bp.pET-28a(+)质粒大小为5369bp.因此,上述条带表明3种重组质粒均已成功构建.

1—pET-28a(+)-m-HBc;2—pET-28a(+)-m+HBc;3—pET-28a(+)-wtHBc
2.2 HBc VLPs的表达纯化
2.2.1 亲和色谱纯化
HBc经Ni2+亲和色谱纯化,洗脱峰规整(见图3),表明HBc成功表达纯化.图中紫外吸收值上升,达到平台,表明吸附达到平衡.样品吸附完毕后,用平衡缓冲液冲洗,使紫外吸收值降至基线,表明此时亲和色谱柱中,除吸附的样品外,其他杂蛋白已经全部冲洗干净.通入洗脱液,洗脱吸附于色谱柱的蛋白样品,出现洗脱峰.图中洗脱峰位置的偏移是进样量不同导致,对洗脱峰及其表示的纯化结果无影响.与wtHBc相比,随着进样体积的增加,m-HBc的洗脱峰面积同样增加.m+HBc的洗脱峰面积略小于wtHBc的洗脱峰面积,表明由于聚精氨酸多肽的引入,m+HBc得率降低.可能原因是,聚精氨酸多肽的引入使得m+HBc的等电点增大(pI=8.56),接近操作使用的Tris-HCl缓冲液的pH值,故m+HBc易在细胞破碎(冰浴)操作中形成包涵体,从而使得纯化上清液中m+HBc含量降低.

图3 HBc的亲和色谱纯化图谱
2.2.2 尺寸排阻色谱纯化
使用填充Sephadex G-25介质的XK 16/26色谱柱除去HBc样品中的咪唑,结果如图4所示.HBc样品出峰于10~16mL,先于咪唑(30~40mL).且由于咪唑的相对分子质量接近盐离子的相对分子质量,咪唑峰的位置与电导峰(20~30mL)的位置更为接近.表明HBc样品与咪唑成功分离.此外,mHBc样品的咪唑峰明显,这是由于加入到mHBc纯化之后样品中的DTT所致.DTT的加入有助于打开m+HBc二聚体和m-HBc二聚体的二硫键,从而促成mHBc二聚体(由一分子m+HBc与一分子m-HBc组成)的正确形成.由于wtHBc二聚体是由两分子同源wtHBc单体组成,二硫键的存在对于wtHBc没有影响,因此无需加入DTT.
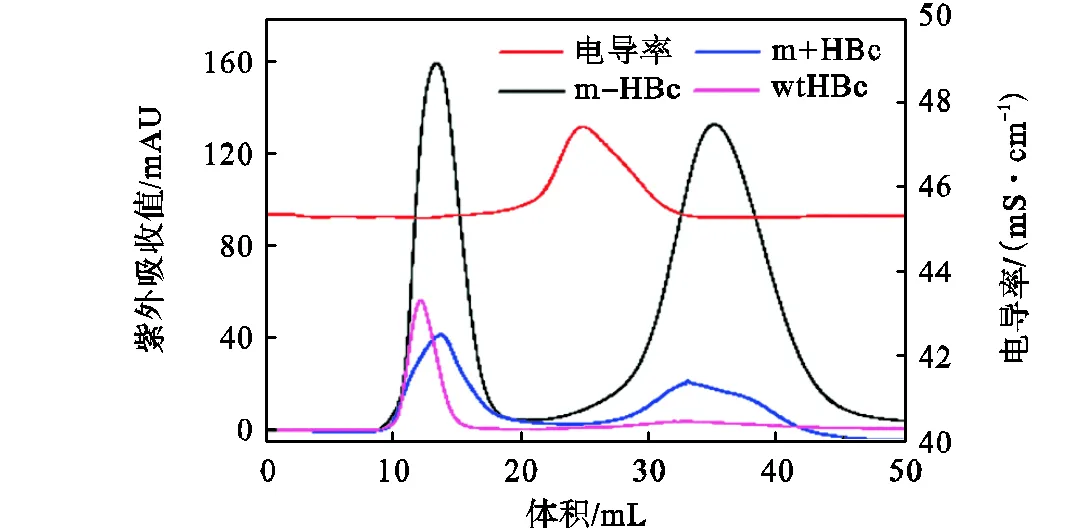
图4 HBc除去咪唑的纯化图谱
2.3 HBc VLPs的表征
2.3.1 还原性SDS-PAGE
全长HBc(aa 1~183)相对分子质量为21000.质粒pET-28a(+)进行重组表达时额外引入His标签、T7Tag标签以及酶切位点等碱基序列,所以获得 wtHBc、m+HBc和m-HBc的理论相对分子质量分别为20800、22100和21800.纯化后HBc样品的还原性SDS-PAGE检测结果如图5所示.在破碎全菌液、破碎上清液以及纯化样品的电泳条带中均可见位于14000~25000的目的HBc条带.纯化之后HBc样品的杂条带明显减少,表明亲和色谱纯化效果较好,HBc纯度较高.此外,通过比较破碎全菌液和破碎上清液的HBc条带,发现上清液中wtHBc的含量略低于全菌液,表明本文使用pET-28a(+)质粒表达HBc时,可同时表达出可溶性HBc以及包涵体.

1—wtHBc细胞破碎液;2—wtHBc细胞上清液;3—纯化后的wtHBc;m+—m+HBc;m-—m-HBc
2.3.2 HBc二级结构分析
利用圆二色性光谱分析带电多肽的插入对HBc二级结构的影响,如图6所示.wtHBc的圆二色性图谱在209nm和222nm处有属于-螺旋的特征负峰,与文献[2]报道的晶体衍射结构一致.mHBc与wtHBc具有相同的-螺旋特征负峰.根据CD图谱,利用Beta Structure Selection方法(http://bestsel. elte.hu/)计算HBc二级结构的含量.得出wtHBc、 m+HBc和m-HBc中a-螺旋的质量分数分别为9.3%、23.1%和9.0%,β-折叠的质量分数分别为33.9%、31.0%和35.2%.可见突变后螺旋含量有所变化,但β-折叠并无明显影响.且突变结构依然富含螺旋结构,而由于HBc VLPs的组装主要受HBc单体间α-螺旋相互作用影响[2],因此突变后从二级结构分析不会削弱其自组装性能.

图6 HBc突变体的圆二色性光谱
2.3.3 HBc VLPs纯化表征
通过透析组装法,使用截留分子量14000的透析袋于4℃自组装获得HBc VLPs,并通过尺寸排阻色谱表征自组装效果,如图7所示.本文构建的由120个wtHBc二聚体或mHBc二聚体组装而成的=4形式的HBc VLPs相对分子质量约为5×106.采用的Sepharose 6Fast Flow的排阻极限为4×106的球形蛋白分子或2×106的葡聚糖分子.因而,使用Sepharose 6Fast Flow介质分离HBc VLPs时,VLPs样品与蓝色葡聚糖2000在排阻极限位置有着相同的紫外吸收峰.图7显示,使用蓝色葡聚糖2000测得Sepharose 6Fast Flow的排阻极限出峰位置为11~15mL,DTT的出峰位置为25~35mL.wtHBc及mHBc样品具有11~15mL的VLPs紫外吸收峰以及25~35mL的DTT紫外吸收峰,表明wtHBc VLPs与mHBc VLPs均成功组装.此外,HBc样品在20~25mL处具有不存在于蓝色葡聚糖2000色谱曲线中的额外紫外吸收峰.并且,尽管本文保持蓝色葡聚糖2000与HBc样品浓度相同,HBc VLPs的紫外吸收峰均低于蓝色葡聚糖2000的紫外吸收峰,且mHBc VLPs的紫外吸收峰最低.造成此结果的原因可能是HBc在组装过程中除了形成目标VLPs,也会形成组装中间体.组装中间体的相对分子质量小于VLPs,出峰于VLPs之后;远大于DTT相对分子质量,出峰于DTT之前.故而20~25mL的紫外吸收峰为组装中间体的紫外吸收峰,且由于组装得不完全造成HBc VLPs的紫外吸收峰低于蓝色葡聚糖2000的紫外吸收峰.同时,带电多肽引入提供的静电吸收作用使得mHBc间的相互作用增强,该作用增强使中间体更易形成,表现为mHBc色谱曲线中中间体对应峰含量增大,而VLPs含量相应减小.因此后续还需要通过自组装动力学过程调控以优化该过程.

图7 HBc VLPs纯化分离图谱
2.3.4 尺寸表征
HBc VLPs的粒径分析如图8所示.wtHBc VLPs和mHBc VLPs的粒径分别为(30.44±2.23)nm和(30.19±1.85)nm.Lu等[13]的工作已经表明HBc(aa 1~149)可形成=4形式的VLPs,直径为30nm.C末端聚精氨酸序列的截断、MIR域的外源插入并不影响HBc的组装特性.本文合成的HBc VLPs同样为=4对称结构,并且插入的聚精氨酸基团以及聚天冬氨酸基团位于mHBc VLPs的外表面.因此,本文所示粒径与文献[13]结果符合,表明HBc VLPs构建成功.

图8 HBc VLPs的DLS粒径表征
2.4 HBc VLPs稳定性分析
2.4.1 HBc VLPs的盐浓度响应性
前述HBc VLPs的色谱表征结果中,发现HBc的组装效率不是很理想,分析其原因可能是受溶液盐浓度和pH值的影响.为了确定HBc VLPs组装的最佳盐浓度条件,进一步研究HBc VLPs在不同盐浓度缓冲液中的稳定性,如图9所示.随着盐浓度的增加,wtHBc VLPs(8~11mL)紫外吸收峰呈升高趋势,直到1.0mol/L NaCl时其紫外吸收峰开始降低.表明在一定范围(0.1~0.7mol/L)内,盐浓度的增加可以提高wtHBc VLPs的组装性能.在低NaCl浓度(0.1~0.3mol/L)时,Na+增强wtHBc VLPs组装性能和稳定性的作用明显,表明Na+促进HBc VLPs组装,与文献[8]报道一致.Na+发挥作用的机理可能为HBc VLPs的组装是疏水结构域包埋的过程,Na+通过在水溶液中调控HBc的疏水性,从而调控HBc VLPs的组装与聚集.低浓度的NaCl可促进HBc正确组装,而浓度过高可能会破坏掉HBc VLPs原本的疏水平衡,从而造成HBc VLPs聚集.
2.4.2 HBc VLPs的pH响应性
为了探究正、负电荷基团的插入对HBc VLPs在不同pH值缓冲液中的组装及稳定性的影响,使用凝胶过滤色谱,通过280nm处的紫外吸收光谱,分别检测wtHBc VLPs和mHBc VLPs的pH响应性,结果如图10所示.在pH值5.5~9.5的范围内,均可观测到wtHBc VLPs(8~10mL)的紫外吸收峰以及中间体紫外吸收峰(13~22mL)(见图10(a)).此外,在中性pH值环境(pH=7.4),wtHBc VLPs的紫外吸收峰最高,表明组装效率及稳定性最好.当pH值偏离7.4时,wtHBc VLPs自组装效率及稳定性降低.其中,VLPs的紫外吸收峰在pH=5.5时最低,表明此pH值环境不利于wtHBc VLPs的组装和稳定.造成此现象的原因可能是,pH值的偏离使得wtHBc单体之间的静电排斥作用力减弱,导致其稳定性降低.在图10(b)中,mHBc VLPs样品在不同pH值的紫外吸收曲线呈现出相同的趋势与紫外吸收峰位置,3个紫外吸收峰依次为:mHBc VLPs峰(7~10mL)、中间体峰(12~18mL)、DTT峰(18~24mL).其中,VLPs峰略低于中间体峰,与VLPs纯化表征实验结果吻合,表明静电相互作用的引入对单体间相互作用的扰动导致其中间体含量增加而使mVLP组装体含量降低.然而,VLPs峰在pH值5.5~9.5范围内对应的峰高与面积的差异不大,表明额外正、负电荷基团的引入可提高HBc VLPs对pH值变化的耐受性,拓宽其稳定pH区间.分析其原因可能是,MIR中正、负电荷基团的静电吸引作用使得VLPs中相邻HBc单体之间的相互作用力增强,并在VLPs的外表面形成一层致密的静电相互作用网络,从而加强VLPs的稳定.
2.4.3 形貌分析
在pH响应性实验结果中,发现pH值对wtHBc VLPs稳定性影响的差异较大,为了阐明pH值变化对其作用关系,进一步比较其在不同pH值环境中的组装和稳定性差异.利用AFM分析其在pH=7.4和pH=6.5时的颗粒形貌及尺寸特征,结果分别如图11和图12所示.在两种pH值条件下,VLPs吸附于云母片表面,并发生横向上的聚集.竖直方向上颗粒表面平滑,呈现出尖笋状的凸起形态.此外,由于横向聚集程度的不同,视野中的白色斑点大小不一.颗粒尺度分析结果显示,wtHBc VLPs在pH=6.5和pH=7.4时的粒径分布分别在20~40nm和15~35nm之间.pH=6.5时,wtHBc VLPs的粒径主要在20~30nm之间,部分颗粒的粒径增大至40nm.而wtHBc在pH=7.5时有颗粒粒径分布于30~35nm,与文献[13]报道粒径值一致.因而,pH=7.4较pH=6.5有利于wtHBc VLPs组装和稳定.

图11 pH=6.5时wtHBc VLPs的AFM形貌和粒径表征

图12 pH=7.4时wtHBc VLPs的AFM形貌和粒径表征
2.4.4 不同pH值下wtHBc VLPs的粒径分析
为了进一步验证pH值对wtHBc VLPs的影响作用,采用DLS分析其在pH为7.4和6.5时的粒径,结果如图13所示.在pH为7.4和6.5时,wtHBc VLPs的粒径峰值分别为32.80nm和43.82nm,前者更加接近于文献[17]报道的HBc VLPs正确组装的理论粒径.在pH=6.5时,wtHBc VLPs的粒径略微偏大,在300nm左右也有出峰.造成此现象的原因可能是,wtHBc的理论等电点为5.95,在pH=6.5时所携带净负电荷少于pH=7.4时所携带净负电荷,维持静电平衡状态的静电排斥作用力减弱,从而更容易形成大粒径聚集体.因此,pH值通过影响wtHBc单体间的静电排斥作用而影响其组装状态.wtHBc在 pH=7.4时,所携带净电荷量有益于维持wtHBc VLPs静电相互作用,偏离此pH值使其静电排斥作用减弱,所以在pH=7.4的水溶液中稳定性最好.

图13 不同pH值下wtHBc VLPs的DLS粒径表征
2.4.5 HBc VLPs组装稳定差异性的定量分析
根据HBc VLPs的pH响应性色谱实验的原始数据,算出体积变化值(Δ)与紫外吸收(UV280)变化值(Δ),并求出Δ/Δ.以Δ/Δ的变化为依据,算出Δ/Δ开始变化至第2次为0时的ΣΔ·Δ(对应HBc VLPs色谱峰积分面积).以HBc VLPs色谱峰积分面积定量代表其稳定性,并以HBc VLPs在pH=7.4时的稳定性为1,分别计算出其在其他pH值下的积分面积与pH=7.4时积分面积的比值,将此比值作为相对稳定性的量值.以pH值为横坐标、相对稳定性为纵坐标做图,得到图14所示的HBc VLPs稳定性随pH值变化.从图中可以看出,wtHBc VLPs的稳定性随着pH=(5.5~9.5)的升高总体呈现先增强后减弱的趋势.其中pH=8.5时的数据偏小,其原因可能是wtHBc VLPs在pH=8.5时的色谱峰与中间体峰的分离程度不及其他pH值时的分离程度,使其在计算积分面积时的有效数据减少,所得实际积分面积小于理论积分面积,从而导致计算出的VLPs相对稳定性偏低,在图中即表现为wtHBc VLPs在pH=8.5时出现异常点.而wtHBc VLPs在pH=7.4时稳定性最佳,而pH=5.5时稳定性最弱,仅为pH=7.4时的64.2%,体现了wtHBc VLPs的pH响应性.而mHBc VLPs稳定性随pH值变化的曲线相对平滑,在所有测试pH值下的相对稳定性均在88.3%以上,且其在pH=5.5时的相对稳定性高出wtHBc VLPs在pH=5.5时相对稳定性的24.1%.此结果表明mHBc VLPs对pH值变化的耐受性增强,稳定性相对于wtHBc VLPs明显提高.

图14 HBc VLPs稳定性随pH值变化
3 结 语
本文通过带电多肽引入改造HBc VLPs,以提高其稳定性,获得pH响应型VLPs.通过在wtHBc的Pro79和Ala80之间分别插入带电多肽RRRRRRRR和DDDDDDDD,成功构建正电荷突变的m+HBc和负电荷突变的m-HBc.突变体m+HBc和m-HBc的二级结构富含a-螺旋,与wHBc一致.wtHBc和mHBc均可在体外实现自组装,且组装过程及组装体稳定性受离子强度和pH值影响.正、负电荷基团的引入,可调节蛋白组装基元的荷电性质,使mVLPs对pH值变化的耐受性增强,稳定性提高.本研究设计将有助于VLPs在纳米结构材料及载体方向的研究应用.
[1] Rolland D,Gauthier M,Dugua J M,et al. Purification of recombinant HBc antigen expressed in escherichia coli and pichia pastoris:Comparison of size-exclusion chromatography and ultracentrifugation[J]. J Chromatogr B Biomed Sci Appl,2001,753(1):51-65.
[2] Roose K,De Baets S,Schepens B,et al. Hepatitis B core-based virus-like particles to present heterologous epitopes[J]. Expert Rev Vaccines,2013,12(2):183-198.
[3] Mohamed Suffian I F B,Wang J T,Hodgins N O,et al. Engineering hepatitis B virus core particles for targeting HER2 receptors in vitro and in vivo[J]. Biomate-rials,2017,120:126-138.
[4] Yu X,Jin L,Jih J,et al. 3.5Å cryoEM structure of hepatitis B virus core assembled from full-length core protein[J]. PLoS One,2013,8(9):e69729-1-e69729-11.
[5] Strods A,Ose V,Bogans J,et al. Preparation by alkaline treatment and detailed characterisation of empty hepatitis B virus core particles for vaccine and gene therapy applications[J]. Scientific Reports,2015,5(1):11639-1-11639-16.
[6] Sominskaya I,Skrastina D,Petrovskis I,et al. A VLP library of C-terminally truncated hepatitis B core proteins:Correlation of RNA encapsidation with a Th1/Th2 switch in the immune responses of mice[J]. Plos One,2013,8(9):e75938.
[7] Wynne S A,Crowther R A,Leslie A G W. The crystal structure of the human hepatitis B virus capsid [J]. Molecular Cell,1999,3(6):771-780.
[8] Ceres P,Zlotnick A. Weak protein-protein interactions are sufficient to drive assembly of hepatitis B virus capsids[J]. Biochemistry,2002,41(39):11525-11531.
[9] Stray S J,Ceres P,Zlotnick A. Zinc ions trigger conformational change and oligomerization of hepatitis B virus capsid protein[J]. Biochemistry,2004,43(31):9989-9998.
[10] Zlotnick A,Johnson J M,Wingfield P W,et al. A theoretical model successfully identifies features of hepatitis B virus capsid assembly[J]. Biochemistry,1999,38(44):14644-14652.
[11] Zhao Q,Wang Y,Abraham D,et al. Real time monitoring of antigenicity development of HBsAg virus-like particles(VLPs)during heat-and redox-treatment[J]. Biochemical and Biophysical Research Communica-tions,2011,408(3):447-453.
[12] Zhang Y,Song S,Liu C,et al. Generation of chimeric HBc proteins with epitopes in E. coli:Formation of virus-like particles and a potent inducer of antigen-specific cytotoxic immune response and anti-tumor effect in vivo[J]. Cellular Immunology,2007,247(1):18-27.
[13] Lu Y,Chan W,Ko B Y,et al. Assessing sequence plasticity of a virus-like nanoparticle by evolution toward a versatile scaffold for vaccines and drug delivery[J]. Proceedings of the National Academy of Sciences,2015,112(40):12360-12365.
[14] Gillam F,Zhang J,Zhang C. Hepatitis B core antigen based novel vaccine against porcine epidemic diarrhea vi-
rus[J]. Journal of Virological Methods,2018,253:61-69.
[15] Mihailova M,Boos M,Petrovskis I,et al. Recombinant virus-like particles as a carrier of B- and t-cell epitopes of hepatitis C virus(HCV)[J]. Vaccine,2006,24(20):4369-4377.
[16] Skrastina D,Petrovskis I,Petraityte R,et al. Chimeric derivatives of hepatitis B virus core particles carrying major epitopes of the rubella virus E1 glycoprotein [J]. Clinical and Vaccine Immunology,2013,20(11):1719-1728.
[17] Ding X,Liu D,Booth G,et al. Virus-like particle engineering:From rational design to versatile applications [J]. Biotechnology Journal,2018,13(5):1700324.
[18] Shah S,Hayden C A,Fischer M E,et al. Biochemical and biophysical characterization of maize-derived HBsAg for the development of an oral vaccine[J]. Archives of Biochemistry and Biophysics,2015,588:41-49.
[19] Dhanasooraj D,Kumar R A,Mundayoor S. Vaccine delivery system for tuberculosis based on nano-sized hepatitis B virus core protein particles[J]. Int J Nanomedicine,2013,8:835-843.
[20] Qazi S,Schlicksup C J,Rittichier J,et al. An assembly-activating site in the hepatitis B virus capsid protein can also trigger disassembly[J]. ACS Chemical Biology,2018,13(8):2114-2120.
[21] Schumacher J,Bacic T,Staritzbichler R,et al. Enhanced stability of a chimeric hepatitis B core antigen Virus-like-particle(HBcAg-VLP)by a c-terminal linker-hexahistidine-peptide[J]. Journal of Nanobiotechnol-ogy,2018,16(1):39-1-39-21.
[22] Newman M,Chua P K,Tang F M,et al. Testing an electrostatic interaction hypothesis of hepatitis B virus capsid stability by using an in vitro capsid disassembly/reassembly system[J]. Journal of Virology,2009,83(20):10616-10626.
[23] Su P,Yang C,Chu T,et al. HBV maintains electrostatic homeostasis by modulating negative charges from phosphoserine and encapsidated nucleic acids[J]. Scientific Reports,2016,6(1):38959-1-38959-19.
Construction and Characteristics of Charge Modified-Hepatitis B Virus Core Protein Virus-Like Particles
Zhang Lin,Chen Heng
(School of Chemical Engineering and Technology,Tianjin University,Tianjin 300072,China)
The hepatitis B virus core protein (HBc) can self-assemble into icosahedral virus-like particles (VLPs). However, their application is limited by their low assembly efficiency and low stability. For this paper, charged polypeptides RRRRRRRR or DDDDDDDD were inserted into the major immunodominant region (MIR) of wild-type HBc (wtHBc) to improve VLPs stability through the electrostatic interactions formed by the charged groups. The mutants (mHBc) were then obtained by expression in recombinant, including one form with an extra positive charge (m+HBc) and one with a negative charge (m-HBc). An α-helix structure was observed in mHBc, which was consistent with wtHBc. Using the equimolecular mixtures of m+HBc and m-HBc, successful self-assembly into VLPs nanoparticles with a particle size of (30.44±2.23) nm was observed, which was consistent with wtHBc VLPs. Assembly process and stability were affected by ionic strength and pH values. The change in stability of the VLPs in different buffers was characterized by size exclusion chromatography, atomic force microscopy, and dynamic light scattering. It was found that the wtHBc VLPs could exist in solutions containing 0.3—0.7 mol/L NaCl. Reduced stability was observed once their ionic strength deviated from this range. Optimized assembly of wtHBc VLPs was obtained at pH=7.4. Deviation from this pH value caused a decrease of stability. Significant decrease of stability was observed when pH value fell below 5.5, which was only 64.2% of that at pH=7.4. For mHBc VLPs, no obvious difference in stability was observed at various pH values, and relative stability of more than 88.3% was observed at the tested pH range of 5.5—9.5. Thus, the improved tolerance of HBc VLPs to pH changes could be obtained by the introduction of extra electrostatic interactions through charged amino acid residues; and, thus, a broader stable pH range and enhanced stability of VLPs were achieved, which could be beneficial to its applications.
hepatitis B virus core protein(HBc);charge;virus-like particles(VLPs);nanostructure;protein modification
Supported by the National Natural Science Foundation of China(No. 21978205,No. 91534119),the National Key Research and Development Program of China(No. 2018YFA0900700),the Innovation Foundation of Tianjin University.
Q816
A
0493-2137(2020)05-0450-09
10.11784/tdxbz201904068
2019-04-25;
2019-07-17.
张 麟(1981— ),男,博士,教授.
张 麟,linzhang@tju.edu.cn.
国家自然科学基金资助项目(21978205,91534119);国家重点研发计划资助项目(2018YFA0900700);天津大学自主创新基金项目.
(责任编辑:田 军)
