胶红酵母CICC 33013胞外多糖抑制肝癌细胞活性研究
2020-04-13马文锦李梅林周彦兵张永显于长青班省华
马文锦 李梅林 王 博 周彦兵 彭 涛 张永显 于长青 班省华
(甘肃省轻工研究院有限责任公司,甘肃 兰州 730000)
胶红酵母是一种抗逆性较强的腐生酵母,含有包括7种人体必需氨基酸在内的16种常见的氨基酸,6种脂肪酸,以及丰富的类胡萝卜素、VE、核苷酸和虾青素等微量元素[1]。胞外多糖(exo-polysaccharide,EPS)是由微生物包括细菌、真菌、藻类释放到周围环境中促进细胞生长,抑制溶菌酶,储存营养和加强耐有毒重金属的一类多糖[2]。近年来,胶红酵母的研究主要集中在其类胡萝卜素[3-4]的富集培养条件和优良菌株的筛选[5-6]等方面。研究[7-8]发现,酵母菌胞外多糖(YEPS)具有潜在的抗氧化、抗凝血、抗血栓和抗病毒活性,可用于生产有机体免疫调节剂。目前,国内外对细菌胞外多糖和一些大型真菌胞外多糖的研究较多[9],而对酵母菌胞外多糖的菌株筛选、结构解析和功能活性研究较少[10],尤其胶红酵母胞外多糖的结构解析和功能活性尚未见报道。
课题组[11]前期通过醇沉,脱蛋白,透析等方法得到胶红酵母CICC 33013菌株代谢的胞外多糖(REPS),复溶后经DEAE-52纤维素层析和Sephadex G-100凝胶柱层析分离纯化,高效凝胶渗透色谱法色谱图显示胞外多糖组分REPS2-A是单一、对称峰,表明得到的胶红酵母胞外多糖组分REPS2-A是均相样品,根据葡聚糖标准,胞外多糖组分REPS2-A的平均分子量为7.125×106Da。并基于红外光谱、核磁共振和甲基化分析,确定了胶红酵母胞外多糖组分REPS2-A是高度分支的多糖,由(1→3)-连接的Gal为骨架组成,分支是由(1→2)-连接的Glc、(1→4)-连接的Man、(1→3)-连接的Glc、(1→4,6)-连接的Man和(1→2,3,4)-连接的Ara组成。有研究[12-13]表明,具有抗肿瘤活性的甘露聚糖多为(1→6)键型,活性半乳糖则以(1→3)糖苷键连接。试验拟从增殖、凋亡与周期等方面分析评价胞外多糖组分REPS2-A对肝癌细胞HepG2的抑制作用,为胶红酵母胞外多糖在食品与药品中的应用提供理论支持和技术依据。
1 材料与方法
1.1 材料与仪器
胶红酵母菌株(RhodotorulamucilaginosaCICC 33013):中国典型培养物保藏中心;
血癌细胞K562、胃癌细胞BGC823、SGC7901、MKN28、肝癌细胞HepG2、BEL7402、Hep3B、胰腺癌细胞HS66T、乳腺癌细胞SKBR3、宫颈癌细胞HeLa:兰州大学第一医院中心实验室;
RPMI 1640培养液:武汉凌飞科技有限公司;
胎牛血清:浙江天杭生物科技股份有限公司;
磷酸盐缓冲溶液、胰酶:天津科密欧化学试剂有限公司;
青霉素—链霉素溶液:国药集团化学试剂有限公司;
膜联蛋白V-异硫氰酸荧光素细胞凋亡检测试剂盒:广州威佳科技有限公司;
其他试剂:均为分析纯;
流式细胞仪:LDZX-30KBS型,上海申安医疗器械厂;
倒置显微镜:HH-4型,金坛市宏华仪器厂;
酶联免疫检测仪:DG5033A型,上海巴玖实业有限公司;
离心机:CT15RT型,上海天美生化仪器设备有限公司;
摇床振荡器:ZD-9550型,海门市其林贝尔仪器制造有限公司;
CO2培养箱:UV-1100型,上海美谱达仪器有限公司。
1.2 试验方法
1.2.1 癌细胞筛选 在倒置光学显微镜下观察各组癌细胞,选取生长良好的各癌细胞[14]。选出的细胞进行分类处理:① 悬浮类细胞直接移入无菌的离心管进行离心;② 贴壁类细胞移除原有的培养基,用PBS清洗2~3次,加入1~2 mL胰酶静止3~5 min,加入完全培养液终止消化,移入无菌的离心管,离心条件为1 000 r/min、5 min,移除上清液。
将对数生长期的血癌细胞K562、胃癌细胞BGC823、胃癌细胞SGC7901、胃癌细胞MKN28、肝癌细胞HepG2、BEL7402、Hep3B、胰腺癌细胞HS66T、乳腺癌细胞SKBR3、宫颈癌细胞HeLa接种在无菌的96孔板,接种浓度约为104个/mL,重复7次,并设置空白对照组,加入多糖(浓度为1.0 mg/mL),混合均匀放入CO2培养箱中培养24 h。吸去上清液,加入RPMI 1640培养液和MTT溶液,于37 ℃、5% CO2的条件下继续培养4 h。吸去上清液,分别加入DMSO,置于摇床上低速振荡10~15 min,使结晶物溶解完全。在波长为490 nm条件下对各孔的吸光值进行测定[15-16]。细胞增殖抑制率按式(1)计算:
(1)
式中:
R——细胞增殖抑制率,%;
Ap——试验组吸光值;
AC——空白组吸光值。
1.2.2 多糖药物对HepG2细胞作用浓度及时效性测定 经过筛选肝癌细胞HepG2为后续主要的研究对象。在96孔板内接种对数生长期的HepG2细胞,使每孔细胞数约为1.0×104个。多糖浓度分别为0.0,0.5,1.0,10.0 mg/mL,做6个重复并设置空白对照,并以人正常细胞株(L02)和Oxaliplatin处理HePG2分别为阴性和阳性对照组。加样完成后振荡均匀,于37 ℃、5% CO2的条件下培养24,48,72 h进行测定[17]。
1.2.3 HepG2细胞凋亡检测 多糖作用于HepG2细胞的浓度为1.0 mg/L,未添加多糖的细胞做为空白对照。放入37 ℃、5% CO2的培养箱中培养24,48,72 h形成3个试验组,每组各做3个平行。培养结束后移除培养液,加入PBS,细胞刮分散细胞,移入离心管离心(1 000 r/min,4 ℃,5 min),移除上清,收集细胞。吸取10 μL细胞沉淀悬于190 μL结合缓冲液,加入膜联蛋白V-异硫氰酸荧光素细胞凋亡显像剂,轻轻混匀,避光室温反应15 min,加入295 μL 结合缓冲液,在1 h内上机检测,上机前5 min加入5 μL PI(碘化丙啶)[18-19]。
1.2.4 细胞形态学观察 细胞制成单细胞悬液,细胞数约106个/mL,同时设不加HepG2细胞对照组和浓度为1.0 g/L的多糖作用24,48,72 h的试验组,培养结束后,在倒置显微镜下观察细胞形态。
1.2.5 细胞周期测定 将培养细胞制成单细胞悬液,细胞数约106个/mL,同时设细胞对照组和浓度为1.0 g/L的多糖作用24,48,72 h的试验组。用PBS清洗2次,匀浆细胞,用预冷的75%酒精(1~3 mL)固定,加入PI,置4 ℃避光染色30 min,400目尼龙网过滤后,将样品加入流式细胞仪,氩离子激发PI荧光,波长488 nm处测定。
1.3 数据统计分析
数据采用Sigmaplot 12.5进行统计分析,试验结果用(x±s)表示,3个平行试验,采用ANOVA进行Duncana多重比较分析(P<0.05)。
2 结果与分析
2.1 多糖组分REPS2-A对不同癌细胞的作用
采用MTT法研究多糖组分REPS2-A对10种常见癌细胞的抑制作用,效果如图1所示。结果表明,多糖组分REPS2-A对选取的10种癌细胞都有一定的抑制作用,癌细胞的种类不同,抑制效果亦不相同。其中血癌细胞K562、胃癌细胞BGC823、胃癌细胞SGC7901、胃癌细胞MKN28、肝癌细胞BEL-7402、肝癌细胞Hep3B、胰腺癌细胞HS66T、乳腺癌细胞SKBR3、宫颈癌细胞HeLa 9种癌细胞的抑制率均低于50%,说明多糖组分REPS2-A对这些细胞没有明显的抑制效果,可能是自发凋亡引发的结果。对肝癌细胞HepG2的抑制率明显的高于其他9种癌细胞,其抑制率为62%,高于50%,说明多糖组分REPS2-A对肝癌细胞HepG2的抑制具有特异性。因此后续试验选取肝癌细胞HepG2作为研究对象。

图1 多糖REPS2-A对不同癌细胞的抑制结果
2.2 多糖组分REPS2-A溶液的浓度及时效性分析
如图2所示,随着多糖组分REPS2-A溶液浓度的增加,其对肝癌细胞HepG2的抑制率逐渐升高,而随着作用时间的延长,多糖REPS2-A溶液对肝癌细胞HepG2的抑制率变化范围较小,说明在一定的时间(72 h)内,时间的变化对多糖REPS2-A溶液的作用效果影响不大。当浓度低于1.0 mg/mL时,多糖REPS2-A溶液对肝癌细胞HepG2的抑制率均低于50%,说明多糖组分REPS2-A溶液浓度低于1.0 mg/mL时的研究意义不大。浓度为1.0 mg/mL时,多糖组分REPS2-A溶液对肝癌细胞HepG2的抑制率均高于50%,对正常肝细胞L02的抑制率为31%,说明在该浓度下肝癌细胞HepG2得到了较好的抑制效果。当浓度为10.0 mg/mL时,抑制率接近100%,此时的多糖组分REPS2-A溶液的浓度太高影响了细胞的生长,因此,无实际研究意义。
以经典抗癌药物奥沙利铂作为阳性对照,给予铂类药物后,肝癌细胞HepG2的生长均受到明显抑制,细胞生长密度明显降低,活细胞数量明显减少。随着给药浓度增强和给药时间延长,铂类药物对肝癌细胞的抑制作用逐渐增强,以24~48 h的抑制作用最为明显。以药物作用48 h肝癌细胞株的IC50值显示:HepG2细胞株对铂类药物敏感。相比多糖作为抑制剂,10 mg/L多糖对肝癌细胞的抑制率与0.1 mg/L奥沙利铂药物的相当。
2.3 多糖组分REPS2-A对HepG2细胞凋亡的影响
由图3、4可知,未经多糖组分REPS2-A处理的HepG2细胞的自发凋亡率是0.40%;当多糖组分REPS2-A浓度为1 mg/mL作用24,48,72 h时,其细胞早期凋亡率分别为73.74%,36.00%,27.88%,凋亡率分别为77.70%,88.18%,97.08%。与对照组相比,多糖组分REPS2-A能促进肝癌HepG2细胞凋亡。
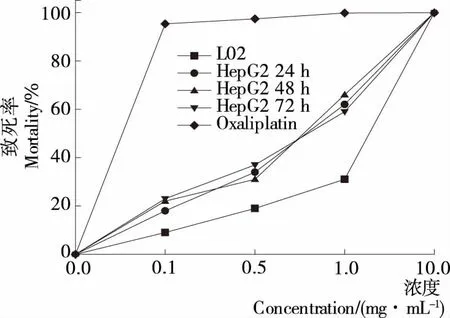
图2 REPS2-A溶液对肝癌细胞(HepG2)作用的浓度与时效性
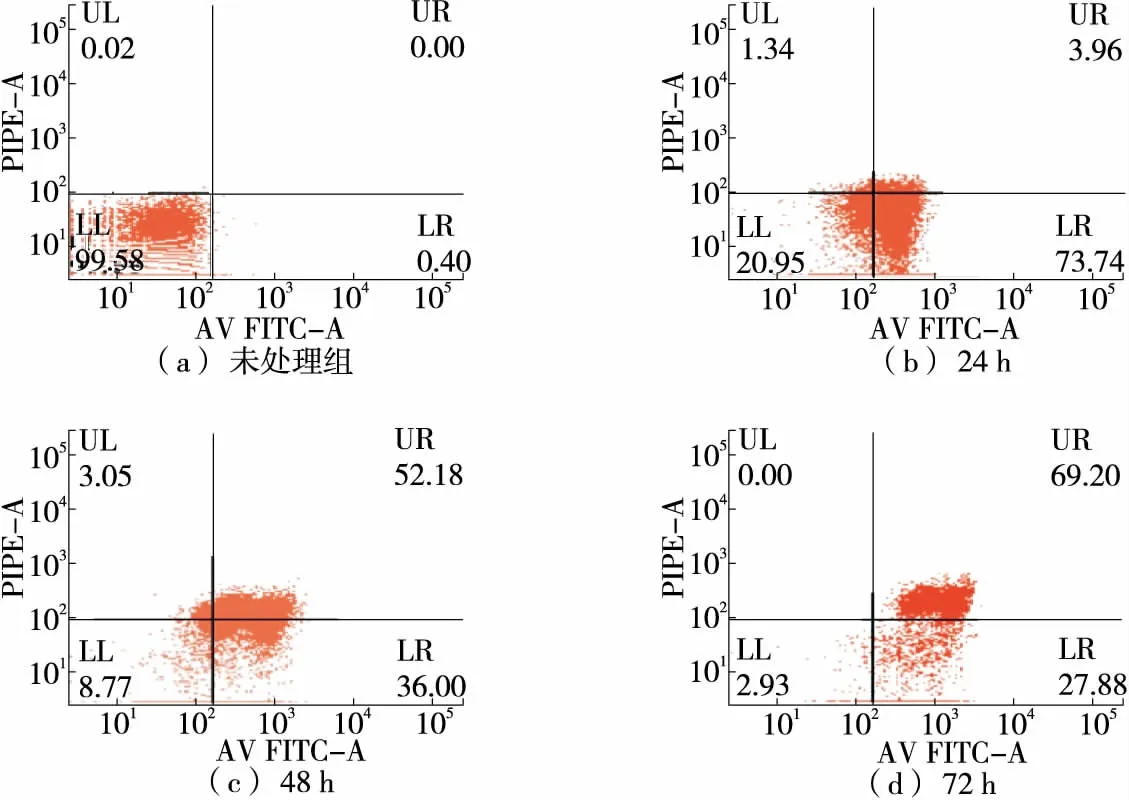
图3 REPS2-A浓度为1 mg/mL时不同时间HepG2细胞凋亡分析
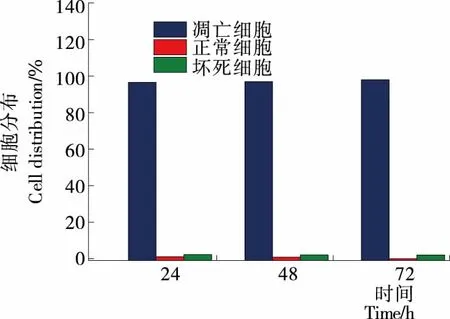
图4 REPS2-A浓度为1 mg/mL时不同时间(24,
Figure 4 The apoptosis rate of HepG2 cells at different time (24, 48 and 72 h) when the concentration of reps2-a was 1 mg/mL
2.4 多糖组分REPS2-A对HepG2细胞形态学的影响
由图5可以看出,HepG2细胞在REPS2-A作用下生长、繁殖受到明显的抑制,并且随着浓度的增加抑制效果有明显的增加。
2.5 多糖组分REPS2-A对HepG2细胞周期的影响
用流式细胞仪检测HepG2细胞在多糖组分REPS2-A浓度为0.0,0.1,0.5,1.0 mg/mL,作用24 h各试验组细胞周期的变化,结果如图6和表1所示。随着浓度的增加,G0~G1期细胞所占百分比升高,表明G1/S期发生阻滞。

图5 不同多糖REPS2-A浓度处理时HepG2
Figure 5 Morphological characteristics of HepG2 cells treated with different concentrations of polysaccharide REPS2-A
周期分析结果与细胞生长形态影响结果相一致,当REPS2-A浓度为0.0,0.1,0.5,1.0 mg/mL作用24 h后。多糖组分REPS2-A对HepG2细胞的生长有明显的抑制作用。
3 结论
试验以胶红酵母CICC 33013代谢的胞外多糖组分REPS2-A为研究对象,揭示胶红酵母胞外多糖在肝肿瘤细胞活性中的抑制作用,结果显示:当多糖组分REPS2-A浓度为1 mg/mL,作用时间分别为24,48,72 h时,肝癌细胞HepG2凋亡率分别为77.70%,88.18%,97.08%。采用流式细胞仪测定多糖对HepG2细胞作用周期,结果显示:多糖组分REPS2-A溶液使HepG2细胞在G1/S期发生阻滞。试验证实胶红酵母胞外多糖能有效抑制肝癌HepG2细胞的增殖,其机制之一是REPS2-A使HepG2细胞阻滞发生在G1/S期,并诱导HepG2细胞凋亡。

]Debris:细胞碎片,Aggregates:聚集体,Dip G1:G1期DNA的相对含量,Dip G2:G2期DNA的相对含量,Dip S:S期DNA的相对含量
图6 不同浓度的REPS2-A处理24 h的HepG2细胞的流式细胞仪分析图
Figure 6 Flow cytometry analysis of HepG2 cells treated with REPS2-A of various concentrations:0.0 (control), 0.1, 0.5, 1.0 mg/mL for 24 h
表1多糖REPS2-A不同浓度处理的HepG2细胞的周期分析表
Table1ThecellcyclesofHepG2treatedwithvariousconcentrationofREPS2-A

浓度/(mg·mL-1)细胞所占百分比/%G0~G1期S期G2~M期0.061.00 24.4614.540.168.9627.943.110.571.5628.090.351.075.0923.990.92
胶红酵母胞外多糖有可能成为治疗肝癌的天然产品或作为抗肿瘤药的辅助药物,但胶红酵母胞外多糖对于癌症的抑制通路机制、胶红酵母胞外多糖的毒性以及产糖相关的优异基因仍不清楚,需进一步深入研究。
