揉面过程中面团面筋蛋白结构的变化
2020-04-13周惠明朱科学郭晓娜
孟 莲 周惠明,2 朱科学 郭晓娜
(1. 江南大学食品学院,江苏 无锡 214122;2. 江苏省现代粮食流通与安全协同创新中心,江苏 南京 210000)
揉面是手擀面制作工艺中至关重要的环节之一,也是手擀面口感爽滑筋道,深受人们喜爱的原因之一。目前,国内外对面条工艺的研究主要集中于和面、熟化。杨玉玲等[1]研究了和面方式对面团流变学特性及面条品质的影响;Don等[2]发现面团中麦谷蛋白大聚体含量随熟化时间的延长而升高;陈洁等[3]研究了熟化温度,以期通过调整醒面温度获得不同用途的面团。而关于传统工艺中揉面这一环节的研究很少。Scepanovic等[4]通过Tanner多模损伤模型,模拟理想揉面机几何形状,数值化研究了面团揉捏过程的微观结构损伤及流动行为。该研究是从力学角度探索理想化的揉面条件,未涉及揉捏对面团这一黏弹体系产生的作用和贡献。邵丽芳等[5]研究发现,揉面可使冷冻熟面质构品质显著提升,手工揉面比机器揉面效果更为显著。但仍缺乏关于面团揉捏过程中面筋蛋白结构变化和交联机制的研究。
面筋形成过程主要是蛋白质分子通过氢键发生水合作用,蛋白质分子自身通过二硫键发生聚集[6]。由于水合作用,面筋蛋白产生一定的内聚性和黏附性[7]。通过SH-SS交换或在分子水平上发生非共价相互作用(氢键或疏水),诱导大分子聚集,并改变面筋的二级结构,使面团的物理和流变特性发生变化[8]。麦醇溶蛋白使面团具有黏性和延展性,而麦谷蛋白通过聚合物网络的形成在面团的弹性中起关键作用,故面团的麦醇溶蛋白与麦谷蛋白的比例(Gli/Glu)影响面团的形成[9]。此外,二硫键或疏水性相互作用可能会加速麦谷蛋白的聚集[10-11]。
试验拟对手工揉面过程中面团面筋蛋白的结构变化规律及交联作用进行深入研究,为面条的品质改良和传统工艺发展提供理论依据。
1 材料与方法
1.1 原料与试剂
小麦粉:金龙鱼麦芯粉,含水量14.43%,蛋白质含量9.95%,益海嘉里粮油有限公司;
十二烷基硫酸钠、尿素、乙二胺四乙酸、三羟甲基氨基甲烷、甘氨酸、异丙醇等:分析纯,国药集团化学试剂有限公司;
二硫苏糖醇、Ellman试剂、β-巯基乙醇:分析纯,美国Sigma公司;
乙腈:色谱纯,美国Sigma公司。
1.2 仪器与设备
和面机:JHMZ-200型,北京东孚久恒仪器技术有限公司;
生化培养箱:LRH-250型,上海一恒科学仪器有限公司;
物性分析仪:TA-XT plus型,英国SMS公司;
傅里叶变换红外光谱仪:NEXUS型,美国尼高力仪器公司;
高效液相色谱仪:LC-20AT型,日本岛津公司。
1.3 方法
1.3.1 面团的制备 称取200 g小麦粉,96 g去离子水与2 g盐于针式和面机中,混合5 min,分别揉面2,4,6,8,10,15 min后,放置于30 ℃,湿度80%的恒温箱中静置20 min,冷冻干燥,研磨成粉,过80目筛备用,每组试验至少重复3次。
1.3.2 面团质构特性的测定
(1) 硬度和弹性:用A/DP装置制备测试面团,采用P/1S型号探头,测试前、中、后速度分别为2,1,5 mm/s,形变35%,接触时间1 s,触发力5 g。
(2) 黏性:用A/DSC装置制备测试面团,采用P/25型号探头,测试前、中、后速度分别为0.5,0.5,10.0 mm/s,应力40 g,接触时间0.1 s,触发力5 g。
1.3.3 面团中游离巯基与二硫键含量的测定 根据Beveridge等[12-13]的方法稍作修改。将冷冻面团(0.4 g)分散于10.0 mL 0.2 mol/L Tris-Gly缓冲液(pH 8.0,含8 mol/L尿素,3 mmol/L EDTA,1% SDS)中,搅拌提取1 h。悬浮液13 600 r/min离心10 min,收集上清液。测定游离巯基时,在4 mL上清液中加入0.1 mL 10 mmol/L DTNB,室温反应20 min,412 nm处读取吸光度。测定总巯基时,将0.1 mLβ-巯基乙醇和4 mL 0.2 mol/L Tris-Gly缓冲液加入1 mL上层清液,室温下振荡混合1 h,加入10 mL 12%的三氯乙酸,再振荡混合1 h,5 000 r/min离心10 min,取上清,重复3次,收集最终沉淀物,于10 mL 0.2 mol/L Tris-Gly缓冲液中溶解,加入0.1 mL 10 mmol/L DTNB混合,测定吸光度。
标准曲线的制备:将L-半胱氨酸溶解在0.2 mol/L Tris-Gly缓冲液中,制备巯基标准溶液(0.00,0.02,0.03,0.04,0.05,0.06 μmol/mL)。将4 mLL-半胱氨酸溶液与0.1 mL 10 mmol/L DTNB溶液混合,测定溶液吸光度。建立巯基浓度与吸光度的关系标准曲线,按式(1)、(2)分别计算巯基、二硫键含量。
(1)
(2)
式中:
m——巯基含量,μmol/g;
C——冷冻面团浓度,g/mL;
S——巯基浓度,μmol/mL;
n——上层清液稀释系数。
m2——二硫键含量,μmol/g;
m1——总巯基含量,μmol/g;
m3——游离巯基含量,μmol/g。
1.3.4 面团蛋白质分子间作用力的测定 参考Gómez-Guillén等[14]的方法并修改,取A、B、C 3组样品各0.1 g,A样品加入5 mL 0.6 mol/L NaCl(SA)溶液,B样品加入5 mL 0.6 mol/L NaCl和1.5 mol/L尿素(SB)溶液,C样品加入5 mL 0.6 mol/L NaCl和8 mol/L尿素(SC)溶液,混合均匀。4 ℃静止1 h,3 000 r/min离心15 min,取上清液,采用考马斯亮蓝法测定上清液蛋白质含量。溶解在SB与SA溶液的蛋白含量差表示氢键;溶解在SC与SB溶液的蛋白质含量差表示疏水相互作用。
1.3.5 面团蛋白质二级结构的测定 参照Chompoorat等[15-16]的方法并加以修改,将样品与KBr按比例(1∶50,质量比)混合,研磨均匀,使用配套压片机制得透明薄片,进行全波长扫描(400~4 000 cm-1),扫描次数16,分辨率4 cm-1。利用Omnic和Peak Fit v4.12软件分析数据,进行二阶导数拟合,根据各结构对应的区间范围计算其所占百分比含量。
1.3.6 面团蛋白质交联程度的测定 参照Lagrain等[17]的方法并修改,准确称取一定量的面团冻干样品(含1.00 mg干基蛋白质),溶解于1.0 mL的样品缓冲液(含有2.0% SDS的0.05 mol/L,pH 6.8磷酸盐缓冲液)中,室温振荡30 min,8 000 r/min离心10 min,取上清液过0.45 μm滤膜备用。采用美国Biosep-SEC-S4000色谱柱(300 mm×7.8 mm,15~500 kDa),流动相为50%乙腈(含有0.05%的三氟乙酸),流速0.9 mL/min,柱温30 ℃,进样量60 μL,紫外检测波长214 nm。总面筋蛋白的提取用含有2.0 mol/L尿素和1.0%二硫苏糖醇的样品缓冲液溶解样品,其余操作步骤一致。
1.3.7 面团蛋白质亚基占比的测定 参考Bruneel等[18]的方法并稍作修改,准确称取含有50.00 mg干基蛋白质的面团冻干样品,先用含有0.4 mol/L氯化钠的1.5 mL磷酸盐缓冲液(0.05 mol/L,pH 7.6)提取两次,弃上清液,再用1.5 mL的去离子水提取一次,弃上清液;将沉淀物用1.5 mL 60%乙醇提取3次,室温离心(15 000 r/min)后收集上清液,即为麦醇溶蛋白的提取液;沉淀物用1.5 mL含有50%异丙醇,2.0 mol/L尿素,1.0%二硫苏糖醇的Tris-HCl 缓冲液(0.05 mol/L,pH 7.5)于60 ℃下提取3次,室温离心(15 000 r/min)后收集上清液,即为麦谷蛋白的提取液,过0.45 μm滤膜后备用。选用德国Nucleosil 300-5 C8色谱柱,流动相分别为含有0.1%的三氟乙酸的超纯水(A液)和含有0.1%的三氟乙酸的乙腈(B液),洗脱条件为二元高压梯度洗脱,洗脱液中B的浓度为24.0%~56.0%。流动相总流速1 mL/min,柱温50 ℃,进样量100 μL,紫外检测波长214 nm。参考Wieser等[19-20]的方法将各峰区分,并计算各亚基所对应洗脱曲线的峰面积。
1.3.8 数据统计与分析 采用SPSS 23.0在P<0.05检验水平上进行显著性分析,数据表示为(平均值±标准差);采用Origin 2016制图。
2 结果与分析
2.1 揉面过程中面团质构特性的变化
由图1可知,揉面可使面团硬度、弹性和黏性增加,当揉面时间为10~15 min时,硬度大幅增加,黏性和弹性发生轻微下降。这可能是由于揉面初期,在力的作用下,面团中蛋白质大分子相互缠结,形成部分应力,使得面团变得坚韧和致密;揉面后期因外力作用时间过长,在内部产生的应力经熟化静置后并未完全消去,存在残余应力使得面团吸水能力和弹性性能轻微下降。
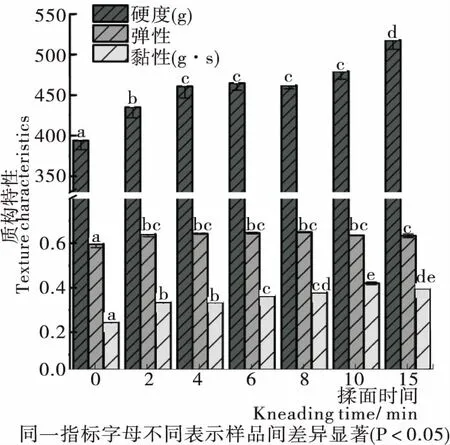
图1 揉面过程中面团质构特性的变化
Figure 1 Changes in dough texture characteristics during kneading
2.2 揉面过程中面团巯基与二硫键含量的变化
由表1可知,随着揉面时间的延长,巯基—二硫键互换增多,二硫键逐渐增加,表明此阶段,面筋蛋白内部发生了二硫键交联,且交联程度不断增强。当揉面时间为2 min时,游离巯基的减少率与二硫键的增长率分别为10.69%,4.48%,随后缓慢互为转换;当揉面时间为6~10 min时,二者转换速率几乎为零;当揉面时间为15 min时,互换速率增大,游离巯基的减少率与二硫键的增长率分别为17.19%,5.09%。这可能是由于揉面初期,在力的作用下蛋白质分子与水分子深度接触,水合作用增强,水溶的氧分子促进了游离巯基氧化为二硫键;随着揉面时间的延长,水合作用进一步增强,直至饱和;揉面后期由于面团长时间被360°揉捏暴露于空气中,蛋白质分子与氧气接触增多,一定程度上促进了氧化作用。
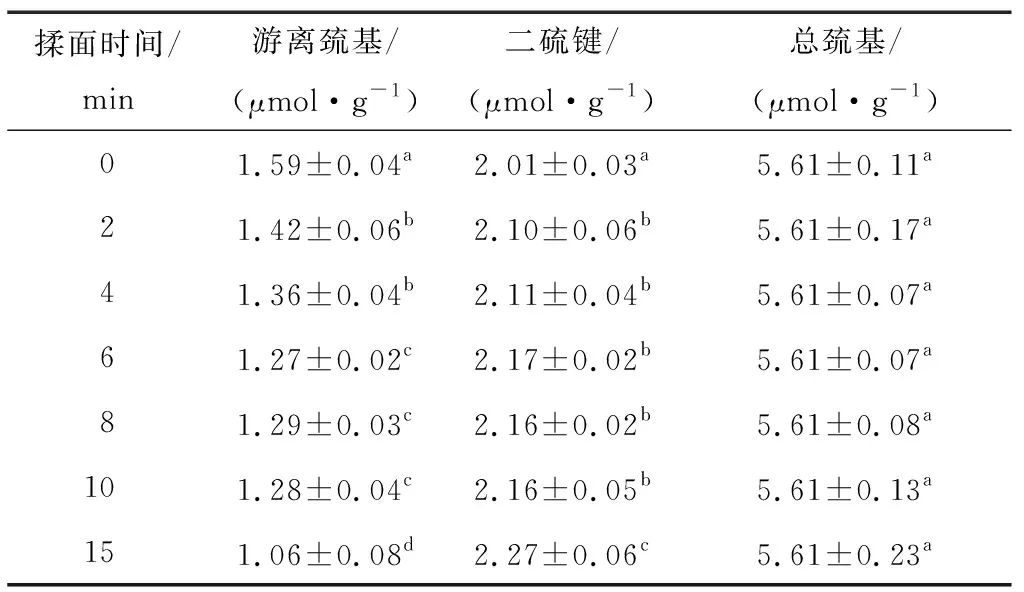
表1 揉面过程中面团巯基与二硫键的变化†
† 同列字母不同表示有显著性差异(P<0.05)。
2.3 揉面过程中面团蛋白质分子间作用力的变化
由图2可知,揉面初期,氢键大量形成,随后含量趋于稳定;疏水相互作用先大幅下降后趋于平缓。当揉面时间为0 min时,疏水相互作用相对处于较高水平,氢键处于较低水平,是由于揉捏使面团中水分子与蛋白质分子进一步接触,蛋白质分子与水分子间的氢键结构取代了水—水氢键结构,蛋白质与水相互作用增强直至趋于饱和状态,此外,疏水相互作用与自由巯基的氧化有关,游离巯基氧化形成二硫键使蛋白质疏水相互作用降低[21]。面团蛋白质分子与水分子的进一步结合,疏水相互作用下降,面筋蛋白分子聚集和缔合形成紧密的网络,提高了蛋白质的弹性,使其结构更加稳定,增强了面团的弹性,与上述质构特性结果一致。
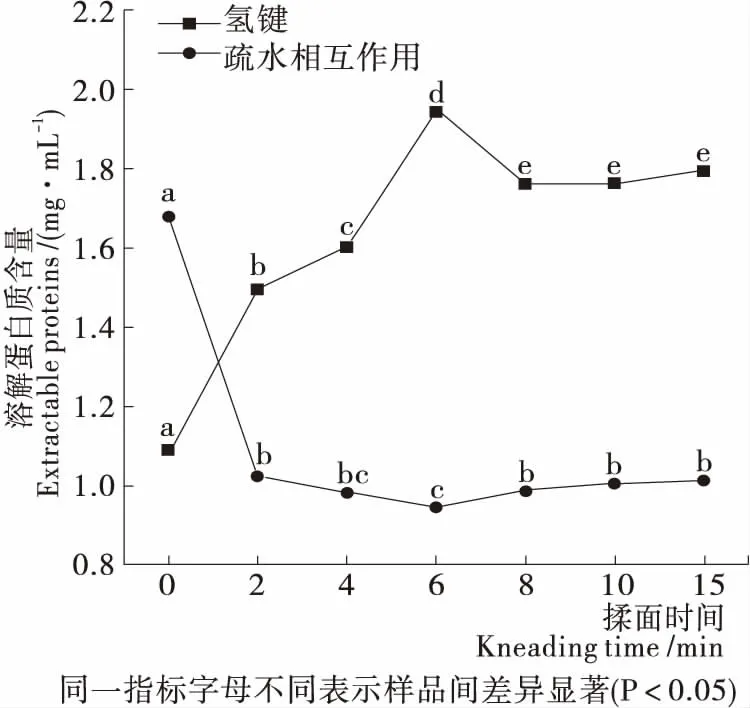
图2 揉面过程中面团蛋白质分子间作用力的变化
Figure 2 Changes of protein intermolecular forces in dough during kneading
2.4 揉面过程中面团蛋白质二级结构的变化
酰胺I带对应的拉曼光谱可用于表征蛋白质二级结构变化,1 614~1 640 cm-1对应的谱峰可归于β-折叠,1 640~1 650 cm-1对应的谱峰可归于无规则卷曲,1 650~1 660 cm-1对应的谱峰可归于α-螺旋,1 660~1 685 cm-1对应的谱峰可归于β-转角[22-24]。由图3可知,揉面过程中面团的蛋白质二级结构:α-螺旋和β-转角处于动态波动状态,基本无变化;无规则卷曲揉面初期骤降56.52%,β-折叠揉面初期增加32.34%,随后二者变化幅度较小。这表明揉面过程中面团蛋白质的构象变化主要取决于β-折叠和无规则卷曲,进而影响面筋网络结构的形成。β-折叠一般被认为是所有二级结构中最为稳定的一种构象。Choi等[25]研究表明,相比β-转角和无规卷曲,α-螺旋和β-折叠属于比较有序化的构象,具有较高的稳定性。故揉面可大幅提升面筋蛋白结构的稳定性和有序性。随着揉面的进行,β-折叠有小幅度的增加和降低变化,与二硫键含量变化趋势一致,可能是由于二硫键有促进蛋白结构更易于形成β-折叠的作用[26]。
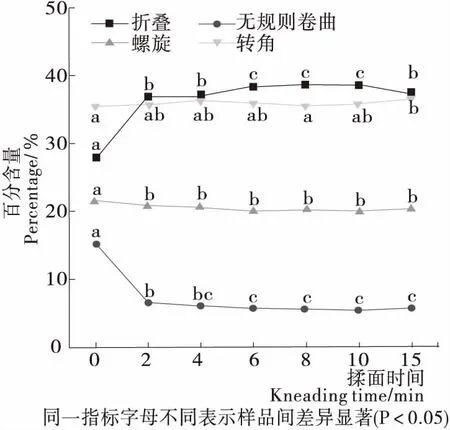
图3 揉面过程中面团蛋白质二级结构的变化
Figure 3 Changes of dough protein secondary structure during kneading
2.5 揉面过程中面团面筋蛋白可萃取率的变化
Pareyt等[27]研究表明,SDS可萃取麦谷蛋白的保留时间为5.00~7.25 min,SDS可萃取麦醇溶蛋白的保留时间为7.25~10.50 min。由图4可知,随着揉面的进行,麦谷蛋白的峰面积下降趋势不明显,麦醇溶蛋白的峰面积有不同程度的下降,揉面后期,麦醇溶蛋白峰面积有一定程度增加,但仍然低于0 min的。这表明在揉面阶段,麦醇溶蛋白发生聚合,而麦谷蛋白仅有轻微下降,结果不明显,有待进一步研究认证。
由图5可知,随着聚集过程的进行,SDS可提取部分减少,SDS不可提取部分增加[28]。揉面过程中,麦谷蛋白萃取率下降幅度虽然较小,但不同样品间具有显著性差异(P<0.05),麦醇溶蛋白萃取率揉面初期下降,揉面后期(8~15 min)有所提升,但仍然低于0 min的,与图4结果一致。揉面后期麦醇溶蛋白和麦谷蛋白的萃取率发生不同程度提升,可能是因为揉面后期面团已充分水合,且施加作用力时间过长,产生的机械可导致蛋白发生轻微解聚,或是使蛋白构象发生一定变化。
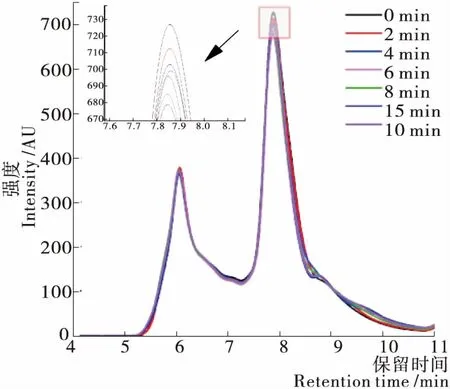
图4 揉面过程中SDS可萃取面筋蛋白的SE-HPLC图谱
Figure 4 SE-HPLC chromatogram of SDS extractable gluten protein during kneading
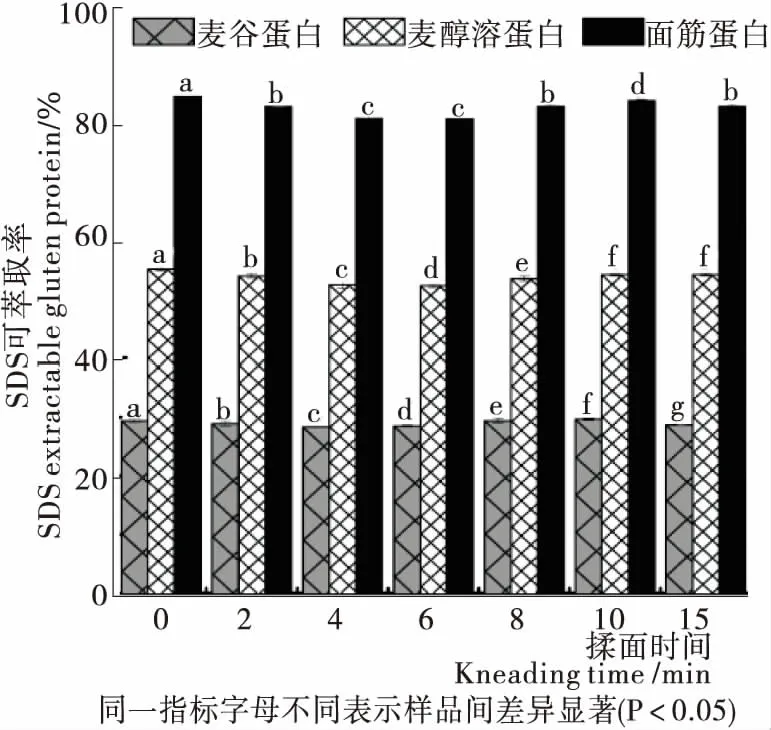
图5 揉面过程中面团面筋蛋白SDS可萃取率的变化
Figure 5 Changes in SDS extractable rate of dough gluten protein during kneading
2.6 揉面过程中面团蛋白质亚基占比的变化
面筋提取物可分为两大类,分别是麦醇溶蛋白亚基(ω-、α-、γ-麦醇溶蛋白)和麦谷蛋白亚基(HMW-GS和LMW-GS),其中LMW-GS又可分为B/C-LMW-GS和D-LMW-GS[29-30]。由图6可知,揉面过程中,ω-麦醇溶蛋白亚基峰面积无明显变化,γ-麦醇溶蛋白亚基峰面积仅在揉面初期(2 min)发生下降,随后与初始值差异不大,α-麦醇溶蛋白亚基峰面积明显下降,尤其是揉面初期最为显著,与麦醇溶蛋白的SDS可萃取率下降趋势一致。
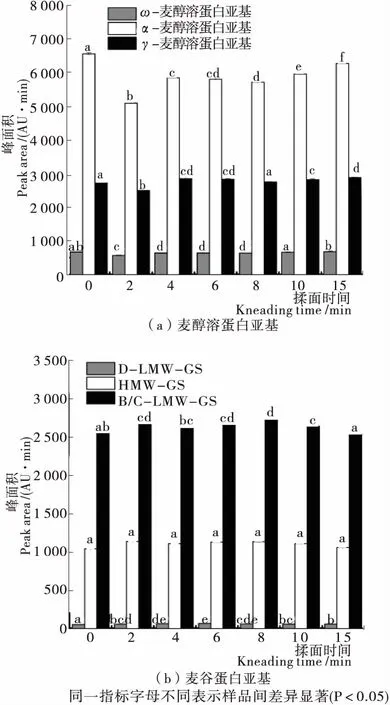
图6 揉面过程中面团蛋白亚基的变化
Figure 6 Changes in dough protein subunits during kneading
揉面过程中α-麦醇溶蛋白亚基峰面积分别降低了22.42%,10.87%,11.59%,12.87%,9.22%,4.35%,表明随着揉面的进行,面团黏性和延展性得到加强。麦谷蛋白的B/C-LMW-GS峰面积显著增加,HMW-GS峰面积无明显变化,说明揉面过程中麦谷蛋白交联程度增强主要是以低分子量麦谷蛋白为主。LMW-GS是小麦面筋蛋白的主要成分之一,决定着面团的面筋强度和弹性[31]。揉面过程中B/C-LMW-GS峰面积分别增加了4.56%,2.61%,4.11%,6.73%,3.18%,0.81%,表明随着揉面的进行,面团弹性得到增强。
3 结论
随着揉面的进行,面团黏弹性增强,揉面初、中期(0~8 min)面团的游离巯基下降,二硫键增多,氢键增多,疏水作用力下降;二级结构中的β-折叠增多,无规则卷曲下降,α-螺旋和β-转角无明显变化;面筋蛋白、麦醇溶蛋白、麦谷蛋白的SDS可萃取率均有不同程度下降;麦谷蛋白主要是以低分子量蛋白发生交联聚合,麦醇溶蛋白的α-、γ-麦醇溶蛋白亚基参与了面筋蛋白的交联聚合反应。揉面后期(10~15 min),各指标或是趋势变得平缓或是发生不同程度反弹,但依然区别于初始值(0 min)。因此,在实际生产应用中,可增加揉面工艺,选取适当时间,可一定程度上改善面团的黏弹性,进而改善面条品质。试验仅从面团面筋蛋白结构构象或成分含量的变化解释面团黏弹性变化,后续可从非线性力学角度(如流变学特性等)定量或定性表征揉面过程中面团面筋蛋白黏弹性变化,使研究更加完善。
