针刺干预对肌萎缩侧索硬化症模型小鼠脑及脊髓中IBA-1和TNF-α表达的影响*
2020-04-13贺韵涵李晓峰杨晓航戚莹媛
贺韵涵,李晓峰,符 涛,杨晓航,戚莹媛,王 强,4△
1.陕西中医药大学(咸阳712046);2.北京崇文光明医院保健科(北京100061);3.陕西中医药大学第二附属医院(咸阳712000);4.陕西省针药结合重点实验室(咸阳712046)
肌萎缩侧索硬化症(Amyotrophiclateral sclerosis,ALS)是一种中枢神经系统退行性疾病。主要表现为全身肌肉渐进性无力、萎缩、肌肉痉挛等,最终多因呼吸麻痹致死[1]。目前该病主要依靠药物利鲁唑(Riluzole)治疗,但其副作用大,经济成本高,因此迫切的需要寻找一种安全、有效、经济的方法。近年来研究发现[2],针灸在治疗神经元退行性疾病中发挥了一定的作用。而针刺治疗ALS 的作用机制却鲜有报道。本研究选择电针刺激双侧天枢穴及足三里穴作为针刺治疗组。再通过对比正常组、模型组、针刺组及利鲁唑组之间IBA-1 及TNF-α 表达的差异,观察电针对IBA-1及TNF-α表达水平的影响,探讨针刺治疗该病的临床价值及作用机制。
材料和方法
1 材 料
1.1 实验动物及分组:SOD1G93A转基因小鼠由Jackson 实验室购买。将18 d小鼠剪尾0.3-0.5 cm,依照Jackson实验室的方法进行基因鉴定。应用PCR技术鉴定子代鼠,符合SOD1G93A基因表型为模型鼠,不符合为正常组,将模型鼠再分为模型组、针刺组、利鲁唑组,每组各8-10 只。实验室喂养条件为(24±2)℃,光照12 h及黑暗12 h交替,定时给予清洁饮水及饲料。实验过程对SOD1G93A转基因小鼠处理,严格遵循国家科技部2006年颁布的《关于善待实验动物的指导性意见》。
1.2 主要试剂及仪器:利鲁唑(法国,赛诺菲);兔抗IBA-1 和TNF-α(英国,ABCAM);即用型SABC(兔IgG)试剂盒(武汉,博士德);DAB 显色液(武汉,博士德);冰冻切片机(美国,Thermo Scientific,型号HM525 NX);显微摄像成像系统(德国,Leica,型号THUNDER Imager Tissue)。
2 实验方法
2.1 干预方法:针刺组于SOD1G93A转基因小鼠出生30 d后开始,依照《实验针灸学》[3]标准选取天枢穴(ST25)及足三里穴(ST36)。天枢穴位于小鼠前正中线旁开5 mm,耻骨联合以上20 mm 处。足三里穴位于膝关节下外侧,腓骨小头下3.5 mm 处。采用0.25 mm×13 mm 不锈钢针灸针,直刺2 mm,接通电针仪(1m A,2Hz),每周针刺2次,每次20 min,连续治疗13周。针刺治疗在气体麻醉下进行(氧气和一氧化二氮的混合物,3%用于诱导,1.5%用于维持),以减少电刺激的压力。利鲁唑组将利鲁唑溶于双蒸水中,按照30 mg/(kg·d)的剂量[4],从小鼠90 d日龄开始予以小鼠灌胃治疗,1次/d。正常组、模型组正常饲养。
2.2 动物体征观察:对比针刺及药物利鲁唑干预后SOD1G93A小鼠毛发光泽度、行走动作、肢体震颤、精神状态及体质量等指标。
3 转棒实验(Rotarod test) 于小鼠日龄30 d后开始,主要用于评定小鼠协调性及肌力。实验前5 d对小鼠进行适应性训练,正式实验从第6天开始。每只小鼠每天重复3次实验,每次间隔15 min,每周测试2次。记录小鼠每次转棒时间,并计算1 d中3次的平均时间。转棒仪转速为15 r/min,超过200 s按照200 s记录,不足200 s则按照实际时长记录。
4 组织取材与制备 小鼠疗程结束并完成转棒实验测试后,进行异氟烷气体麻醉。麻醉后打开胸腔,暴露心脏,用顿头注射器针头插入心尖,快速滴入0.9%氯化钠溶液进行全身灌流并剪开右心耳,直至肺及肝脏颜色变白为止。迅速断头取脑,并取脊髓腰4-5节段,将取出的组织置于4%多聚甲醛溶液,并在4℃冰箱固定24 h。再用30%蔗糖脱水,48 h 后用OCT 冰冻包埋剂固定,以备冰冻切片。冠状切片,脑组织切片厚度为14μm,脊髓切片厚度为20μm 保存于-80℃冰箱用于免疫组化实验。
5 免疫组化检测 脑干区及脊髓IBA-1 和TNF-α表达:取出冰冻切片37℃复温1 h。0.1mol/L PBS室温冲洗并进行抗原修复。与3%过氧化氢反应15 min,5%BSA 室温封闭1h,分别滴加1∶300一抗(兔抗IBA-1 与TNF-α),4℃孵育过夜。次日,0.1 mol/L PBS冲洗后二抗室温孵育1 h,再进行PBS冲洗,滴加SABC反应1 h,冲洗后DAB显色10 min,苏木素复染1.5 min,最后常规脱水透明,中性树胶封片,显微镜下观察。
6 统计学方法 应用SPSS 17.0统计学软件进行分析处理。所有数据以均数±标准差(¯x±s)表示,采用单因素方差分析,组间比较用LSD 检验,以P<0.05为差异有统计学意义。
结 果
1 各组小鼠体征变化 小鼠60 d日龄时,各组间小鼠毛发、行动、精神状态无统计学差异(P>0.05),体征状态良好。小鼠120 d日龄时,对照组毛发光泽、体重正常、行动灵活、精神状态良好。模型组小鼠毛发干枯,精神不振,出现一侧或双侧后肢震颤或无力,肌肉明显萎缩,行走呈拖拽状,体重明显下降(P<0.05)。针刺组各状况较模型组均有好转。见表1。
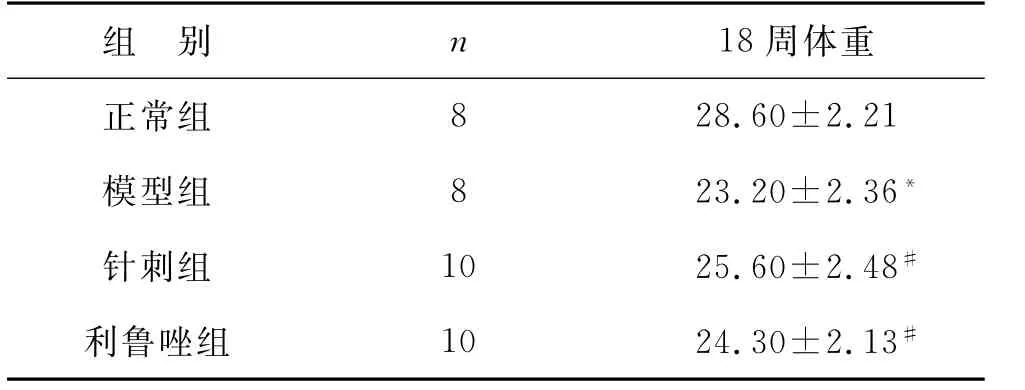
表1 各组小鼠18周体重比较(g)
2 转棒实验 小鼠在转棒仪器上停留时间称为潜伏期。停留期长短可以评估各组小鼠协调能力和肌力。实验发现,17周后,模型组、针刺组及利鲁唑组较正常组潜伏期均缩短(P<0.05),但针刺组较模型组、利鲁唑组停留时间长,运动功能得到改善。见表2。

表2 各组小鼠转棒实验潜伏期比较(s)
3 各组小鼠脑干区IBA-1表达比较 我们比较了各组小鼠脑干区IBA-1 表达情况。结果显示,G93A 模型组的小鼠较同窝野生小鼠对照组比较,IBA-1阳性细胞表达明显增多,灰度值下降(P <0.05),说明发病后的小鼠脑干中小胶质细胞活跃。针刺治疗后,IBA-1阳性细胞较模型组明显减少,灰度值上升(P<0.05),表明早期针刺天枢穴(ST25)及足三里穴(ST36)可以降低小胶质细胞活化,减少神经元损伤。同时,利鲁唑组也有改善,但与模型组间差异无统计学意义(P>0.05)(图1)。
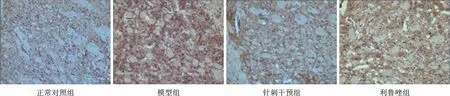
图1 IBA-1在小鼠脑干中的表达(×20)
4 各组小鼠脊髓IBA-1 和TNF-α表达比较IBA-1和TNF-α阳性产物在小鼠脊髓均有表达,着色呈棕黄色。与对照组比较,模型组小鼠脊髓IBA-1和TNF-α阳性细胞计数均明显增高,平均灰度值降低(均P<0.05),表明SOD1G93A转基因小鼠脊髓中激活的小胶质细胞释放炎症介质,导致了神经元的损伤。电针治疗后脊髓IBA-1和TNF-α阳性表达下降,平均灰度值增高(均P<0.05),表明针刺后有可能通过抑制促炎因子TNF-α的释放,降低了小胶质细胞的活化,从而保护神经元,进而改善了SOD1G93A小鼠疾病的发展。利鲁唑组IBA-1和TNF-α阳性表达虽有所下降,但与模型组相比较,差异均无统计学意义(图2、图3)。
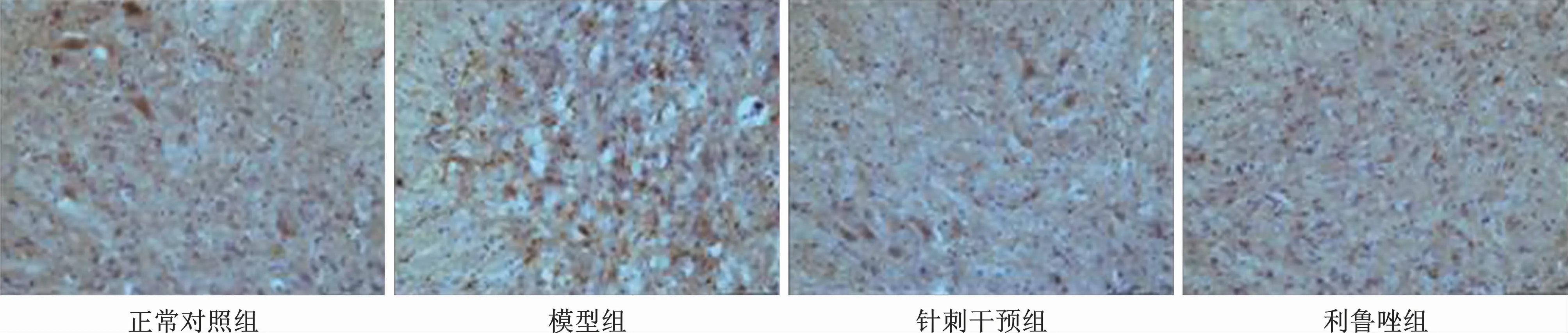
图2 IBA-1在小鼠脊髓中的表达(×20)
讨 论
肌萎缩侧索硬化症(ALS)是一种常见的运动神经元损伤疾病,具有选择性地累及脊髓前角细胞、脑干颅神经运动核等特点。该病症状主要表现为球部、四肢、躯干、胸部、腹部的肌肉逐渐无力和萎缩,最终多数由于呼吸麻痹致死。该发病率1/10万~3/10万,年患病率为5.2/10万,年死亡率为1/10万,且呈逐年增长的趋势[5]。并且我国发病率早于欧洲发达国家,为49.8~54.3岁[6]。ALS具有起病隐袭,致残率和死亡率高的特点。根据病因将该病分为家族性(FALS)和散发型(SALS)两个临床类型。其中遗传型约占5%~10%,平均发病年龄为58-63岁;散发性约占90%~95%,平均发病年龄为43-52岁。临床又将该病分为经典型ALS肢体起病型、经典型ALS 延髓起病型、连枷臂综合征(Flail arm syndrome,FAS)、连枷腿综合征(Flail leg syndrome,FLS)、原发性侧索硬化(primary lateral sclerosis,PLS)、进行性肌萎缩(progressive muscular atrophy,PMA)。ALS 发病机制十分复杂,这些机制可能存在于运动神经元及胶质细胞中。通常,在脑和脊髓损伤、感染、毒素的刺激下或在自身免疫的作用下会出现由胶质细胞激活的免疫应答即神经炎症。瞬时神经炎症损伤后组织修复期间起到保护作用,但慢性神经炎症与运动神经元退行性疾病如帕金森、阿尔兹海默症、ALS 等病理机制均有关。病理性神经炎症主要由于激活的胶质细胞释放促炎细胞因子,导致了运动神经元的死亡。同时有研究证明在炎症因子如肿瘤坏死因子的溶液中也发现了小胶质细胞的存在[7]。
ALS被世界卫生组织列为世界五大疑难杂症之一。目前利鲁唑用于治疗ALS是美国FDA 唯一批准的治疗药物。利鲁唑是一种谷氨酸拮抗剂,通过抑制NMDA 受体和AMPA 受体的兴奋性突触后效应,减少谷氨酸释放,抑制持续钠电流及神经元重复放电,从而降低神经元的兴奋性[8]。有临床研究表明[9],利鲁唑主要可以延长ALS患者最后阶段的生存期,从而延长寿命。
由于利鲁唑价格昂贵,因此急需寻找一种新的治疗手段,而针灸在治疗退行性神经元损伤方面有良好的作用[10]。同时,针灸在疾病治疗中的抗炎作用被广泛应用,并且电针刺激可以通过减少神经元细胞死亡和改善动物运动功能从而治疗神经退行性疾病,这已经得到证实[11]。根据ALS 的临床症状,本病当属中医痿证范畴[12]。其病因病机可归纳为先天不足或后天失养导致脾失健运、肝肾亏虚,气血生化不足。《素问·痿论》曰:“阳明者,五脏六腑之海,主润宗筋,宗筋主束骨而利关节也”。由此看出,调理脾胃,气血充足,则筋脉濡养,束骨而利关节也。许多医家通过整理文献发现[13]治疗ALS 应用最多的经脉就是足阳明胃经,这与“治痿独取阳明”治疗原则一致。本实验选择电针刺激SOD1G93A转基因小鼠足阳明胃经天枢穴(ST25)及足三里穴(ST36)。天枢穴不但是胃经的要穴,同时还是大肠经的募穴,它是阳明经脉气生发之地;足三里穴为足阳明经的下合穴,是六腑气血深注于下肢三阳经的部位,为生化之源,气血充盈。因此,本研究在小鼠30 d时予以电针刺激天枢穴及足三里穴,以促进胃中腐熟生化水谷精微,濡养宗筋,阳明充则宗筋润,而能束骨利机关,从而延缓ALS疾病的进展,这可能也是针刺疗法干预ALS早期的机制之一。
本实验通过对比针刺组与利鲁唑治疗组,结果显示两组均有效改善了小鼠运动功能及生存质量。再通过对各组小鼠脑干区小胶质细胞活化标志物IBA-1的观察发现,ALS模型小鼠脑干区IBA-1较正常组小鼠显著增加,该结果与文献报道一致[14],这些激活的小胶质细胞加快神经元活化最终导致神经元的死亡。同时我们还发现通过针刺治疗脑干区IBA-1表达显著减少。为了进一步探究针刺治疗机制是否与抑制炎症因子释放有关,我们检测了各组小鼠脊髓前角炎症因子IBA-1和TNF-α的表达。TNF-α信号已被证明[15]在神经中枢系统内可以通过激活胶质细胞应对损伤。本实验结果提示通过针刺刺激干预小鼠胶质细胞活化参与炎性反应有一定抑制作用。但同时我们也发现,虽然利鲁唑有效改善了小鼠生存质量,且在脑干及脊髓IBA-1和TNF-α的阳性表达有所下降,但与模型组相比无统计学意义。利鲁唑在最后阶段虽然改善了小鼠生存质量,但其作用机制可能与减少神经炎症关系并不密切。另外,该结果与利鲁唑给药时间是否有关,仍需我们在今后研究中继续探索。同时,再次证明早期针刺治疗可能与减少神经炎症反应有关。
近年来,ALS的发病率逐年上升,目前手段非常有限[16-17]。随着研究更加深入,针刺疗法良性调节,价格低廉及无副作用等,被广泛应用[18-20]。我们的实验结果初步表明,针刺治疗在SOD1G93A模型小鼠中通过抑制活化的胶质细胞释放促炎因子,从而发挥了一定抗炎的作用,减少了神经元在脑和脊髓的损伤。然而,为了更加充分了解针灸治疗作用机制,我们还需要进一步的研究来确定针刺治疗是否会改变氧化应激、蛋白聚集和线粒体功能障碍等,从而为临床治疗提供更多新思路。
