苯并咪唑并[2,1-b]噻唑衍生物的合成
2020-04-10叶姗姗李婷婷赵子任张变香
叶姗姗,李婷婷,王 晨,赵子任,张变香
(山西大学 化学化工学院,山西 太原 030006)
苯并咪唑并[2,1-b]噻唑衍生物是一类芳香杂环类化合物,具有重要的生物和药物活性,作为生物活性物质和药物的关键结构片断,在糖尿病,肿瘤,癌症等疾病的治疗方面有着广泛的应用,使其成为当今研究领域的热门课题之一[1-6]。例如化合物A对人肺癌细胞系A549表现出显著的细胞毒性及对微管蛋白组装的抑制作用[7];化合物B对结肠癌HT-29和三阴性乳腺癌MDA-MB-468细胞系具有良好抗肿瘤效力[8];化合物C对人乳腺癌(MDA MB-231)有显著的抗增殖作用(Chart 1)[9]。

Scheme 1

Chart 1
这类化合物常采用多步合成法合成,收率较低,且后处理较为复杂[Scheme 1,(1)][10]。近年来,随着催化反应的不断发展,一系列新的催化体系被用于有机合成中,成为形成C—N,C—S键的重要方法,广泛应用于含氮、硫的有机化合物的合成制备中[Scheme 1,(2)][11-13]。例如,在以2-巯基苯并咪唑为原料合成苯并咪唑并[2,1-b]噻唑衍生物的研究中,2010年,Xu等[14]报道了在Cu催化下,2-巯基苯并咪唑与溴化烯烃或溴化炔烃反应的一步合成法;2017年,Zhang课题组[15]利用金属Pb和Cu的共催化作用,2-巯基苯并咪唑与碘化烯烃反应合成了带有不同取代基的苯并咪唑并[2,1-b]噻唑衍生物;2018年,Jana等[16]也报道了铜催化下,2-巯基苯并咪唑与带有硝基取代基的烯烃反应合成苯并咪唑并[2,1-b]噻唑衍生物的方法。然而,在这些反应体系中大都需要重金属催化、强碱性条件或者使用一些复杂的配体,在一定程度上提高了实验的成本,也给后续处理带来了困难。目前,用简单方便、反应条件温和的方法制备具有药物活性的咪唑并[2,1-b]噻唑类衍生物的报道很少。
芳基高碘盐作为一种易得且稳定的芳基化试剂被广泛应用于有机合成中[17]。特别是近十几年发展起来的炔基苯基高碘盐,是一种高活性的有机中间体。在有机合成中,高碘基团易被取代,在炔基上形成新的C—C键、C—S键,从而可合成各种取代的炔烃或烯烃化合物[18-21]。本论文在以往研究的基础上[22-24],探讨了在温和的反应条件下,以易得的2-巯基苯并咪唑为原料,与炔基苯基高碘盐反应合成苯并咪唑并[2,1-b]噻唑衍生物的新型合成法[Scheme 1,(3)],并对其反应机理进行了详细的推测分析,同时采用MTT法研究了不同质量浓度的该类化合物对人肝癌细胞(HepG2)生长情况的影响。
1 实验部分
1.1 仪器与试剂
X-4数字显示显微熔点测定仪;ZF-C型三用紫外仪;Bruker AV 600 MHz型核磁共振仪(DMSO-d6或CDCl3为溶剂,TMS为内标);Thermo Scientific Q Exactive型质谱仪;FACS Calibur型流式细胞仪。
人肝癌细胞(HepG2,山西大学生物技术研究所);胎牛血清(FBS,杭州四季青生物材料公司);噻唑蓝(MTT,Sigma);其余所用试剂均为分析纯。
1.2 合成
(1) 苯基(苯基乙炔基)碘鎓甲苯磺酸盐(1)的合成
在100 mL圆底烧瓶中加入碘苯、间氯过氧苯甲酸和一水合对甲苯磺酸,并用有机溶剂将其溶解,室温搅拌反应6 h;滴加到含苯乙炔的有机溶剂溶液中,并加入少量变色硅胶作为干燥剂,反应至反应液变透明。滤除固体,收集有机相,旋蒸除溶,残余物用乙醚洗涤、过滤、滤饼真空干燥得淡黄色的固体粉末1,收率93.2%,m.p.118~121 ℃(119~122 ℃[18]);1H NMR(CDCl3,600 MHz)δ:2.33(s,3H,CH3),7.09~7.10(d,J=7.2 Hz,2H,ArH),7.17~7.46(m,8H,ArH),7.54~7.59(m,3H,ArH),8.14~8.15(d,J=7.2 Hz,1H,ArH)。
(2) 苯并咪唑并[2,1-b]噻唑衍生物(3a~3c)的合成通法
在反应瓶中加入2-巯基苯并咪唑类化合物21 mmol,用有机溶剂溶解后,冰浴条件下滴加11 mmol的有机溶剂悬浊液,滴毕,于室温反应12 h。分液,有机层依次用蒸馏水(3×10 mL)洗涤,无水Na2SO4干燥,过滤,旋蒸除溶,残余物经硅胶柱层析纯化得3a~3c。
3-苯基苯并[4,5]咪唑[2,1-b]噻唑(3a):淡黄色固体,收率83.3%,m.p.138~140 ℃(138~140 ℃[14]);1H NMR(DMSO-d6,600 MHz)δ:7.08~7.11(t,J=7.8 Hz ,1H,ArH),7.15~7.16(d,J=8.4 Hz,2H,ArH),7.29~7.32(t,J=7.8 Hz,1H,ArH),7.63~7.64(d,J=1.8 Hz,3H,ArH),7.71~7.75(m,3H,ArH);13C NMR(DMSO-d6,150 MHz)δ:109.1,111.9,119.2,120.8,123.6,129.3,129.4,129.5,130.1,130.6,133.8,148.7,157.1。
7-甲氧基-3-苯基苯并[4,5]咪唑[2,1-b]噻唑(3b):淡黄色固体,收率84.4%,m.p.122~124 ℃;1H NMR(CDCl3,600 MHz)δ:3.88(s,3H,OCH3),6.58~6.59(d,J=4.8 Hz,1H,ArH),6.71~6.73(m,1H,ArH),7.12~7.14(d,J=9.0 Hz,1H,ArH),7.58~7.60(m,3H,ArH),7.66~7.68(m,2H,ArH);13C NMR(CDCl3,150 MHz)δ:55.7,101.5,106.6,107.1,110.1,112.0,119.5,124.8,128.7,129.0,130.3,133.8,134.2,149.8,156.7;HR-MS(ESI)m/z:calcd for C16H13N2OS{[M+H]+}281.0743,found 281.0742。
7-硝基-3-苯基苯并[4,5]咪唑[2,1-b]噻唑(3c):淡黄色固体,收率80.2%,m.p.140~142 ℃;1H NMR(DMSO-d6,600 MHz)δ:7.24~7.30(m,1H,ArH),7.37~7.44(m,3H,ArH),7.44~7.48(m,1H,ArH),7.57(d,J=9.0 Hz,1H,ArH),7.84(dd,J=1.7 Hz,8.8 Hz,1H,ArH),8.03(dd,J=2.0 Hz,9.0 Hz,1H,ArH),8.39~8.43(m,1H,ArH);13C NMR(DMSO-d6,150MHz)δ:105.8,109.0,115.0,118.1,118.5,126.7,126.9,129.9,130.1,132.8,136.0,137.8,142.6,149.1,154.3;HR-MS(ESI)m/z:calcd for C15H10N3O2S{[M+H]+}296.0653,found 296.0650。
(3)5a和5b的合成通法
在反应器中加入2-巯基唑类化合物41 mmol,用有机溶剂溶解后,冰浴条件下滴加11 mmol的有机溶剂悬浊液,滴毕,于室温反应12 h。分液,有机层依次用蒸馏水(3×10 mL)洗涤,无水Na2SO4干燥,过滤,旋蒸除溶,残余物经硅胶柱层析纯化得目标产物5a和5b(Scheme 2)。
2-((苯基乙炔基)硫代)苯并[d]噁唑(5a):淡黄色固体,收率79.0%,m.p.159~161 ℃;1H NMR(CDCl3,600 MHz)δ:7.39~7.40(d,J=4.8 Hz,4H,ArH),7.46~7.48(m,2H,ArH),7.69~7.71(m,1H,ArH),7.84~7.86(t,J=3.6 Hz,1H,ArH),7.92~7.94(d,J=8.0 Hz,1H,ArH);13C NMR(CDCl3,150 MHz)δ:58.43,110.34,111.09,113.22,120.32,125.51,125.54,125.96,126.05,129.92,139.92,149.06,176.68;HR-MS(ESI)m/z:calcd for C15H10NOS{[M+H]+}252.0405,found 252.0412。

Scheme 2
3-苯基苯并[d]噻唑并[2,3-b]噻唑-4-鎓4-甲基苯磺酸盐(5b):黄色黏稠液体,收率75%;1H NMR(CDCl3,600 MHz)δ:7.24~7.31(m,1H,ArH),7.31~7.41(m,3H,ArH),7.41~7.43(d,J=7.2 Hz,1H,ArH);7.60~7.77(m,1H,ArH),7.77~7.82(m,3H,ArH),7.82~7.93(m,1H,ArH);HR-MS(ESI)m/z:calcd for C15H10NS2{[M-TsO]+}268.0249,found 268.0260。
1.3 体外抗肿瘤活性测定
采用MTT法研究了3a~3c对肿瘤细胞生长的影响。将对数生长期的HepG2细胞以每孔5.0×103个细胞的密度接种于96孔板,待其16 h贴壁后,分别加入含不同质量浓度3a~3c的10%FBS/DMEM培养液200 μL,以未经处理的细胞作为对照组,设置6个复孔,分别培养24 h后,每孔加入5 mg/mLMTT 20 μL,培养4~6 h后弃除旧液,随后加入DMSO 150 μL,振荡10 min,选择490 nm波长,在酶标仪上测定各孔的光吸收值,记录结果并计算各组存活率。
2 结果与讨论
2.1 合成
首先进行2-巯基苯并咪唑与炔基苯基高碘盐1的反应,结果选择性地得到了苯并咪唑并[2,1-b]噻唑,而没有得到硫醚类产物。接着研究了试剂用量、反应温度、时间和溶剂对反应的影响,结果见表1。

表1 反应条件的优化Table 1 Optimization of reaction conditions
a产物3b收率;b产物3c收率。
从表1可以看出,升高体系的反应温度,原料2-巯基苯并咪唑会随着溶剂游离到容器壁,使得目标化合物的产率降低;反应时间为12 h最佳,增加或减少反应时间,结果变化不明显;当带炔基高碘盐1从1 eq.增加到1.2 eq.时,产率没有提高;使用CH2Cl2作溶剂时产率较高。因此,最佳的反应条件是:炔基苯基高碘盐1用量为1当量,溶剂为CH2Cl2,室温下反应12 h,产率达到83.5%。在此反应条件下,分别进行了5-甲氧基-2-巯基苯并咪唑、5-硝基-2-巯基苯并咪唑与炔基苯基高碘盐1的反应,得到了相应的目标化合物3b、3c,产率分别为84.4%、80.2%。
Scheme 3

Scheme 4
2.2 反应机理及产物结构
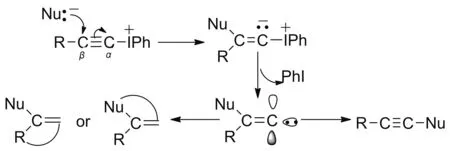
一般来说,在炔基芳基高碘盐参加的反应中,其反应机理大致分为两类:一类是亲核试剂先进攻炔基芳基高碘盐中β-炔基碳原子生成内鎓盐,随着碘苯的离去,形成活泼的卡宾中间体,再经过1,2-迁移或分子内1,5-碳烯插入,得到相应的炔烃或环状烯烃化合物(Scheme 3)[19-23〗;另一类机理是亲核试剂与炔基芳基高碘盐中的碘原子先成键,再与β-炔基碳原子加成,形成一个环状体系后,然后α-位碘离子的消去生成碳宾,最后双键碳上的基团进行1,2-迁移[24-27〗。
为了明确目标产物的结构,我们培养了3a的单晶,通过X射线衍射对其单晶结构进行分析,结果见图1。由图1可见,化合物3a的结构为接近平面的三环苯并咪唑并[2,1-b]噻唑的环状烯烃结构,苯并咪唑中的氮原子与高碘盐中的β-炔基碳原子成键。
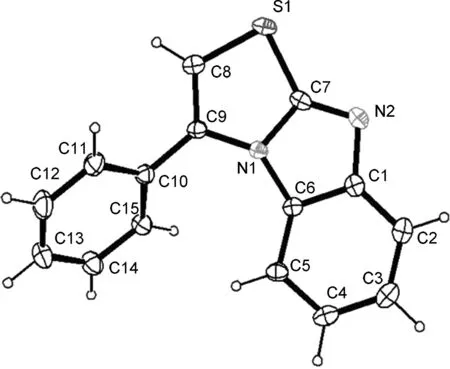
图 1 反应产物3a的单晶结构Figure 1 X-ray crystal structure of product 3a
由此可以推断,反应中巯基硫原子先进攻炔基(苯基)碘鎓盐中碘正离子,形成含有S—I键的中间体Ⅰ,后经过克莱森[3,3]重排,S—I键断裂,N—C键生成,得到中间体Ⅱ,随着碘苯的离去形成类似碳宾的中间体Ⅲ,再经环化、[1,5-H]迁移得到稳定的苯并咪唑并[2,1-b]噻唑衍生物(Scheme 3)。
在确定产物苯并咪唑并[2,1-b]噻唑3a结构及反应机理后,还探讨了2-巯基苯并噁唑、2-巯基苯并噻唑与炔基高碘盐1的反应,得到了经由Scheme 4反应机理的产物5a、5b。实验结果进一步说明杂环化合物的合成受所含杂原子的影响较大,在氧、硫、氮3个杂原子中,氧原子电负性最大,噁唑环上π电子的离域程度相对较小,使其再次成环形成具有芳香性共轭体系的程度较差,得到相应的炔烃化产物5a;硫原子的电负性小于氧和氮原子,与碳接近,噻唑环上的电子云分布比较均匀,π电子离域程度较大,很容易再次成环形成具有芳香性的共轭体系,得到相应的环状产物5b。当2-巯基苯并咪唑的苯环上分别带有不同的吸电子基(NO2)和供电子基团(OCH3)时,对其杂原子部位的反应影响不太明显。
2.3 3a~3c的细胞毒性
图2为3种化合物对肿瘤细胞生长情况的影响。由图2可见,3a、3b和3c对HepG2癌细胞均有毒性,且随着质量浓度的增大毒性作用增强。当化合物的质量浓度达到4 μg/mL时,化合物3b对肿瘤细胞的抑制作用相对最强,抑制率为52%。

Concentration/μg·mL-1图2 化合物3a~3c的体外活性Figure 2 In vitro activities of 3a~3c
以2-巯基咪唑类化合物为原料,与含有端基炔的二芳基高碘盐反应,合成了苯并咪唑并[2,1-b]噻唑衍生物。该方法操作简单,反应条件温和,不需要催化剂和配体,具有良好的应用前景。目标化合物对HepG2癌细胞的生长表现出抑制活性,为新药筛选提供了基础。
