新型苯并噁唑基吡啶盐的合成及其线性光学性质
2020-04-10刘庆松汪泽鹏甘小平周虹屏
刘庆松,汪泽鹏,刘 丹,甘小平,周虹屏
(1.安徽大学 化学化工学院,安徽 合肥 230601;2.安徽农业大学 理学院,安徽 合肥 230036)
苯并噁唑是一种含有氮、氧等杂原子、大π共轭体系的苯并杂环化合物,在医药、农药、合成染料等方面应用广泛;其衍生物具有良好的光学性质,在光电功能材料方面的应用也越来越受到人们的关注:熊启杰等[1]合成了一种荧光增强型苯并噁唑类锌离子探针,能快速、专一性识别Zn2+,可实现对Zn2+的可视化检测;尚玉婷[2]合成了一种检测植物体内Zn2+的苯并噁唑类荧光探针,其荧光强度随Zn2+浓度的增加而增大,能用于Zn2+的定量检测[3-4]。

Scheme 1
有机吡啶盐是一类非常重要的光学材料,在光限幅、光折变、双光子吸收和荧光探针等领域有着广泛的应用:陶在琴等[5]通过Heck偶联反应合成了一种可溶于水、具有红光发射性能的三苯胺吡啶盐衍生物,其荧光发射峰位于近红外波段,可作为荧光探针用于牛血清蛋白和氨基酸的检测;邹顺瑛等[6]合成了一种新型的共轭双吡啶盐,对硝酸根离子具有良好的选择性。此外,还有一些吡啶盐对锌离子[7]、铜离子[8]等具有选择性识别作用,可用于目标离子荧光增强识别。本课题组前期也合成了一系列苯并噁唑4-吡啶盐衍生物[9],对其结构、光学性质和构效关系进行了系统的研究。
为了拓展苯并噁唑吡啶盐类光功能化合物的类型,本文以2-(4′-甲基苯基)苯并噁唑为原料,经过溴化、磷盐化、Wittig缩合、碘甲烷取代和阴离子交换等反应,制得一系列阴离子不同的苯并噁唑3-吡啶盐衍生物1~6(Scheme 1),其结构经1H NMR、13C NMR、FT-IR和HR-MS表征。用X-射线单晶衍射分析了化合物1的单晶结构。此外,还对化合物1~6在不同溶剂中的紫外吸收光谱和荧光发射光谱进行了测试,研究其线性光学性质及构效关系。
1 实验部分
1.1 仪器与试剂
UV-3600型双光束紫外可见分光光谱仪;F7000型荧光光谱仪;Bruker 400 Ultrashield型核磁共振仪(TMS为内标);Nicolet FT-IR NEXUS 870型红外光谱仪(KBr 压片);Bruker Autoflex Ⅲ smartbeam型质谱仪;Bruker SMART APEXⅡ型 CCD衍射仪(以ω/2θ扫描方式收集数据),化合物1的晶体学数据已在剑桥晶体学数据中心注册,CCDC号为:1838541。
中间体L1~L3参考文献[11-13]方法合成;其余所用试剂为分析纯或色谱纯。
1.2 合成路线
(1) 2-(4′-(3′-吡啶乙烯基)苯基)苯并噻唑(L4)的合成
称取中间体L33.58 g(6.5 mmol),吡啶-3-甲醛0.48 g(4.5 mmol),K2CO31.8 g(13 mmol),甲基三辛基氯化铵(Alliquit 336)3滴和N,N-二甲基乙酰胺(DMA)10 mL加入50 mL圆底烧瓶中,氮气保护下于140 ℃回流反应8 h(TLC示踪)。冷却至室温,搅拌下加入50 mL二氯甲烷,抽滤,滤液用饱和食盐水(4×25 mL)洗涤,分液,有机层用无水氯化钙干燥,经硅胶柱层析[洗脱剂:V(石油醚)/V(乙酸乙酯)=5/1]纯化得白色固体L41.10 g,收率76%;1H NMR(400 MHz,DMSO-d6)δ:8.63~8.62(d,J=4.0 Hz,1H),8.25~8.23(d,J=8.0 Hz,2H),7.94~7.90(d,J=12.0 Hz,2H),7.87~7.78(m,4H),7.62~7.60(d,J=8.0 Hz,1H),7.54~7.50(d,J=16.0 Hz,1H),7.47~7.42(m,2H),7.32~7.30(m,1H);13C NMR(100 MHz,DMSO-d6)δ:162.07,154.53,150.20,149.59,141.57,139.86,136.82,130.71,130.39,127.86,127.60,125.77,125.66,124.95,122.99,122.85,119.89,110.92。
(2) 碘化(3-(4′-(2′-苯并噁唑基)苯乙烯基))-N甲基吡啶(1)的合成[14-16]:
称取L40.70 g(2.35 mmol)加入50 mL圆底烧瓶中,加入乙腈13 mL,搅拌使其溶解;加入碘甲烷0.43 g(3 mmol),升温至40 ℃,回流反应约4 h(TLC示踪)。抽滤,滤饼真空干燥得黄色固体10.86 g,收率67%;1H NMR(400 MHz,DMSO-d6)δ:9.32(s,1H),8.90~8.88(d,J=8.0 Hz,1H),8.80~8.78(d,J=8.0 Hz,1H),8.31~8.28(d,J=12.0 Hz,2H),8.18~8.14(t,J=8.0 Hz,1H),7.91~7.89(d,J=8.0 Hz,2H),7.83~7.78(m,3H),7.61~7.57(d,J=16.0 Hz,1H),7.49~7.42(m,1H),4.39(s,3H);13C NMR(100 MHz,DMSO-d6)δ:161.79,150.22,143.58,143.48,141.50,141.48,138.79,136.64,133.98,127.95,127.90,127.57,125.74,125.01,123.63,119.88,110.96,48.12;IRν:3415.99,3034.74,1612.11,1555.31,1506.74,1452.78,1349.97,1295.72,1244.60,1182.40,1049.77,976.78,833.64,744.17,671.18,506.45 cm-1;MS(APCI)m/z:Calcd for C21H17IN2O{[M-I-]+}313.1335,found 313.1331。
(3) 化合物2~5的合成(以2为例)[17]:
称取化合物10.3 g(0.68 mmol)加入250 mL圆底烧瓶中,加入乙腈100 mL,加热使其溶解;滴加硝酸银 0.1155 g(0.68 mmol)的乙腈(2 mL)溶液,滴毕,于80 ℃回流反应6 h。抽滤,滤液浓缩,冷却过夜,抽滤,滤饼真空干燥得黄色固体20.21 g,收率55%。
用对甲苯磺酸银,六氟磷酸银和三氟乙酸银替代硝酸银,用类似的方法合成化合物3~5,收率依次为42%,8%,15%。
硝酸(3-(4′-(2′-苯并噁唑基)苯乙烯基))-N-甲基吡啶(2):1H NMR(400 MHz,DMSO-d6)δ:9.29(s,1H),8.89~8.87(d,J=8.0 Hz,1H),8.80~8.78(d,J=8.0 Hz,1H),8.32~8.30(d,J=8.0 Hz,2H),8.18~8.14(t,J=8.0 Hz,1H),7.91~7.89(d,J=8.0 Hz,2H),7.86~7.82(t,J=8.0 Hz,2H),7.81~7.77(d,J=16.0 Hz,1H),7.62~7.58(d,J=16.0 Hz,1H),7.49~7.43(m,2H),4.38(s,3H);13C NMR(100 MHz,DMSO-d6)δ:150.23,143.62,143.54,141.50,141.33,141.17,138.80,136.67,134.00,127.93,127.58,126.61,125.76,125.03,123.68,121.46,120.82,119.89,110.97,48.09;IRν:3412.85,3036.67,1625.72,1508.59,1452.68,1383.63,1245.26,1553.49,973.82,832.65,806.09,763.60,742.60,702.38,675.54,502.78 cm-1;MS(APCI)m/z:Calcd for C21H17N3O4{[M-(NO3)-]+} 313.1335,found 313.1328。
对甲苯磺酸(3-(4′-(2′-苯并噁唑基)苯乙烯基))-N-甲基吡啶(3):1H NMR(400 MHz,DMSO-d6)δ:9.29(s,1H),8.87~8.86(d,J=4.0 Hz,1H),8.78~8.76(d,J=8.0 Hz,1H),8.30~8.28(d,J=8.0 Hz,2H),8.16~8.12(t,J=4.0 Hz,1H),7.90~7.87(d,J=12.0 Hz,2H),7.83~7.80(t,J=6.0 Hz,2H),7.79~7.75(d,J=16.0 Hz,1H),7.60~7.56(d,J=16.0 Hz,1H),7.48~7.41(m,4H),4.37(s,3H),2.27(s,3H);13C NMR(100 MHz,DMSO-d6)δ:161.80,150.23,145.81,143.54,141.51,141.16,138.81,137.50,136.68,134.00,128.00,127.96,127.91,127.57,126.59,125.75,125.45,125.02,123.68,119.88,110.96,48.09,20.74;IRν:3421.31,3063.00,1630.47,1517.85,1453.11,1416.75,1292.90,1219.59,1118.20,1062.04,1033.96,1011.49,971.88,814.33,763.78,679.24,566.92,499.23 cm-1;MS(APCI)m/z:Calcd for C21H17N3O4{[M-(NO3)-]+} 313.1335,found 313.1329。
六氟磷酸(3-(4′-(2′-苯并噁唑基)苯乙烯基))-N-甲基吡啶(4):1H NMR(400 MHz,DMSO-d6)δ:9.30(s,1H),8.88~8.86(d,J=8.0 Hz,1H),8.79~8.77(d,J=8.0 Hz,1H),8.30~8.28(d,J=8.0 Hz,2H),8.17~8.13(t,J=10.0 Hz,1H),7.90~7.88(d,J=8.0 Hz,2H),7.82~7.76(m,3H),7.60~7.56(d,J=16.0 Hz,1H),7.46~7.41(m,2H),4.38(s,3H);13C NMR(100 MHz,DMSO-d6)δ:161.79,150.23,143.51,141.50,141.19,138.80,136.66,134.00,127.96,127.92,127.58,126.59,125.75,125.01,123.66,119.88,110.97,48.11;IRν:3421.31,3045.14,1609.31,1512.42,1449.18,1344.17,1288.76,1244.67,1175.63,1062.49,979.52,824.91,764.28,673.19,504.64;MS(APCI)m/z:Calcd for C21H17N2OF6P{[M-(PF6)-]+}313.1335,found 313.1330。
三氟乙酸(3-(4′-(2′-苯并噁唑基)苯乙烯基))-N-甲基吡啶(5):1H NMR(400 MHz,DMSO-d6)δ:9.29(s,1H),8.88~8.87(d,J=4.0 Hz,1H),8.79~8.77(d,J=8.0 Hz,1H),8.30~8.28(d,J=8.0 Hz,2H),8.16~8.13(t,J=6.0 Hz,1H),7.90~7.88(d,J=8.0 Hz,2H),7.82~7.80(t,J=4.0 Hz,2H),7.79~7.75(d,J=16.0 Hz,1H),7.60~7.56(d,J=16.0 Hz,1H),7.48~7.41(m,2H),4.37(s,3H);13C NMR(100 MHz,DMSO-d6)δ:161.79,150.23,143.54,141.51,141.17,138.80,136.67,133.99,127.95,127.92,127.58,126.59,125.75,125.02,123.68,119.88,110.96,48.08;IRν:3403.44,3405.15,1686.00,1511.30,1297.03,1208.03,1128.44,969.18,831.48,767.13,675.11,555.75,500.73 cm-1;MS(APCI)m/z:Calcd for C23H17N2O3F3{[M-(F3CCOO)-]+}313.1335,found 313.1328。
(4) 四苯硼酸(3-(4′-(2′-苯并噁唑基)苯乙烯基))-N-甲基吡啶(6)的合成[18]
称取化合物10.28 g(0.636 mmol)加入250 mL圆底烧瓶中,加入无水乙醇100 mL,加热使其溶解;滴加四苯硼钠0.217 g(0.636 mmol)的乙醇溶液,滴毕,于80 ℃回流反应6 h。抽滤,滤饼真空干燥得黄色固体60.285 g,收率42%;1H NMR(400 MHz,DMSO-d6)δ:9.27(s,1H),8.86~8.84(d,J=8.0 Hz,1H),8.77~8.75(d,J=8.0 Hz,1H),8.31~8.29(d,J=8.0 Hz,2H),8.15~8.11(t,J=8.0 Hz,1H),7.90~7.88(d,J=8.0 Hz,2H),7.85~7.80(m,2H),7.79~7.75(d,J=16.0 Hz,1H),7.60~7.56(d,J=16.0 Hz,1H),7.46~7.43(m,2H),7.17(s,3H),6.93~6.90(t,J=6.0 Hz,8H),6.80~6.76(t,J=8.0 Hz,4H),4.36(s,3H);13C NMR(100 MHz,DMSO-d6)δ:164.05,163.56,163.07,162.58,161.79,150.24,143.58,143.49,141.47,141.17,138.79,136.67,135.49,134.02,127.96,127.58,126.57,125.75,125.22,125.02,123.66,121.48,119.89,110.96,48.09;FT-IRν:3403.44,3063.00,1634.23,1582.07,1453.24,1247.47,1137.66,1063.60,827.85,737.07,707.10,671.36,610.84 cm-1;MS(APCI)m/z:Calcd for C45H37N2O4{[M-(B(Ph)4)-]+}313.1335,found 313.1331。
2 结果与讨论
2.1 表征
化合物1属于单斜晶系,P21/n空间群,晶胞参数为a=14.6690(18) Å,b=7.7244(10) Å,c=16.941(2) Å,α=γ=90°,β=103.225(1)°,R1=0.0197,wR2=0.0571,GOF=1.102。1的单分子结构和堆积结构见图1。
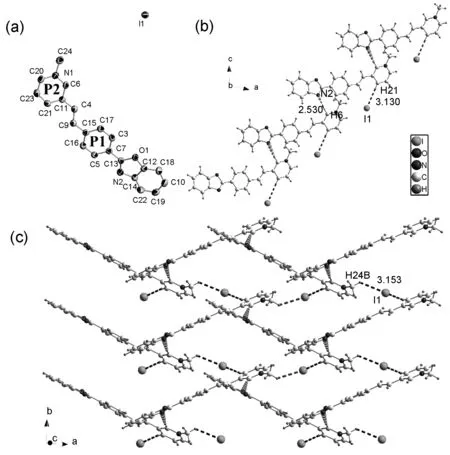
图1 1的ORTEP图(a),一维结构图(b)和二维结构图(c)Figure 1 (a)ORTEP diagram,(b)one -dimensional structure and two-dimensional structure(c) of compound 1
由图1(a)可见,在化合物1的椭球图中,苯并噁唑环和相邻的苯环平面P1(由C3,C5,C7,C15,C16,C17组成)的二面角为9.859°,平面P1和吡啶环P2之间的二面角为13.892°,C15—C9,C9=C4,C4—C11的键长分别为1.477 Å,1.334 Å,1.471 Å,表明化合物在该部分具有较高程度的离域。上述结果表明:该系列化合物阳离子部分从电子给体的苯并噁唑环到电子受体的吡啶环区域有较好的平面性,有利于分子内电荷的转移[19]。由图1(b)可见,化合物1的一维链状结构中是通过N2…H6(d=2.530 Å)和I1…H21(d=3.130 Å)等弱相互作用连接的。二维层状结构是通过I1…H24B(d=3.153Å)弱相互作用形成的。
2.2 光学性质研究
为了研究6种吡啶盐在溶液中的线性光学性质,分别在乙醇、乙腈、DMF、甲醇、二甲基亚砜和水中测试了化合物的紫外-可见吸收光谱和荧光发射光谱。
由UV-Vis谱图(图略)可知,化合物1~6均在350 nm附近有一个吸收峰,结合理论计算结果(图2)可以归属为分子内电荷转移跃迁(ICT)[20]。与苯并噁唑4-吡啶盐的紫外吸收光谱相比,化合物1~6的最大吸收波长略有蓝移(苯并噁唑4-吡啶盐的最大吸收波长均在约370 nm)。说明吡啶氮原子的位置变动后会使化合物1~6的基态到激发态的能级差变大。
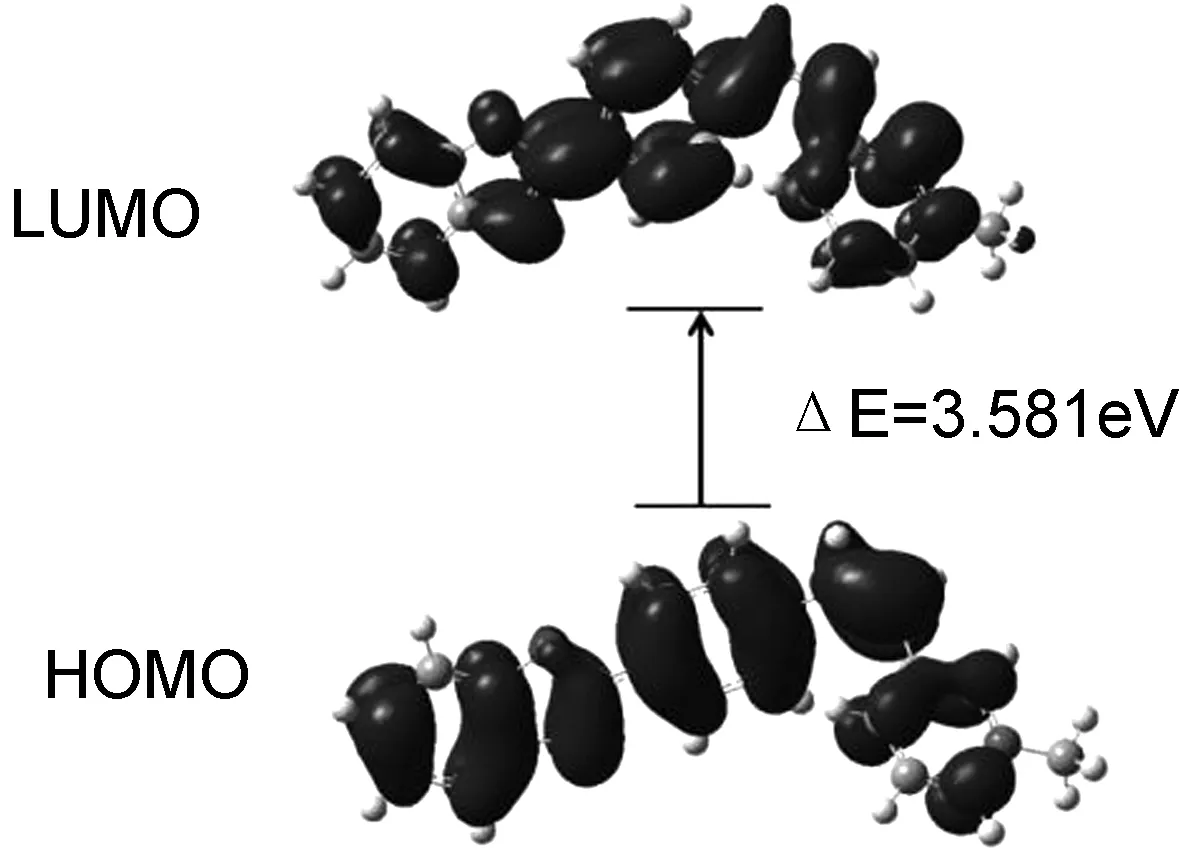
图2 化合物1~6阳离子部分的前线分子轨道的能级和电子密度分布图(B3LYP/6-31G)Figure 2 Energy gaps and electron cloud distributions of the cationic part of 1~6
由FL谱图(图略)可知,化合物1~6在6种不同极性的溶剂中具有不同强度的荧光发射,尤其是在水溶液中具有良好的荧光发射性能。最大荧光发射波长位于约480 nm,虽然较苯并噁唑4-吡啶盐衍生物(约500 nm)蓝移,但在水溶液中良好的荧光发射性使得该系列化合物仍具有作为水溶性的荧光材料的潜质。
在温和的反应条件下合成了6个新型的水溶性苯并噁唑基吡啶盐。6种不同阴离子的苯并噁唑吡啶盐在不同极性的溶剂中,特别是在水溶液中具有良好的光学性质,其最大吸收波长均位于约350 nm,最大荧光发射波长则位于约470 nm,可作为潜在的杂环小分子光电功能材料应用。
