新型α-蒎烯基苯磺酰胺类化合物的合成及其抗真菌活性
2020-04-10李龙生段文贵林桂汕陆顺忠
岑 波,李龙生,段文贵*,林桂汕,陈 铭,陆顺忠
(1.广西大学 化学化工学院,广西 南宁 530004;2.广西林业科学研究院,广西 南宁 530002)
松节油是广西等地区的天然优势生物质资源,其主要成分为α-蒎烯。α-蒎烯及其衍生物具有良好的抗菌、除草、杀虫和驱避等生物活性[1-2]。通过α-蒎烯分子四元环和双键官能团的改性,可以合成具有生物活性及其他功能的化合物。
磺酰胺类化合物的结构中含有-SO2和-NH-基团,此类含硫、氮原子及活泼氢的化合物显示出杀菌[3]、除草[4]、杀虫[5]和抗癌[6]等广泛的生物活性,在农药和医药等方面有较多应用。近年来,本课题组在松节油基新型生物活性化合物的合成方面取得了一系列研究成果[4,7-16]。
本文在实验室成果基础上,继续开展对α-蒎烯的改性研究。以α-蒎烯为原料,经多步反应,将磺酰胺活性基团引入到α-蒎烯的亚结构中去,设计并合成了一系列新型α-蒎烯基磺酰胺类化合物(7a~7i,Scheme 1),其结构经1H NMR、13C NMR、FT-IR和MS(ESI)表征。并测试了化合物对5种植物病原菌的抑制活性。
1 实验部分
1.1 仪器与试剂
MP420型全自动熔点仪;AVANCE Ⅲ HD 600 MHz型超导核磁共振仪(CDCl3为溶剂,TMS为内标);Nicolet iS 50 FT-IR型红外光谱仪(KBr压片或涂膜);TSQ Quantum Access MAX型液相色谱-质谱联用仪;Agilent 6890型气相色谱仪;Waters 1525型高效液相色谱仪。
α-蒎烯,GC测定质量分数为97%,广西梧州松脂股份有限公司;α-萜品烯马来酸酐加成物(3)[17]和N-芳磺酰基乙二胺(6a~6i)[18]按文献方法合成;其余所用试剂均为分析纯。
1.2 合成
(1)N-羧甲基萜品烯马来酰亚胺(4)的合成
在50 mL两口烧瓶中加入甘氨酸0.90 g(12.0 mmol),N,N-二甲基甲酰胺6 mL和三乙胺12.0 mmol,滴加32.34 g(10.0 mmol)的DMF(6 mL)溶液,滴毕(约30 min),回流反应约4 h(TLC监测)。冷却至室温,倒入250 mL分液漏斗中,用10%氢氧化钠溶液调至pH 9~10,用二氯甲烷(2×20 mL)萃取,合并水相,用稀盐酸溶液调至pH 5~6,用少量二氯甲烷萃取,合并有机层,用无水Na2SO4干燥,减压蒸除二氯甲烷,残余物经硅胶柱层析(洗脱剂:A=石油醚/乙酸乙酯=2/1,V/V)纯化得化合物白色固体4,产率68%,m.p.153~154 ℃;1H NMR(600 MHz,DMSO-d6)δ:5.90(d,J=8.5 Hz,1H,7-H),5.82(d,J=8.5 Hz,1H,8-H),3.92(s,2H,15-H),3.07(d,J=7.9 Hz,1H,2-H),2.74(d,J=7.9 Hz,1H,5-H),2.47~2.42(m,1H,11-H),1.52~1.46(m,1H,9a-H),1.43~1.38(m,1H,10a-H),1.36(s,3H,14-H),1.19~1.15(m,1H,9b-H),1.13~1.08(m,1H,10b-H),1.01(d,J=6.8 Hz,3H,13-H),0.90(d,J=6.9 Hz,3H,12-H);13C NMR(150 MHz,CDCl3)δ:176.9,175.4,168.1,136.2,135.2,49.8,46.1,44.2,43.1,37.5,34.8,29.3,22.5,21.0,18.3,17.0;IR(KBr)ν:3100~3300,3036,1751,1677 cm-1;MS(ESI)m/z:289.9{[M-H]+}。
(2)N-羧甲基萜品烯马来酰亚胺基酰氯(5)的合成
在50 mL两口瓶中加入2.91 g(10.0 mmol)化合物4,滴加二氯亚砜10 mL,滴毕(30 min),搅拌下升温至65 ℃,反应3~4 h(TLC监测)。减压蒸除过量二氯亚砜得棕黄色黏稠液体5。
(3)7a~7i的合成(以7a为例)
在50 mL两口烧瓶中加入化合物6a10.0 mmol,二氯甲烷15 mL和三乙胺1.4 mL(10.0 mmol),搅拌使其混合均匀;缓慢滴加化合物511.0 mmol的二氯甲烷(10 mL)溶液,滴毕(30 min),反应1~2 h(TLC监测)。过滤,滤液减压蒸馏得固体粗产物,经硅胶柱层析(洗脱剂:A=1/1)纯化得目标产物7a。
用类似的方法合成7b~7i。
α-蒎烯基苯基磺酰胺(7a):白色固体,收率84%,m.p.63~64 ℃;1H NMR(600 MHz,CDCl3)δ:7.83(d,J=9.1 Hz,2H,20-H,24-H),7.57(t,J=7.4 Hz,1H,22-H),7.50(t,J=7.6 Hz,2H,21-H,23-H),6.74(t,J=5.3 Hz,1H,CONH),6.00(d,J=8.5 Hz,1H,8-H),5.92(d,J=8.4 Hz,1H,7-H),4.05(s,2H,15-H),3.36(m,2H,17-H),3.09(d,J=7.9 Hz,1H,2-H),3.00(m,2H,18-H),2.70(d,J=7.9 Hz,1H,5-H),2.59~2.51(m,1H,11-H),1.53~1.45(m,9a-H,4H,14-H),1.45~1.39(m,1H,10a-H),1.33~1.28(m,1H,9b-H),1.24(m,1H,10b-H),1.07(d,J=6.8 Hz,3H,13-H),0.96(d,J=6.9 Hz,3H,12-H);13C NMR(150 MHz,CDCl3)δ:177.8,177.3,166.9,139.6,136.6,135.9,132.9,129.4,127.2,50.6,46.8,43.8,42.4,41.2,39.9,37.0,34.3,29.8,23.0,22.8,18.6,17.0;IR(KBr)ν:3356,3291,3038,1770,1699,1161 cm-1;MS(ESI)m/z:473.8{[M+H]+}。
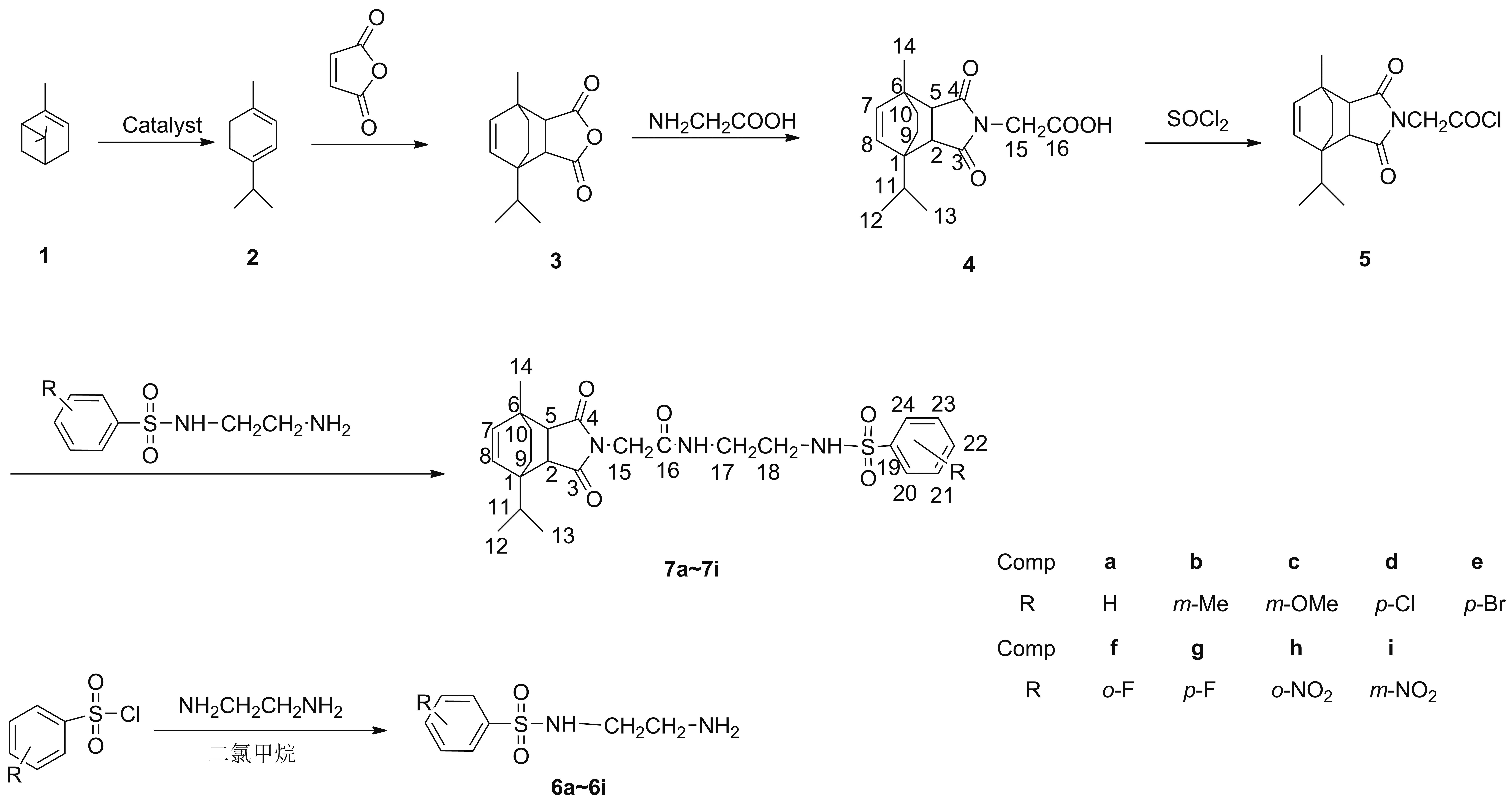
Scheme 1
α-蒎烯基m-甲基苯基磺酰胺(7b):白色固体,产率80%,m.p.69~70 ℃;1H NMR(600 MHz,CDCl3)δ:7.65(s,1H,20-H ),7.63(d,J=7.0 Hz,1H,24-H),7.38(m,2H,22-H,23-H),6.65(t,J=5.6 Hz,1H,CONH),6.01(d,J=8.4 Hz,1H,8-H),5.93(d,J=8.5 Hz,1H,7-H),5.66(t,J=6.2 Hz,1H,SNH),4.05(s,2H,15-H),3.34(m,2H,17-H),3.09(d,J=7.9 Hz,1H,2-H),3.01(m,2H,18-H),2.70(d,J=7.9 Hz,1H,5-H),2.56(m,1H,11-H),2.41(s,3H,Ar-CH3),1.53~1.46(m,4H,14-H,9a-H),1.45~1.39(m,1H,10a-H),1.31(m,1H,9b-H),1.25(m,1H,10b-H),1.08(d,J=6.8 Hz,3H,13-H),0.97(d,J=6.9 Hz,3H,12-H);13C NMR(150 MHz,CDCl3)δ:177.7,177.2,166.8,139.6,139.4,136.6,135.9,133.8,129.2,127.5,124.3,50.6,46.8,43.8,42.4,41.3,39.9,37.0,34.3,29.8,23.0,22.8,21.5,18.6,17.0;IR(KBr)ν:3359,3293,3097,1770,1699,1155 cm-1;MS(ESI)m/z:487.9{[M+H]+}。
α-蒎烯基m-甲氧基苯基磺酰胺(7c):白色固体,产率70%,m.p.79~83 ℃;1H NMR(600 MHz,CDCl3)δ:7.84(s,1H,20-H),7.62~7.52(m,1H,24-H),7.30~7.24(m,1H,22-H),7.23~7.16(m,1H,23-H),6.65(t,J=5.5 Hz,1H,CONH),6.01(d,J=9.0 Hz,1H,8-H),5.95~5.91(d,J=8.9 Hz,1H,7-H),5.89(dd,J=7.6 Hz,4.6 Hz,1H,SNH),4.04(s,2H,15-H),3.30(m,2H,17-H),3.08(m,3H,2-H,18-H),2.70~2.66(d,J=7.9 Hz,1H,5-H),2.60~2.52(m,1H,11-H),1.55~1.43(m,4H,14-H,9a-H),1.45~1.38(m,1H,10a-H),1.36~1.28(m,1H,9b-H),1.27~1.24(m,1H,10b-H),1.11~1.06(d,J=6.8 Hz,3H,13-H),0.99~0.92(d,J=7.0 Hz,3H,12-H);13C NMR(150 MHz,CDCl3)δ:177.6,177.1,166.7,159.8,141.6,136.6,135.9,130.5,127.7,124.7,121.9,55.6,50.6,46.8,43.8,42.6,41.2,39.9,38.8,37.0,34.3,29.8,23.0,22.8,18.6,17.0;IR(KBr)ν:3359,3295,3096,1771,1702,1156 cm-1;MS(ESI)m/z:502.0 {[M-H]+}。
α-蒎烯基p-氯苯基磺酰胺(7d):白色固体,产率85%,m.p.80~81 ℃;1H NMR(600 MHz,CDCl3)δ:7.77(d,J=8.6 Hz,2H,20-H,24-H),7.48(d,J=8.5 Hz,2H,21-H,23-H),6.69(t,J=5.6 Hz,1H,CONH),6.00(d,J=8.7 Hz,1H,8-H),5.96(d,J=14.6 Hz,1H,SNH),5.91(d,J=8.4 Hz,1H,7-H),4.04(s,2H,15-H),3.33(m,2H,17-H),3.08(d,J=7.7 Hz,1H,2-H),2.99(m,2H,18-H),2.69(d,J=7.8 Hz,1H,5-H),2.54(m,1H,11-H),1.51(m,1H,9a-H),1.47(s,3H,14-H),1.44~1.38(m,1H,10a-H),1.35~1.29(m,1H,9b-H),1.27~1.21(m,1H,10b-H),1.08(d,J=6.7 Hz,3H,13-H),0.97(d,J=6.9 Hz,3H,12-H);13C NMR(150 MHz,CDCl3)δ:177.8,177.2,166.9,139.4,138.2,136.4,135.9,129.6,128.6,50.6,46.8,42.6,41.2,39.9,37.0,34.3,29.8,23.0,22.8,18.6,17.0;IR(KBr)ν:3365,3296,3093,1770,1699,1164 cm-1;MS(ESI)m/z:507.9 {[M+H]+}。
α-蒎烯基p-溴苯基磺酰胺(7e):白色固体,产率75%,m.p.54~56 ℃;1H NMR(600 MHz,CDCl3)δ:7.70(d,J=8.6 Hz,2H,20-H,24-H),7.65(d,J=8.6 Hz,2H,21-H,23-H),6.58(t,J=5.7 Hz,1H,CONH),6.01(d,J=8.5 Hz,1H,8-H),5.93(d,J=8.4 Hz,1H,7-H),5.80(t,J=6.1 Hz,1H,SNH),4.05(s,2H,15-H),3.34(dd,J=10.4,6.2 Hz,2H,17-H),3.09(d,J=7.9 Hz,1H,2-H),3.01(dd,J=11.2 Hz,5.8 Hz,2H,18-H),2.70(d,J=7.9 Hz,1H,5-H),2.55(m,1H,11-H),1.53~1.48(m,1H,9-H),1.48~1.41(m,4H,10a-H,14-H),1.32(m,1H,9b-H),1.28~1.25(m,1H,10b-H),1.08(d,J=6.8 Hz,3H,13-H),0.97(d,J=7.0 Hz,3H,12-H);13C NMR(150 MHz,CDCl3)δ:177.7,177.2,167.0,138.7,136.6,135.9,132.6,128.7,127.9,50.6,46.8,43.8,42.5,41.2,39.8,37.0,34.3,29.8,23.0,22.7,18.5,17.0;IR(KBr)ν:3354,3291,3090,1772,1702,1165 cm-1;MS(ESI)m/z:551.8{[M+H]+}。
α-蒎烯基o-氟苯基磺酰胺(7f):白色固体,产率65%,m.p.66~68 ℃;1H NMR(600 MHz,CDCl3)δ:7.86(m,2H,21-H,24-H),7.17(m,2H,22-H,23-H),6.69(t,J=5.6 Hz,1H,CONH),6.00(d,J=8.5 Hz,1H,8-H),5.98(d,J=8.6 Hz,1H,SNH),5.92(d,J=8.7 Hz,1H,7-H),4.05(s,2H,15-H),3.34(m,2H,17-H),3.08(d,J=7.1 Hz,1H,2-H),3.03~2.96(m,2H,18-H),2.69(d,J=7.7 Hz,1H,5-H),2.59~2.47(m,1H,11-H),1.53~1.46(m,4H,14-H,9a-H),1.42(m,1H,10a-H),1.32(m,1H,9b-H),1.24(m,1H,10b-H),1.08(d,J=6.8 Hz,3H,13-H),0.97(d,J=6.9 Hz,3H,12-H);13C NMR(150 MHz,CDCl3)δ:177.8,177.2,167.0,164.5,136.6,136.,135.9,135.7,130.0,129.9,116.5,50.6,46.8,43.8,42.5,41.2,39.9,37.0,34.3,29.8,23.0,22.8,18.5,17.0;IR(KBr)ν:3357,3294,3105,1770,1700,1167 cm-1;MS(ESI)m/z:489.9{[M-H]+}。
α-蒎烯基p-氟苯基磺酰胺(7g):白色固体,产率68%,m.p.69~71 ℃;1H NMR(600 MHz,CDCl3)δ:7.75(d,J=8.8 Hz,2H,20-H,24-H),6.96(d,J=8.8 Hz,2H,21-H,23-H),6.69(t,J=5.5 Hz,1H,CONH),5.98(d,J=8.5 Hz,1H,8-H),5.91(d,J=8.5 Hz,1H,7-H),5.63(d,J=5.9 Hz,1H,SNH),3.86(s,2H,15-H),3.31(m,2H,17-H),3.05(d,J=7.1 Hz,1H,2-H),2.94(d,J=3.0 Hz,2H,18-H),2.68(d,J=7.6 Hz,1H,5-H),2.56(m,1H,11-H),1.49(m,4H,14-H,9a-H),1.43(m,1H,10a-H),1.32(m,1H,9b-H),1.27~1.25(m,1H,10b-H),1.08(d,J=6.8 Hz,3H,13-H),0.95(d,J=6.9 Hz,3H,12-H);13C NMR(150 MHz,CDCl3)δ:177.6,177.1,166.6,163.0,141.6,136.4,135.7,129.4,114.5,50.7,46.8,44.0,42.6,41.2,39.6,37.9,34.3,29.8,23.1,22.8,18.6,17.0;IR(KBr)ν:3361,3297,3097,1772,1701,1168 cm-1;MS(ESI)m/z:489.9{[M-H]+}。
α-蒎烯基o-硝基苯基磺酰胺(7h):白色固体,产率82%,m.p.79~81 ℃;1HNMR(600 MHz,CDCl3)δ:8.11~8.07(d,J=7.5 Hz,1H,24-H),7.87~7.84(d,J=8.7 Hz,1H,21-H),7.76~7.72(m,2H,22-H,23-H),6.48(t,J=5.7 Hz,1H,CONH),6.03(d,J=8.4 Hz,1H,8-H),5.95(t,J=6.3 Hz,2H,7-H,SNH),4.04(s,2H,15-H),3.39(m,2H,17-H),3.18(m,2H,18-H),3.07(d,J=7.9 Hz,1H,2-H),2.68(d,J=7.9 Hz,1H,5-H),2.56(m,1H,11-H),1.53~1.48(m,1H,9a-H),1.47(s,3H,14-H),1.46~1.41(m,1H,10a-H),1.34~1.29(m,1H,9b-H),1.28~1.24(m,1H,10b-H),1.08(d,J=6.8 Hz,3H,13-H),0.97(d,J=6.9 Hz,3H,12-H);13C NMR(150 MHz,CDCl3)δ:177.5,177.0,166.7,148.1,136.6,135.9,133.9,133.3,133.0,131.1,125.6,50.6,46.7,43.8,43.1,41.3,39.8,37.0,34.3,29.7,23.0,22.7,18.5,16.9;IR(KBr)ν:3356,3295,3096,1773,1701,1166 cm-1;MS(ESI)m/z:516.8{[M-H]+}。
α-蒎烯基m-硝基苯基磺酰胺(7i):白色固体,收率86%,m.p.69~70 ℃;1HNMR(600 MHz,CDCl3)δ:8.67(s,1H,20-H),8.41(d,J=8.2 Hz,1H,24-H),8.17(d,J=7.9 Hz,1H,22-H),7.74(t,J=8.0 Hz,1H,23-H),6.74(t,J=5.6 Hz,1H,CONH),6.39(t,J=6.0 Hz,1H,SNH),5.99(d,J=8.4 Hz,1H,8-H),5.91(d,J=8.5 Hz,1H,7-H),4.05(s,2H,15-H),3.36(m,2H,17-H),3.09(d,J=7.9 Hz,1H,2-H),3.08~3.04(m,2H,18-H),2.70(d,J=7.9 Hz,1H,5-H),2.59~2.46(m,1H,11-H),1.55~1.48(m,1H,9a-H),1.46~1.41(m,4H,10a-H,14-H),1.35~1.28(m,1H,9b-H),1.27~1.22(m,1H,10b-H),1.07(d,J=6.8 Hz,3H,13-H),0.97(d,J=7.0 Hz,3H,12-H);13C NMR(150 MHz,CDCl3)δ:177.9,177.3,167.1,148.5,142.1,136.6,135.9,132.8,130.7,127.3,122.4,50.6,46.8,43.8,42.7,41.2,39.9,37.1,34.3,29.8,23.0,22.7,18.5,17.0;IRν:3360,3293,3097,1770,1699,1169 cm-1;MS(ESI)m/z:516.8{[M-H]+}。
1.3 7a~7i的杀菌活性测试
参考文献[19],采用离体法(也称琼脂稀释法)测试目标产物的抑菌活性。
2 结果与讨论
2.1 合成
在中间体4的合成过程中,由于甘氨酸本身存在显弱碱性的氨基和显酸性的羧基,在溶剂中容易形成内盐而影响氮原子的亲核性,导致反应速率降低。故在DMF作溶剂的条件下,需加入与甘氨酸等摩尔的三乙胺与之成盐,再与加成物3反应,能明显加快反应进程。参考文献[18,20],本研究试用了冰醋酸和DMF作溶剂,发现以DMF作溶剂时,可得到化合物4。
2.2 表征
由FT-IR谱图(图略)可知,4在3100~3300 cm-1处的宽峰为羧基活泼氢的伸缩振动峰;3036 cm-1处特征峰为双键上碳氢键的伸缩振动峰;1751 cm-1处特征峰为碳氧双键伸缩振动峰;1677 cm-1处特征峰为碳碳双键的伸缩振动峰。在目标产物7a~7i的特征峰中,两个N—H键的伸缩振动吸收峰位于3360 cm-1和3295 cm-1附近;稍大于3000 cm-1的较小的吸收峰为不饱和碳C—H伸缩振动峰;1770 cm-1和1700 cm-1处特征峰为羰基C=O键的伸缩振动峰;1160 cm-1处特征峰为SO2的伸缩振动峰。
由1H NMR谱图(图略)可见,对于中间体4,双键C-7和C-8上氢的位移出现在δ5.9左右。对于目标产物7a~7i,双键C-7和C-8上氢的位移出现在δ5.9和δ6.0左右。两个N—H键受到苯环上取代基的影响,伸缩振动吸收峰出现在δ5.8~6.8。由于受羰基强吸电子影响,靠近羰基的氮上氢的电子云密度会比靠近SO2的氮上氢的电子云密度低,处于较低场区,所以前者氢的化学位移相对较高。15-H通常会受羰基吸电子影响使得化学位移增大而出现在δ4.1左右,其余饱和碳的氢的特征峰均在δ3.4以下。
由13C NMR谱图(图略)可知,对于中间体4,3个羰基碳均出现在低场区,化学位移达到δ165以上。双键上的碳则出现在δ135.7~136.7,其他饱和碳的化学位移均在δ60以下。对于目标产物7a~7i,增加的苯环上的碳主要出现在δ120~150处。C-4的峰位移比C-3稍大,因为C-3比较靠近富电子基团异丙基,电子云密度相对较大,所以C-3移向髙场,化学位移变低。
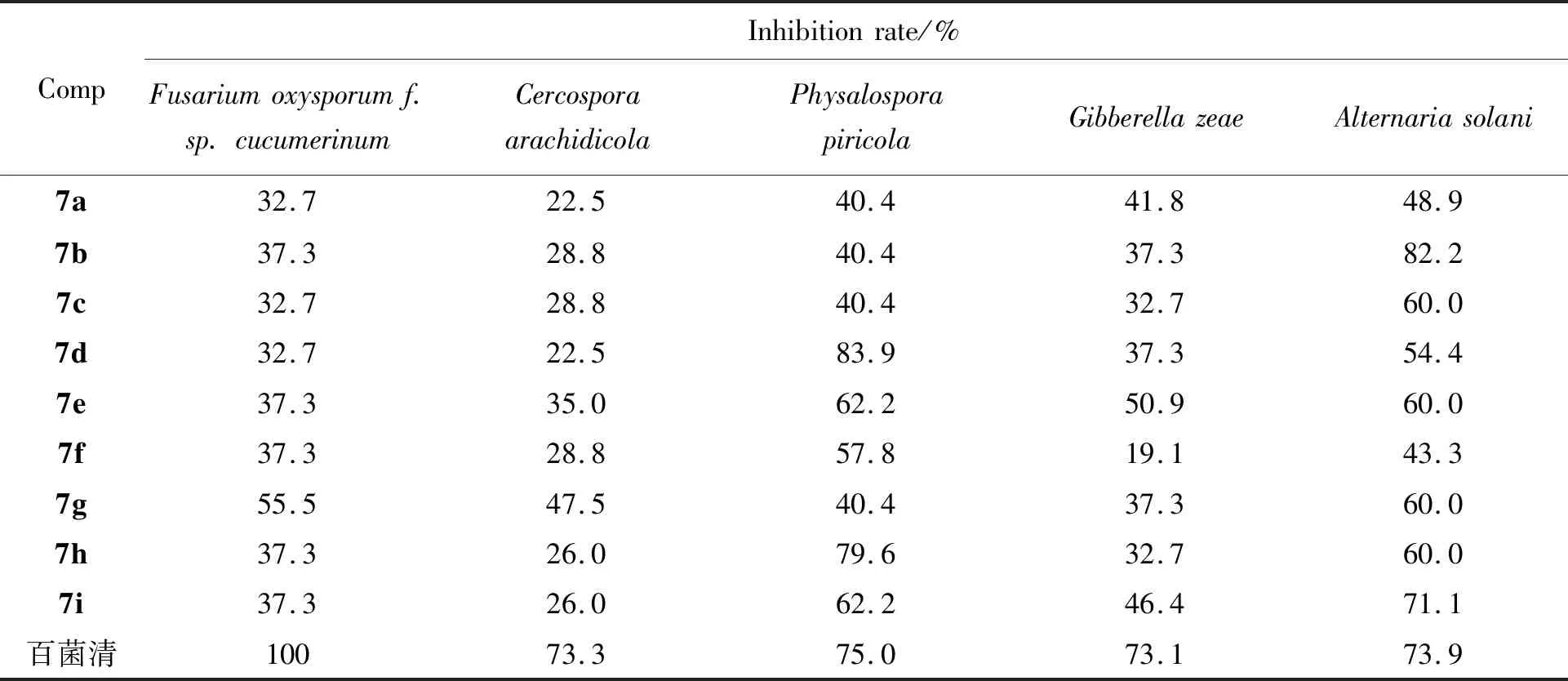
表 1 化合物 7a~7i 的抑菌活性*Table 1 Antifungal activities of compounds 7a~7i
*活性分级指标:A级:≥90%;B级:70~90%;C级:50~70%;D级:<50%。
2.3 抑菌活性
表1为7a~7i对黄瓜枯萎、花生褐斑、苹果轮纹、番茄早疫和小麦赤霉的抑制活性。由表1可知,在50 μg·mL-1浓度下,7a~7i对5种植物病菌都表现出一定的抑制活性,其中化合物7d(R=p-Cl)和7h(R=o-NO2)对苹果轮纹病菌的抑制率分别为83.9%和79.6%(B级活性水平),优于阳性对照百菌清(75.0%);化合物7b(R=m-Me)和7i(R=m-NO2)对番茄早疫病菌的抑制率分别为82.2%和71.1%(B级活性水平),前者优于阳性对照百菌清(73.9%)。
3 结论
以松节油的主要成分α-蒎烯为原料,合成了9个未见报道的α-蒎烯基苯磺酰胺类化合物(7a~7i)。初步的抑菌活性测试结果表明,化合物7d(R=p-Cl)和7h(R=o-NO2)对苹果轮纹病菌的抑制率分别为83.9%和79.6%,优于阳性对照百菌清;化合物7b(R=m-Me)对番茄早疫病菌的抑制率为82.2%,优于阳性对照百菌清。
致谢:抑菌活性测试由南开大学元素有机化学国家重点实验室生物活性测试室完成,谨表谢意!
