咪唑并[1,2-a]吡啶化合物的无溶剂合成及其抗氧化性能
2020-04-10席高磊陈芝飞杨金初蔡莉莉马波波张晓平
席高磊,陈芝飞,杨金初,蔡莉莉,马波波,杨 静*,张晓平
(1.河南中烟工业有限责任公司 技术中心,河南 郑州 450000;2.河南农业大学 烟草学院,河南 郑州 450002)
自由基引发的氧化损伤是导致衰老及多种疾病的直接原因[1],及时清除多余自由基是预防衰老和疾病的重要环节。目前,抗氧化研究已成为医药、食品、保健等领域的热门课题,相关研究主要集中于抗氧化化合物的设计和测试[2]。由于天然化合物具有低毒性及多样活性[3],其结构成为设计多种活性先导化合物的优先选择。

Scheme 1
咪唑并吡啶化合物是将咪唑和吡啶两种天然结构骨架集成于一个分子中的含氮稠杂环化合物,具有抗菌[4-5]、抗癌[6-7]、抗炎[8-9]等多种生理和药理活性。因此,咪唑并吡啶化合物的合成及生物活性探索成为研究热点之一[10-11]。然而关于咪唑并吡啶化合物的抗氧化性能的研究报道较少。Frett等[12-13]以2-氨基吡啶和卤代醛酮为原料,通过氨基和醛酮缩合及分子内环化反应合成了咪唑并吡啶化合物;Yadav等[14]采用相似的反应机理,以2-氨基吡啶与醛酮反应制备了一系列咪唑并吡啶化合物;Groebke、Blackburn及Bienaymé等3个研究小组[15-17]几乎同时报道了以2-氨基吡啶、醛和异氰为原料,采用三组分反应合成咪唑并吡啶化合物的方法。
由此,以G-B-B三组分法合成含氮稠杂环化合物成为热点。2014年,Lacerda等[18]以乙醇为溶剂,在室温下采用冰醋酸催化2-氨基吡啶、苯甲醛和异氰基乙酸乙酯之间发生反应合成了化合物1a,产率为65%,其是合成TNF-α抑制剂的重要中间体;2016年,Swami等[19]在80 ℃条件下,以甲苯为溶剂,In(OTf)3为催化剂,一锅法合成了化合物1d。近年来,本课题组[20]针对G-B-B三组分反应进行了深入研究,发现合成的二茂铁基咪唑并[1,2-a]吡啶化合物具有一定的抗氧化剂活性,并对化合物1a~1f的反应溶剂和催化剂进行了筛选,发现在乙醇溶剂中,采用LaCl3催化制备产率较高,产率为85%~95%[21]。
本文在课题组研究基础上,以2-氨基吡啶、芳香醛和异氰基乙酸乙酯为原料,LaCl3作催化剂,在无溶剂条件下实现了G-B-B三组分反应,高效合成了6个咪唑并[1,2-a]吡啶化合物(1a~1f,Scheme 1),产率89%~97%,其结构经1H NMR,13C NMR和HR-MS(ESI)确证。采用自由基氧化DNA的反应体系检测目标化合物抗氧化活性,并通过淬灭自由基实验考察其还原自由基能力,进而探究咪唑并[1,2-a]吡啶化合物的抗氧化构效关系。
1 实验部分
1.1 仪器与试剂
JH40型全自动熔点仪;UV1101型紫外可见分光光度计;Bruker Avance AMX-400 MHz型核磁共振仪(CDCl3或DMSO-d6为溶剂,TMS为内标);Agilent1290-micrOTOF Q II型高效液相色-质联用仪。
2-氨基吡啶,天津希恩思生化科技有限公司;异氰基乙酸乙酯,天津光复精细化学品有限公司;苯甲醛、水杨醛、3-羟基苯甲醛、4-羟基苯甲醛、2,4-二羟基苯甲醛、3,4-二羟基苯甲醛,北京化工厂;2-硫代巴比妥酸(TBA),国药集团化学试剂有限公司;还原型谷胱甘肽(GSH)、四氯氢醌(TCHQ),上海源叶生物科技有限公司;三氯乙酸(TCA)、乙二胺四乙酸二钠(EDTA),上海达瑞精细化学品有限公司;脱氧核糖核酸钠盐(DNA),Acros Organics公司;2,2′-偶氮-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐自由基(ABTS+·)、二苯苦味酰肼自由基(DPPH)、2,6-二叔丁基-(3,5-二叔丁基-4-氧代-2,5-环己二烯)-对-甲苯氧自由基(galvinoxyl),美国Sigma-Aldrich公司;其余所用试剂均为分析纯。
1.2 1a~1f的合成通法
将2-氨基吡啶0.09 g(1.0 mmol)、芳香醛(1.0 mmol)、异氰基乙酸乙酯0.14 g(1.2 mmol)和LaCl30.03 g(1.0 mmol)加入25 mL圆底烧瓶中,搅拌下于80 ℃(浴温)反应2 h(TLC检测)。冷却至室温,经硅胶柱层析[洗脱剂:V(乙酸乙酯)/V(石油醚)=1/3]纯化得1a~1f。
2-{(2-苯基咪唑并[1,2-a]吡啶-3-基)氨基}乙酸乙酯(1a):黄色油状液体,产率97%;1H NMR(CDCl3,400 MHz)δ:8.22(d,J=6.8 Hz,1H),8.04(d,J=7.2 Hz,2H),7.54(d,J=8.8 Hz,1H),7.44(t,J=8.0 Hz,2H),7.32(d,J=7.6 Hz,1H),7.13(t,J=8.0 Hz,1H),6.78(t,J=6.8 Hz,1H),4.19(dd,J=7.2 Hz,14.4 Hz,2H),3.80(d,J=4.8 Hz,2H),3.76(d,J=5.2 Hz,1H),1.24(t,J=7.2 Hz,3H);13C NMR(CDCl3,100 MHz)δ:171.8,141.6,135.9,134.1,128.6,127.4,126.9,126.6,124.8,124.1,122.8,117.4,111.7,101.6,61.3,49.4,14.1;HR-MS(ESI)m/z:Calcd for C17H17N3O2{[M+H]+}296.1399,found 296.1421。
2-【{2-(2-羟基苯基)咪唑并[1,2-a]吡啶-3-基}氨基】乙酸乙酯(1b):黄色固体,产率94%,m.p.50~52 ℃;1H NMR(CDCl3,400 MHz)δ:8.32(d,J=6.8 Hz,1H),7.97(d,J=8.0 Hz,1H),7.46(d,J=8.8 Hz,1H),7.17~7.23(m,2H),7.01(d,J=8.0 Hz,1H),6.84~6.89(m,2H),4.19(dd,J=7.2 Hz,14.0 Hz,2H),3.81(d,J=4.8 Hz,2H),3.77(d,J=4.4 Hz,1H),1.24(t,J=7.2 Hz,3H);13C NMR(CDCl3,100 MHz)δ:171.6,157.3,139.0,134.7,128.9,125.9,124.8,123.4,122.6,118.7,117.2,116.7,115.9,112.1,61.1,48.8,13.9;HR-MS(ESI)m/z:Calcd for C17H17N3O3{[M+H]+}312.134 8,found 312.137 0。
2-【{2-(3-羟基苯基)咪唑并[1,2-a]吡啶-3-基}氨基】乙酸乙酯(1c):淡黄色固体,产率94%,m.p.85~87 ℃;1H NMR(DMSO-d6,400 MHz)δ:9.38(s,1H),8.47(d,J=6.8 Hz,1H),7.55~7.57(m,2H),7.44(d,J=8.8 Hz,1H),7.23 (t,J=8.0 Hz,1H),7.14~7.19(m,1H),6.88(td,J=1.2 Hz,J=7.2 Hz,1H),6.69~6.71(m,1H),5.36(t,J=6.0 Hz,1H),4.00(dd,J=7.2 Hz,14.0 Hz,2H),3.80(d,J=6.4 Hz,2H),1.08(t,J=7.2 Hz,3H);13C NMR(DMSO-d6,100 MHz)δ:172.2,158.0,140.7,136.1,133.7,129.8,126.7,124.4,124.2,117.8,116.9,114.6,114.0,111.4,60.8,49.3,14.3;HR-MS(ESI)m/z:Calcd for C17H17N3O3{[M+H]+}312.1348,found 312.1361。
2-【{2-(4-羟基苯基)咪唑并[1,2-a]吡啶-3-基}氨基】乙酸乙酯(1d):黄色固体,产率96%,m.p.222~224 ℃;1H NMR(DMSO-d6,400 MHz)δ:9.47(s,1H),8.42(d,J=6.8 Hz,1H),7.93(d,J=8.8 Hz,2H),7.41(d,J=9.2 Hz,1H),7.11~7.15(m,1H),6.82~6.87(m,3H),5.24(t,J=6.0 Hz,1H),3.99(dd,J=7.2 Hz,14.0 Hz,2H),3.76(d,J=6.4 Hz,2H),1.08(t,J=7.2 Hz,3H);13C NMR(DMSO-d6,100 MHz)δ:172.2,157.1,140.7,134.5,128.3,125.9,125.3,124.2,123.9,116.7,115.7,111.2,60.7,49.2,14.4;HR-MS(ESI)m/z:Calcd for C17H17N3O3{[M+H]+}312.1348;found 312.1371。
2-【{2-(2,4-二羟基苯基)咪唑并[1,2-a]吡啶-3-基}氨基】乙酸乙酯(1e):黄色固体,产率89%,m.p.97~99 ℃;1H NMR(DMSO-d6,400 MHz)δ:12.91(s,1H),9.47(s,1H),8.53(d,J=6.8 Hz,1H),7.97(d,J=8.4 Hz,1H),7.53(d,J=9.2 Hz,1H),7.28(t,J=8.0 Hz,1H),7.01(t,J=6.8 Hz,1H),6.35(dd,J=2.8 Hz,8.8 Hz,1H),6.29(d,J=2.8 Hz,1H),5.37(t,J=6.0 Hz,1H),4.02(dd,J=6.8 Hz,14.0 Hz,2H),3.80(d,J=6.0 Hz,2H),1.09(t,J=6.8 Hz,3H);13C NMR(DMSO-d6,100 MHz)δ:171.6,158.2,138.4,133.5,127.5,124.8,123.7,123.6,115.3,111.8,108.7,106.8,103.1,60.3,48.5,13.9;HR-MS(ESI)m/z:Calcd for C17H17N3O4{[M+H]+}328.129 7,found 328.132 1。
2-【{2-(3,4-二羟基苯基)咪唑并[1,2-a]吡啶-3-基}氨基】乙酸乙酯(1f):黄色固体,产率92%,m.p.169~171 ℃;1H NMR(DMSO-d6,400 MHz)δ:8.93(s,2H),8.43(d,J=6.8 Hz,1H),7.55(d,J=2.0 Hz,1H),7.38~7.41(m,2H),7.10~7.14(m,1H),6.85(td,J=1.2 Hz,J=7.2 Hz,1H),6.78(d,J=8.4 Hz,1H),5.22(t,J=6.0 Hz,1H),4.00(dd,J=7.2 Hz,14.0 Hz,2H),3.77(d,J=6.0 Hz,2H),1.08(t,J=7.2 Hz,3H);13C NMR(DMSO-d6,100 MHz)δ:171.8,145.2,144.7,140.0,133.9,125.8,124.9,123.7,123.3,117.9,116.1,115.6,114.2,110.6,60.3,48.7,13.9;HR-MS (ESI)m/z:Calcd for C17H17N3O4{[M+H]+}328.1297,found 328.1323。

Chart 1
1.3 抗氧化性能测试
参考文献方法测试化合物抑制HO·引发的氧化反应体系效果[22]与抑制GS·引发的氧化反应体系效果[23]。
1.4 捕获自由基性能测试
ABTS+·为N-(Chart1)中心自由基,可测试酚羟基还原自由基的能力。DPPH·也是一个N-中心自由基,可检测抗氧化剂将自身的氢原子给予N-中心自由基的能力和抗氧化剂中单电子给予N-中心自由基的能力。galvinoxyl自由基是一个O-中心自由基,可用于检测抗氧化剂将氢原子或电子给予O-中心自由基的能力。参考文献[24-26]方法,测定了ABTS+·浓度、DPPH·浓度和galvinoxyl浓度随时间的变化曲线。
1.5 数据统计与分析
采用Origin 8.0软件对数据进行ANOVA方差分析,显著性检验方法为Duncan多重检验,显著水平为0.05。
2 结果与讨论
2.1 合成
以化合物1a的合成为例,探讨了反应条件对化合物1a产率的影响,结果见表1。由表1可以看出,在无溶剂条件下,以LaCl3为催化剂,80 ℃加热反应2 h,是合成目标化合物的较佳方法,化合物1a的产率为97%,高于文献[21]方法产率。
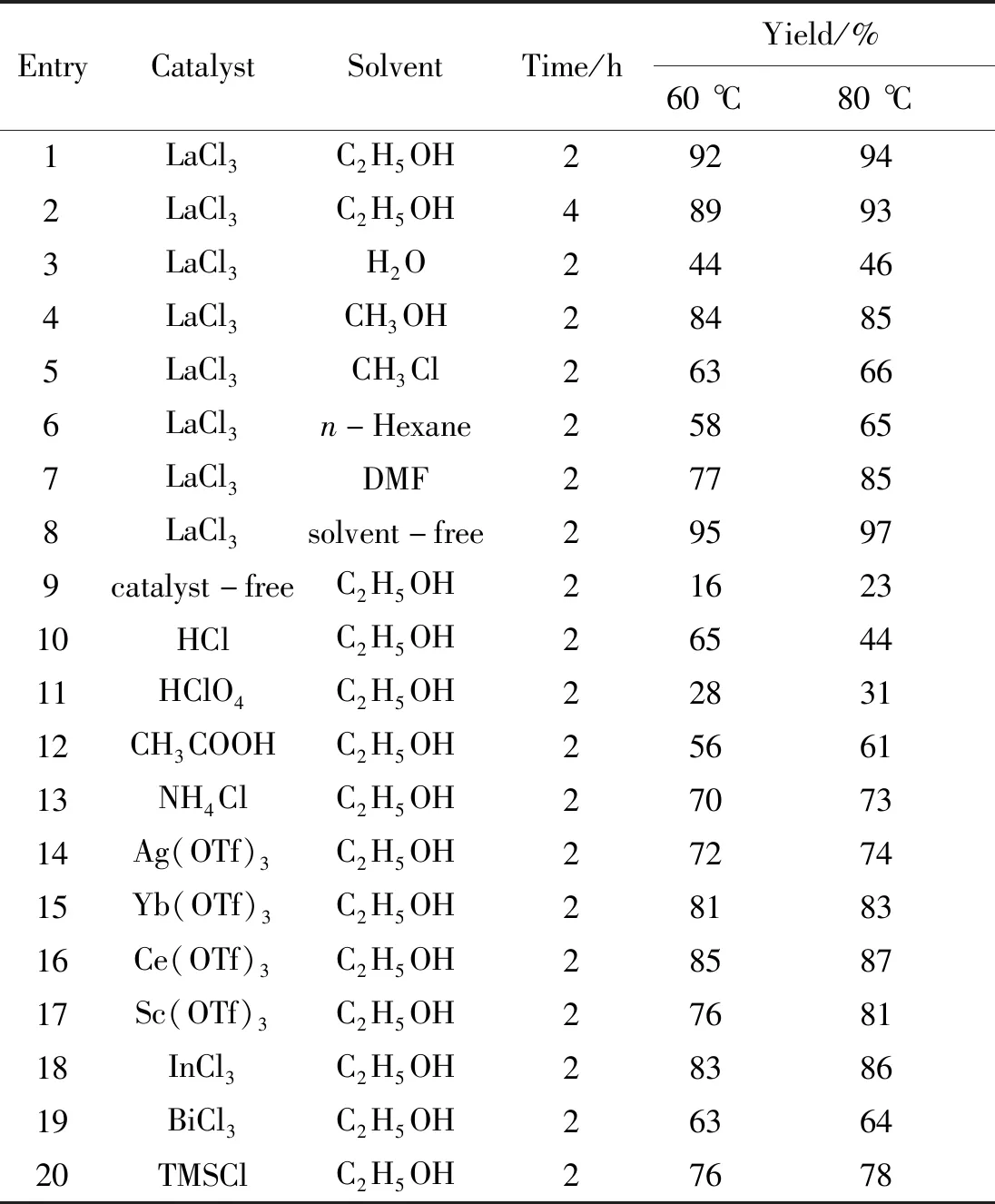
表1 反应条件对1a产率的影响Table 1 The influences of reaction conditions on yield of 1a
2.2 抑制自由基引发的DNA氧化反应性能
在自由基引发的DNA氧化反应体系中,自由基可以氧化DNA生成小分子羰基化合物——硫代巴比妥酸活性物质(TBARS)[27]。TBARS可以与硫代巴比妥酸(TBA)在酸性(三氯乙酸)条件下反应生成有色物质,最大吸光波长为535 nm[28]。因此,通过检测DNA氧化反应过程中产生TBARS的量,可以很方便地监测DNA氧化反应的程度。加入待测化合物后,通过检测DNA氧化反应过程中产生TBARS量的变化即可评估化合物的抗氧化性能[29]。

图1 1a~1f抑制HO·引发的DNA氧化反应性能Figure 1 The activities ladder diagram of 1a~1f in inhibiting HO·induced oxidation of DNA
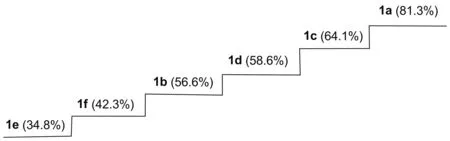
图 2 1a~1f抑制GS·引发的DNA氧化反应性能Figure 2 The activities ladder diagram of 1a~1f in inhibiting GS·induced oxidation of DNA
(1) 抑制HO·引发的DNA氧化反应体系
由图1可见,6个化合物的TBARS百分数均低于空白组(100%),表明6个化合物均具备抑制HO·引发DNA氧化反应的能力。初步构效分析表明,在化合物1a苯环上引入推电子基团(OH)得到化合物1b、1c和1d,其TBARS百分数分别为45.5%、56.8%和51.6%,均远低于化合物1a的TBARS百分数(72.1%),说明OH有利于咪唑并[1,2-a]吡啶化合物保护DNA免受HO·引发的氧化损伤[30]。同时,化合物1b、1c和1d的TBARS百分数遵循“间位>对位>邻位”(OH位置)的顺序,说明OH处于邻位时最有利于提高化合物活性。在单羟基咪唑并[1,2-a]吡啶化合物中继续引入一个OH后,所得化合物1e和1f的TBARS百分数进一步降低,达到了32.2%和39.4%,说明咪唑并[1,2-a]吡啶化合物抑制HO·引发DNA氧化反应的性能随羟基数目增加而增强。其中,双羟基化合物1e的TBARS百分数明显小于化合物1f的TBARS百分数,说明两个OH处在邻、对位时更有利于咪唑并[1,2-a]吡啶抑制HO·引发的DNA氧化反应,主要原因是由于化合物1f中的两个处在相邻的位置,形成分子内氢键,使得羟基上的氢原子与另一个羟基中的氧原子之间产生相互作用,不易被HO·夺取,使该化合物的抗氧化性能有所下降[31]。
(2) 抑制GS·引发的DNA氧化反应体系
由图2可见,6个化合物的TBARS百分数均低于空白组(100%),表明目标化合物也具备抑制GS·引发DNA氧化反应的能力。初步构效分析表明,化合物1a的TBARS百分数为81.3%,而含羟基咪唑并[1,2-a]吡啶化合物1b~1f的TBARS百分数均明显低于化合物1a的81.3%,且都在65%以下,说明酚羟基作为传统抗氧化基团,也能够有效提高咪唑并[1,2-a]吡啶化合物抑制GS·引发的DNA氧化反应能力。其中,单羟基化合物1b的TBARS百分数(56.6%)小于单羟基化合物1c和1d的TBARS百分数(64.1%和58.6%),说明羟基处于邻位最有利于提高化合物抑制GS·引发的DNA氧化反应性能,与HO·引发的DNA氧化反应实验结果相同。双羟基化合物1e和1f的TBARS百分数分别为34.8%和42.3%,远小于单羟基化合物的TBARS百分数,说明OH之间存在协同作用,能够进一步提高咪唑并[1,2-a]吡啶化合物的抗氧化作用。化合物1e的TBARS百分数最小,说明两个OH处在邻、对位时咪唑并[1,2-a]吡啶具有更强的抑制GS·引发的DNA氧化反应活性,与其抑制HO·引发DNA的氧化反应结果类似。

t/s图3 1a~1f捕获ABTS+·性能Figure 3 The activities of 1a~1f on trapping ABTS+·
2.3 捕获自由基性能分析
(1) 捕获ABTS+·结果分析[32]
以ABTS+·浓度为纵坐标,反应时间为横坐标,作浓度随时间的衰减曲线,如图3所示。由图3可见,空白实验中,随着反应时间的增长,ABTS+·浓度始终不变,当加入浓度为10 mol/L的化合物1a~1f后,ABTS+·浓度随反应时间的增长逐渐减小,说明6个咪唑并[1,2-a]吡啶化合物均能够提供电子与ABTS+·孤对电子配对,从而展现捕获ABTS+·的能力。其中,化合物1a分子中无特征抗氧化官能团,却能够捕获ABTS+·,其原因可能是化合物分子中的仲胺可以给出氢原子,从而淬灭ABTS+·,并生成N-中心自由基,生成的N-中心自由基可以通过共振式分散N-中心自由基(Scheme 2),从而稳定自由基单电子,发挥了相当于羟基的抗氧化性能。在加入单羟基化合物1b、1c和1d体系中,ABTS+·浓度随时间的衰减曲线低于含有化合物1a的体系,在加入双羟基化合物1e和1f体系中,ABTS+·浓度随时间的衰减曲线进一步降低,说明羟基是有效的抗氧化官能团,能够有效地提高咪唑并[1,2-a]吡啶化合物捕获ABTS+·的能力,且随羟基数目的增加,化合物捕获ABTS+·的能力不断增强。另外,对比发现,在加入单羟基化合物1b体系中,ABTS+·浓度随时间的衰减曲线低于单羟基化合物1c和1d的体系,说明化合物1b具有更强的捕获ABTS+·的能力,即羟基处于邻位更有利于化合物与ABTS+·孤对电子配对。在加入双羟基化合物1e体系中,ABTS+·浓度随时间的衰减曲线低于双羟基化合物1f的体系,说明化合物1e具有更强的捕获ABTS+·的能力,所得结论与抑制自由基引发的DNA氧化反应体系分析结果一致,即两个羟基处在邻、对位时咪唑并[1,2-a]吡啶具有更强地捕获ABTS+·的能力。

Scheme 2
(2) 捕获DPPH·结果分析
以DPPH·浓度为纵坐标,反应时间为横坐标,作浓度随时间的衰减曲线(图略)。由图分析可知,加入浓度为20mol/L的化合物1a~1f后,DPPH·浓度随反应时间的增长逐渐降低,说明6个咪唑并[1,2-a]吡啶化合物也能够提供电子与DPPH·孤对电子配对,展现捕获DPPH·的能力。其中,在加入羟基化合物1b~1f体系中,DPPH·浓度随时间的衰减曲线明显低于含有化合物1a的体系,且在加入双羟基化合物1e和1f体系中,DPPH·浓度随时间的衰减曲线还低于单羟基化合物1b、1c和1d体系,说明羟基是有效的抗氧化官能团,能够有效地提高咪唑并[1,2-a]吡啶化合物捕获DPPH·的能力,且随羟基数目的增加,化合物捕获DPPH·的能力不断增强,所得结论与捕获ABTS+·结果一致,说明咪唑并[1,2-a]吡啶化合物分子中酚羟基也可以给出H原子与DPPH·孤对电子配对,从而提高化合物捕获DPPH·的能力。另外,与捕获ABTS+·反应结果不同的是在加入单羟基化合物1d体系中,DPPH·浓度随时间的衰减曲线低于单羟基化合物1b和1c的体系,说明化合物1d具有更强的捕获DPPH·的能力,即羟基处于对位最有利于化合物淬灭DPPH·。在加入双羟基化合物1e体系中,DPPH·浓度随时间的衰减曲线低于双羟基化合物1f的体系,是6个化合物中最低的,说明化合物1e具有更强的捕获DPPH·的能力,即两个酚羟基处于邻、对位时更有利于咪唑并[1,2-a]吡啶淬灭DPPH·,与捕获ABTS+·结果一致。此外,文献[33]报道了7个羟基咪唑并[1,2-a]吡啶化合物捕获DPPH·百分数分别为85%、57%、38%、89%、86%、90%和78%,采用相同方法求得的咪唑并[1,2-a]吡啶化合物1a~1f捕获DPPH·百分数分别为84.2%、91.1%、91.9%、93.4%、96.7%和95.3%。
(3) 捕获galvinoxyl结果分析
以galvinoxyl浓度为纵坐标,反应时间为横坐标,作浓度随时间的衰减曲线(图略)。由图可知,加入浓度为200mol/L的化合物1b~1f后,galvinoxyl自由基浓度随反应时间的增长逐渐降低,说明只有连有羟基的咪唑并[1,2-a]吡啶化合物才能捕获galvinoxyl自由基,而无羟基化合物1a则不能提供电子与galvinoxyl自由基的孤对电子配对,不具有淬灭galvinoxyl自由基的能力,即在与galvinoxyl反应中,羟基是一个必需的官能团,仲胺基团在此不能发挥类似的作用。在加入单羟基化合物1b、1c和1d体系中,化合物1d对应的galvinoxyl自由基浓度随反应时间变化降低最快,说明化合物1d具有更强的捕获galvinoxyl自由基的能力,即羟基处于对位最有利于化合物淬灭galvinoxyl自由基,与捕获DPPH·结果一致。在加入双羟基化合物1e和1f体系中,galvinoxyl自由基浓度随时间的衰减曲线低于单羟基化合物1b、1c和1d体系。其中,在加入化合物1e体系中,galvinoxyl自由基浓度随时间的衰减曲线低于化合物1f的体系,也是6个化合物中最低的,说明随羟基数目的增加,化合物捕获galvinoxyl自由基的能力不断增强,且两个酚羟基处在邻、对位时更有利于咪唑并[1,2-a]吡啶淬灭galvinoxyl,与抑制自由基引发的DNA氧化反应及捕获其它自由基结果一致,是由于两个酚羟基处在邻位形成分子内氢键降低了淬灭galvinoxyl的活性。
在无溶剂条件下,经Groebke-Blackburn-Bienaymé三组分反应高效制备了6个咪唑并[1,2-a]吡啶化合物(1a~1f),采用抑制HO·和GS·自由基引发的DNA氧化反应研究了化合物的抗氧化活性,并通过淬灭ABTS+·、DPPH·和galvinoxyl自由基实验考察了目标化合物还原自由基的能力。结果表明,6种目标化合物不仅能够很好地抑制HO·和GS·引发的DNA氧化反应,也能够很好地捕获ABTS+·和DPPH·两种自由基,且含有羟基的咪唑并[1,2-a]吡啶化合物还能够捕获galvinoxyl自由基,是一类潜在的抗氧化剂。其中,化合物1e抗氧化活性最好,其抑制HO·和GS·引发的DNA氧化反应TBARS百分数分别为32.2%和34.8%。
