STF-31对前列腺癌PC-3细胞增殖及凋亡的影响
2020-04-09汤玉锐熊言骏
姚 越,张 冲,韩 兵,汤玉锐,熊言骏,汪 盛
(蚌埠医学院第一附属医院泌尿外科,蚌埠 233000;*通讯作者,E-mail:bydoctorw@163.com)
前列腺癌(prostate cancer)是老年男性泌尿生殖系统最常见的恶性癌症之一[1],目前国际上在治疗前列腺癌方面已经取得了重要的治疗进展,恩杂鲁胺、阿比特龙和卡巴他赛等药物已扩大了治疗药库[2]。研究报道,我国前列腺癌的发病率和死亡率近年来呈逐渐上升趋势[3,4],前列腺癌发生发展的分子机制尚未完全阐明[5,6],仍然缺乏持续有效的治疗策略,严重威胁患者的身心健康,因此,寻找新的能够治疗前列腺癌的药物成为关键。
近来,已经对癌细胞中的葡萄糖代谢进行了深入研究。据报道,几乎所有癌细胞都可以激活葡萄糖的摄取[7,8],癌细胞对葡萄糖摄取异常增加,并且对葡萄糖浓度的变化敏感[9]。因此,靶向消耗肿瘤细胞的葡萄糖是开发更有效抗癌药物的有前途的方法[10-12]。癌细胞中葡萄糖摄取的增加主要归因于葡萄糖转运体1(glucose transporter 1,GLUT1)的上调,这几乎是所有细胞类型中基础葡萄糖转运上升的原因[13,14]。
STF-31是一种特异性靶向GLUT-1抑制剂,能够特异性地与GLUT1相互结合而抑制细胞葡萄糖摄取进而抑制细胞增殖和诱导细胞凋亡。目前尚未有STF-31对前列腺癌PC-3细胞作用的实验研究,本实验旨在研究STF-31对PC-3细胞增殖抑制及凋亡的影响,并探讨其诱导凋亡可能机制。
1 材料与方法
1.1 实验材料和试剂
人前列腺癌PC-3细胞购自上海细胞库,STF-31购自Selleck中国公司,DMEM培养基、胰蛋白酶购自美国Hyclone公司,胎牛血清(fetal bovine serum,FBS)购自浙江天杭生物科技股份有限公司,MTT试剂、乳酸、葡萄糖摄取试剂盒、ATP试剂盒、Annexin Ⅴ-FITC/PI双染试剂盒购于上海碧云天有限责任公司,Bax、Bcl-2、cleaved caspase-3蛋白抗体购自美国CST公司。
1.2 细胞培养
人前列腺癌PC-3细胞培养在含10%胎牛血清、100 mg/L链霉素、100 U/ml青霉素的DMEM培养基中,放置于37 ℃、5% CO2饱和湿度的细胞恒温培养箱中常规培养。
1.3 MTT测定细胞增殖
将PC-3细胞制成单细胞悬液,每孔1×104个细胞接种于6孔板中,待细胞贴壁,加入浓度分别为0,4,8,16 μmol/L的STF-31,于24,48,72 h时每孔加入15 μl MTT溶液,放入培养箱中孵育4 h,小心吸去培养液,每孔加入150 μl DMSO,置于37 ℃培养箱继续孵育30 min待甲臜完全溶解,在490 nm波长处用酶联免疫检测仪测吸光度值(OD490 nm),计算细胞存活率:细胞存活率(%)=实验组OD490 nm/对照组OD490 nm×100%。取各组数据的平均值绘制药物时间剂量效应图,利用SPSS21.0统计软件计算药物的半数抑制浓度(IC50)。
1.4 Annexin Ⅴ-FITC/PI双染法检测细胞凋亡
将PC-3细胞制成单细胞悬液,每孔3×105个细胞接种于6孔板中,待细胞贴壁,加入浓度分别为0,4,8,16 μmol/L的STF-31,给药24 h收集细胞,离心后每孔加入500 μl缓冲液重悬细胞,加入10 μl Annexin Ⅴ-FITC混匀,冰上孵育15 min,之后每孔加15 μl PI染色剂,1 h内检测细胞凋亡情况,并将实验重复3次。
1.5 细胞内ATP水平的检测
将PC-3细胞制成单细胞悬液,每孔3×105个细胞接种于6孔板中,待细胞贴壁,加入浓度分别为0,4,8,16 μmol/L的STF-31,作用6 h,离心收集细胞,弃去上清液。每个孔加入200 μl裂解液裂解20 min,剧烈涡旋以完全裂解细胞。使用4 ℃离心机以12 000 r/min将混合物离心5 min,并将上清液(保留在冰上)用于后续分析,裂解液中的蛋白质浓度通过BCA蛋白测定试剂盒进行定量,每个样品中加入100 μl ATP工作液(ATP检测原液 ∶稀释液=1 ∶9),并在室温下放置5 min(使反应在黑暗中进行),使背景ATP全部消耗,立即向每孔添加20 μl样品,用酶标仪测量吸光度,并将实验重复3次。
1.6 乳酸的测定
将PC-3细胞制成单细胞悬液,每孔3×105个细胞接种于6孔板中,待细胞贴壁,加入浓度分别为0,4,8,16 μmol/L的STF-31,给药24 h,然后收集细胞,重悬于适量的裂解物中,并转移至1.5 ml EP管中。将细胞在-20 ℃下裂解3次,并在4 ℃下以12 000 r/min离心30 min,上清液参照乳酸测定试剂盒步骤(BioVision)进行测试,并将实验重复3次。
1.7 细胞葡萄糖摄取的检测
将PC-3细胞制成单细胞悬液,每孔3×105个细胞接种于6孔板中,待细胞贴壁,加入浓度分别为0,4,8,16 μmol/L的STF-31,给药24 h,吸取原培养基,PBS洗两次,换成不含葡萄糖的培养基饥饿细胞2 h,每孔加入1 mg/ml 2-NBDG溶液50 μl,37 ℃孵育30 min,PBS洗两次,使用多功能酶标仪检测(激发波长465 nm,发射波长540 nm),实验重复3次。
1.8 Western blot法检测Bax、Bcl-2、cleaved caspase-3蛋白表达水平
将PC-3细胞制成单细胞悬液,每孔3×105个细胞接种于6孔板中,待细胞贴壁,加入浓度分别为0,4,8,16 μmol/L的STF-31,给药48 h收集细胞,冰上裂解30 min,12 000 r/min离心30 min,吸取上清液,每组样取60 μg蛋白进行SDS-PAGE电泳;蛋白转至聚偏氟乙烯(PVDF)膜;快速封闭液封闭15 min;分别加一抗(Bax、Bcl-2、cleaved caspase-3,抗体 ∶一抗稀释液=1 ∶1 000)4 ℃孵育过夜;二抗(兔抗)室温下孵育2 h;ECL试剂盒暗室发光显影,Bio-Rad-Image-Lab-6.0凝胶成像系统获取图像。
1.9 统计分析方法
实验数据采用SPSS21.0统计软件进行统计分析,实验数据均以均数±标准差表示,多组比较采用单因素方差分析及两因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 STF-31对PC-3细胞增殖抑制作用
MTT分析结果表明,随着STF-31浓度的增加,PC-3细胞的存活率下降(P<0.05),以及随着STF-31作用时间的延长,PC-3细胞的存活率下降(P<0.05,见图1),与0 μmol/L相比,差异具有统计学意义。不同浓度STF-31处理PC-3细胞24,48,72 h的IC50值分别为20.8 μmol/L,8.26 μmol/L,4.36 μmol/L。
2.2 STF-31对PC-3细胞凋亡的影响
Annexin Ⅴ-FITC/PI双染法检验给药后PC-3细胞凋亡,结果显示,对照组总凋亡率为(4.36±0.39)%,4,8,16 μmol/L STF-31组总凋亡率分别为(8.21±2.8)%,(16.9±1.2)%,(34.2±1.7)%,差异具有统计学意义(P<0.05,见图2)。

与0 μmol/L比较,*P<0.05,**P<0.01图1 STF-31对PC-3细胞增殖抑制作用Figure 1 Inhibitory effect of STF-31 on PC-3 cell proliferation
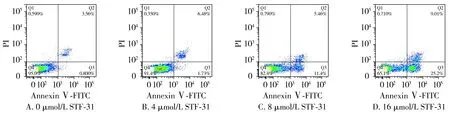
图2 STF-31对PC-3细胞凋亡的影响Figure 2 Effect of STF-31 on PC-3 cell apoptosis
2.3 STF-31对PC-3细胞葡萄糖摄取和ATP的影响
葡萄糖摄取测定的结果表明,随着STF-31浓度的增加,PC-3细胞葡萄糖摄取逐渐减少。STF-31可以诱导PC-3细胞中葡萄糖摄取的能力分别从基线的100%降至(84.3±1.1)%,(65.2±2.1)%和(53.7±2.4)%(P<0.05,见图3)。同时,STF-31可以诱导PC-3细胞中ATP水平分别从基线的100%降至(80.1±2.1)%,(60.2±1.9)%和(48.7±1.34)%(P<0.05,见图3)。这些结果表明,STF-31可以通过抑制PC-3细胞葡萄糖摄取从而抑制PC-3细胞的能量代谢。
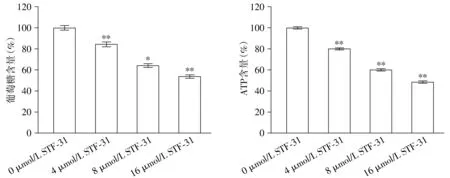
与0 μmol/L比较,*P<0.05,**P<0.01图3 STF-31对PC-3细胞葡萄糖摄取和ATP的影响Figure 3 Effect of STF-31 on glucose uptake and ATP in PC-3 cells
2.4 STF-31对PC-3细胞乳酸的影响
随着STF-31浓度的增加,PC-3细胞胞内乳酸逐渐减少,乳酸含量分别从基线的100%降至(90.1±2.1)%,(75.4±1.3)%和(63.4±2.7)%(P<0.05,见图4)。

与0 μmol/L比较,*P<0.05,**P<0.01图4 STF-31对PC-3细胞乳酸的影响Figure 4 Effect of STF-31 on lactic acid in PC-3 cells
2.5 STF-31对PC-3细胞Bax、Bcl-2、cleaved caspase-3蛋白表达的影响
为了进一步研究STF-31对PC-3细胞凋亡的可能机制,通过蛋白质印迹评估了凋亡相关蛋白Bax、Bcl-2、cleaved caspase-3的表达,随着STF-3浓度的增加,凋亡相关蛋白cleaved caspase-3(caspase-3的裂解产物)和促凋亡蛋白Bax的蛋白水平增加,而抑凋亡蛋白Bcl-2减少(P<0.05,见图5),表明STF-31可以诱导PC-3细胞凋亡,其凋亡机制与凋亡蛋白Bcl-2表达下调和Bax、cleaved caspase-3表达上调有关。
3 讨论
与正常的非增殖细胞相比,癌细胞显示出了特殊的代谢要求[15,16],近年来,抑制癌细胞特异性代谢成为治疗癌症的热点[17]。首先集中在Warburg效应上,癌细胞通过低效率的葡萄糖发酵生成乳酸盐而不是通过线粒体氧化三羧酸循环或氧化磷酸化来生存[18]。目前,在糖酵解过程中靶向葡萄糖转运及其代谢被认为是一种有前景的癌症治疗策略[19]。在人类中,GLUT(葡萄糖转运蛋白)家族由13个与结构相关的成员组成,其中GLUT1在正常细胞中最普遍表达[20],在癌症中,GLUT1是葡萄糖转运蛋白的主要过表达亚型[21]。
STF-31作为一种特异性靶向GLUT-1抑制剂,能够特异性与GLUT1结合而抑制葡萄糖转运,在本实验中,STF-31同样可以抑制PC-3细胞的葡萄糖摄取,而影响PC-3细胞ATP的产生,正常的非增殖细胞仅在厌氧条件下会产生大量的乳酸,而大多数癌细胞却会在无氧条件下和线粒体功能正常的情况下产生乳酸。大量的乳酸会使肿瘤细胞处于酸性环境,与病人体内肿瘤细胞远处器官转移和较短的总体生存期具有相关性[22]。癌细胞通常利用乳酸作为生长增殖和线粒体代谢的物质,并可生成丙氨酸和谷氨酰胺[23]。

与0 μmol/L比较,*P<0.05图5 STF-31对PC-3细胞Bax、Bcl-2、cleaved caspase-3蛋白表达的影响Figure 5 Effect of STF-31 on Bax, Bcl-2, cleaved caspase-3 protein expression in PC-3 cells
本研究结果表明,STF-31能够抑制PC-3细胞乳酸的产生,而且STF-31能够显著诱导PC-3细胞凋亡,为了验证出STF-31诱导PC-3细胞凋亡可能机制,使用Western blot法检测凋亡相关蛋白Bax、Bcl-2、cleaved caspase-3的表达,结果表明,STF-31能够抑制PC-3细胞中Bax、Bcl-2、cleaved caspase-3的表达。综上,STF-31对PC-3具有增殖抑制及诱导凋亡作用,凋亡机制可能为:STF-31通过抑制PC-3细胞葡萄糖摄取而抑制PC-3细胞的能量代谢达到抑制细胞凋亡的目的。
