杨树HDA902基因在低温胁迫应答反应中的功能
2020-04-08李开隆夏德安马旭俊
关 韬 刘 超 李开隆 夏德安 马旭俊
(东北林业大学林木遗传育种国家重点实验室,哈尔滨 150040)
环境温度的季节性波动影响植物生长和发育的各个方面,严重限制植物的繁殖和地理分布[1]。在自然环境的温度变化中,低温是影响植物生长发育的重要条件[2]。在植物的整个成长过程中,低温会对其产生许多不利影响,在早期生长的关键时期尤为明显。短期内的温度突然下降或低温期的延长将影响植物的光合作用,使植物的光能吸收效率和利用效率有所下降。植物的正常生长发育受其影响,导致产量和品质下降[3]。通过植物基因工程的方法改良植物是提高其低温耐受能力的重要手段之一[4]。植物对压力的反应是生理、生化和结构的变化,而许多基因的表达也会发生变化。在真核生物中,基因表达的表观遗传调控在各种发育过程和应激反应中起着至关重要的作用。其中一个重要的表观遗传调控是染色质修饰[5]。
组蛋白去乙酰化酶(HDAC)在酵母、动物和植物中广泛存在,是一个超基因家族。根据植物与酵母HDAC序列的同源性比较,可以把植物HDAC分为RPD3/HDA1、SIR2和HD2三个亚家族。RPD3/HDA1亚家族成员的酶活性取决于细胞中是否含有Zn2+,属于Zn2+依赖型组蛋白去乙酰化酶。植物在整个生长发育过程中,随着RPD3/HDA1亚家族基因表达水平的上调或下降,植物的表型也会发生相应改变[6~7]。该家族中的组蛋白去乙酰化酶参与调节植物在生物胁迫(病虫害)和非生物胁迫(高盐,干旱,低温等)下的应激反应[8~11]。
本实验室前期克隆了毛果杨组蛋白去乙酰化酶RPD3/HDA1亚家族基因HDA902[12]。表达分析表明,HDA902基因的表达受非生物胁迫的影响,低温可诱导HDA902基因的表达[13]。在此基础上,构建了植物过表达载体pROK Ⅱ-HDA902,并采用农杆菌介导法将其转化到野生型烟草中,获得转基因植株。对HDA902转基因烟草耐低温能力进行分析,进而明确HDA902在低温胁迫应答反应中的功能。
1 材料与方法
1.1 植物表达载体构建
利用RT-PCR方法,从毛果杨叶片中克隆组蛋白去乙酰化酶RPD3/HDA1亚家族基因HDA902(XM_002313528)。回收并纯化PCR扩增片段,与载体pMDl9-T Vector连接,转化大肠杆菌,得到重组质粒pMD19-HDA902并测序。对pMD19-HDA902和pROKⅡ空质粒进行双酶切,使用的限制性核酸内切酶为XbaⅠ和KpnⅠ。回收并纯化目的片段,利用T4连接酶连接过夜,并通过热激法将连接产物转化到大肠杆菌中。然后提取大肠杆菌质粒用于双酶切鉴定。植物表达载体通过热激法转化农杆菌EHA105,然后继续扩大培养阳性单克隆菌落用于提取重组质粒进行双酶切鉴定,所需限制性核酸内切酶为XbaⅠ和KpnⅠ。
1.2 农杆菌转化烟草及转基因植株的获得
利用农杆菌介导法进行烟草的遗传转化。首先获得烟草组织培养幼苗,用灭菌过的剪刀将叶片切成2 cm×2 cm大小的正方形。将烟草叶片浸没于重组农杆菌菌液中10 min,然后用吸水纸轻轻擦拭叶片,吸收多余的菌液。将侵染过和未侵染过的烟草叶片放在相同的共培养培养基上,在室温下进行暗培养。将暗培养3 d后的烟草叶片转移至含抗生素的筛选分化培养基上,而未侵染过的烟草叶片则置于不含抗生素的普通分化培养基上(作为对照),将少许未侵染过的叶片放于抗性筛选培养基中以验证抗生素是否失效。侵染后的叶片被放置在光周期为16 h光照/8 h黑暗,温度为23~25℃的培养室中,定期更换抗性筛选培养基,每7天为1个周期,直到获得转基因烟草。
1.3 转基因烟草的分子检测
提取野生型和转基因烟草的总RNA,然后利用反转录试剂盒PrimeScript RT reagent Kit(Takara),将总RNA反转录成cDNA。按照试剂盒说明,利用RT Primer Mix引物(含有Oligo dT Primer和Random 6 mers)进行反转录。反转录时,20 μL体系里使用的RNA量是1 000 ng。以野生型和转基因烟草的cDNA为模板,以GGCCTCCATCATGCTAAGAA作为HDA902基因的正向引物,以CAGAACACGCTCATGCACTT作为反向引物,进行半定量RT-PCR检测。在RT-PCR反应中,以18S rRNA基因作为内参照基因,其特异性引物序列为:正向引物TCAACTTTCGATGGTAGGATAGTG;反向引物CCGTGTCAGGATTGGGTAATTT。PCR(20 μL)反应体系:2×Taq PCR StarMix with loading Dye 10 μL;ddH2O 7 μL;正反向引物(10 μmol·L-1)各1 μL;模板DNA(100 ng·μL-1)1 μL。PCR反应条件:94℃预变性3 min;94℃变性30 s,58℃退火30 s,72℃延伸30 s,循环26次;72℃延伸10 min,16℃保温。
1.4 转基因烟草的耐低温能力分析
选取野生型烟草WT-1和生长状态良好且转基因表达量较高的HDA902转基因烟草Tr-10、Tr-17株系(纯系)作为低温处理的植物材料。首先用75%乙醇清洗烟草种子,时间不超过30 s,然后用30%次氯酸钠溶液对种子进行5 min的消毒,消毒后用无菌蒸馏水清洗种子3~5次,最后将经过消毒处理的种子均匀铺在1/2 MS培养基上。经4℃低温春化2 d后,将种子放于25℃、16 h光照/8 h黑暗的环境下培养2周。当烟草长出第3、4片叶时,进行耐低温能力分析。低温处理时,一批植株(包括WT,Tr-10和Tr-17)在植物培养室(23~25℃)培养2周,作为对照;另一批植株进行低温处理,即将烟草植株置于2℃恒温培养箱中,培养1周后再转移至室温环境下,继续培养1周。3次实验重复。观察和测量野生型和转基因烟草在低温胁迫下的生长情况及生理指标变化。用NBT和DAB这两种染料对野生型和转基因烟草的叶片进行染色,以此分析低温胁迫下HDA902基因对烟草活性氧积累起到的调控作用。
此外,对4周龄的转基因烟草植株进行了低温(2℃)处理,处理时间为0、1、2和3 d。然后,测定烟草叶片的丙二醛(MDA)和脯氨酸(Proline)含量。3次实验重复。
1.5 丙二醛测定
(1)取约0.1 g植物材料,液氮研磨后迅速称取粉末质量W,加入1.5 mL 10%三氯乙酸震荡混匀,4℃放置30 min后,11 000×g离心20 min;
(2)取上清液(即酶液)1 mL,加入1 mL 0.6% TBA,混匀后沸水浴反应15 min;
(3)冷却至室温,12 000×g离心20 min,吸取上清液分别测450和532 nm处的吸光值,所有样品使用一个对照,即1 mL H2O加上1 mL 0.6% TBA。
C(MDA浓度μmol·L-1)=6.45OD532-0.56OD450
(1)
计算每克样品中丙二醛的含量(μmol·g-1):
y=(C×V)/W
(2)
式中:V=1 mL。
1.6 脯氨酸测定
(1)制作标准曲线,按照表1加入各种试剂,沸水浴反应40 min。取出冷却后,加入5 mL甲苯充分震荡,静置待分层。取甲苯层测520 nm处吸光值,以1号管为实验对照;
表1 制作标准曲线所需药剂及含量
Table 1 Chemical agents and their contents of making standard curves
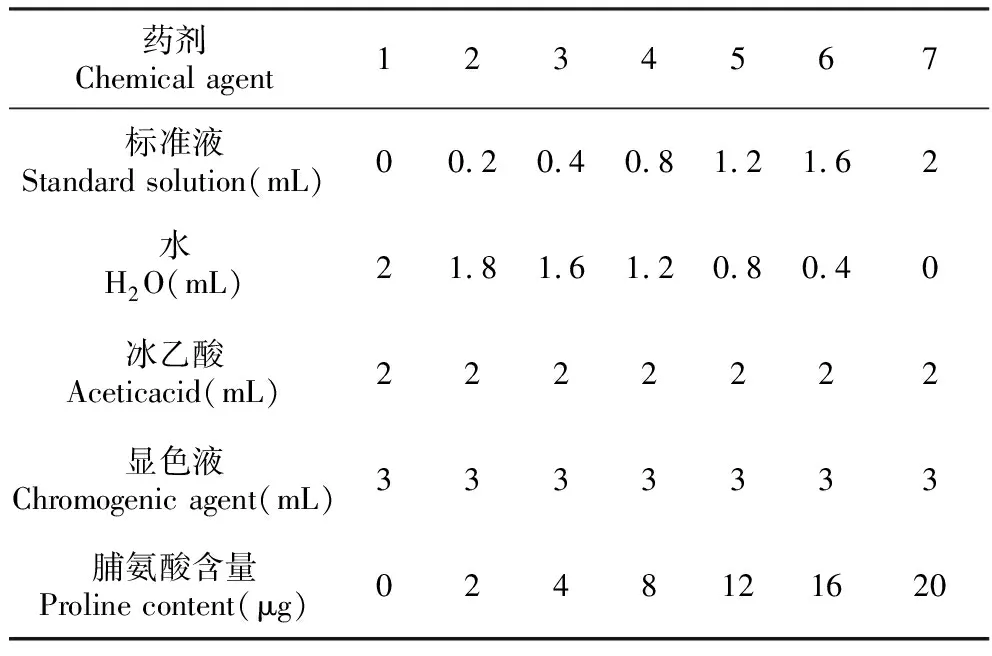
药剂Chemical agent1234567标准液Standard solution(mL)00.20.40.81.21.62水H2O(mL)21.81.61.20.80.40冰乙酸Aceticacid(mL)2222222显色液Chromogenic agent(mL)3333333脯氨酸含量Proline content(μg)0248121620
(2)取约0.1 g植物材料,液氮研磨后迅速称取粉末质量W,加入2 mL 3%磺基水杨酸溶液,震荡混匀,于沸水浴中浸提10 min;
(3)冷却至室温后,11 000×g离心5 min;
(4)上清液1 mL+1 mL冰乙酸+1.5 mL显色液,混匀后沸水浴反应40 min;
(5)取出冷却后,加入2.5 mL甲苯充分震荡,静置待分层,取甲苯层测520 nm处吸光值,以1号管为实验对照。
2 结果与分析
2.1 植物表达载体构建
通过RT-PCR方法获得HDA902基因片段(1 500 bp),经过测序后克隆到pROKⅡ载体上,获得pROKⅡ-HDA902重组载体并将其转入农杆菌EHA105。利用限制性核酸内切酶XbaⅠ和KpnⅠ对重组质粒进行双酶切鉴定。酶切产物条带大小与HDA902基因片段大小一致,进而成功构建了植物表达载体(图1)。
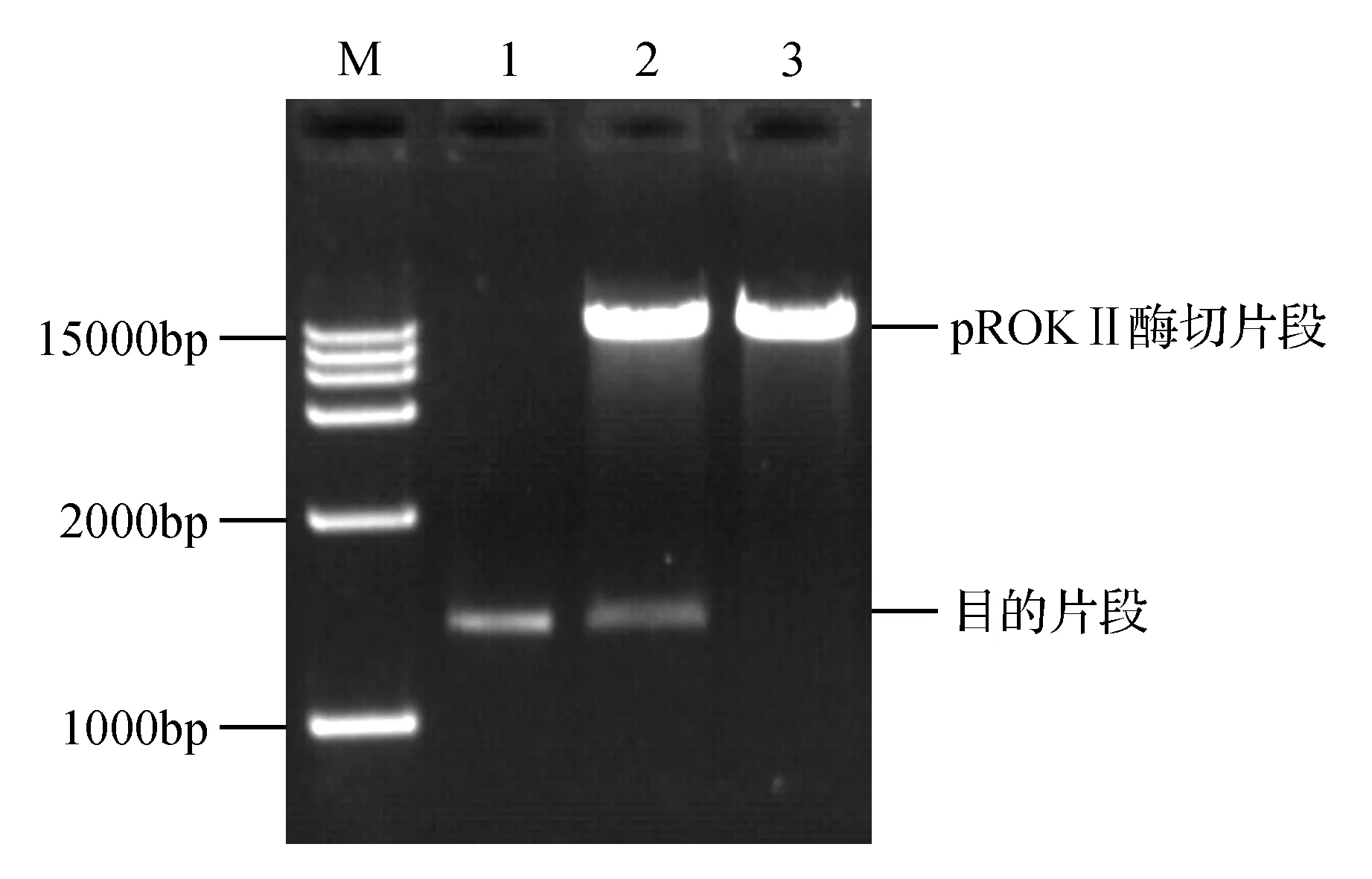
图1 重组质粒pROKⅡ-HDA902的酶切鉴定 M. DNA Marker DL15000;1.HDA902基因片段的凝胶回收产物;2.pROKⅡ-HDA902重组质粒的XbaⅠ和KpnⅠ酶切产物;3.pROKⅡ质粒的XbaⅠ和KpnⅠ酶切产物Fig.1 Identification of the recombinant plasmid pROKⅡ-HDA902 by enzyme digestion M. DL15000 Marker; 1. HDA902 gene fragment; 2. Recombinant plasmid pROKⅡ-HDA902 digested by XbaⅠ and KpnⅠ; 3. Plasmid pROKⅡ digested by XbaⅠ and KpnⅠ
2.2 转基因烟草的分子检测
对野生型和HDA902转基因烟草株系进行了半定量RT-PCR鉴定。结果显示,野生型WT-1、WT-2和水(阴性对照)均没有扩增出特异性片段,而HDA902转基因烟草各株系能够扩增出特异性片段(图2),表明HDA902基因能够在转基因烟草中表达。
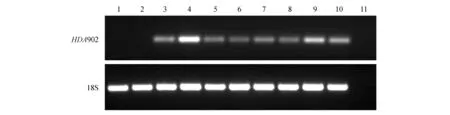
图2 HDA902转基因烟草的RT-PCR鉴定 1. WT-1;2. WT-2;3~10.HDA902转基因烟草株系;11.阴性对照(水)Fig.2 RT-PCR analysis of transgenic plants 1.WT-1; 2.WT-2; 3-10. HDA902 transgenic plants; 11.Negative control(ddH2O)

图3 低温处理下野生型烟草和转基因烟草植株的生长情况 A.野生型和转基因烟草植株在室温(对照)和低温条件下的生长情况(WT.野生型烟草;Tr-10,Tr-17.不同的转基因株系); B.野生型和转基因烟草植株在室温(对照)和低温条件下植株鲜重Fig.3 Growth of wild type and transgenic tobacco plants under the cold stress A. Growth of wild type and transgenic tobacco plants under room temperature(control) and cold stress(WT. Wild type tobacco; Tr-10,Tr-17. Different transgenic lines); B.Fresh weight of wild and transgenic tobacco plants under room temperature(control) and cold stress
2.3 HDA902基因在低温胁迫应答反应中的功能
2.3.1 两周龄植株的低温耐受性分析
在低温耐受性分析中,选取2周龄植株进行低温(2℃)处理。经过1周低温处理,1周室温恢复后,野生型和HDA902转基因烟草的鲜重均有所增加,但转基因烟草鲜重的增加量显著高于野生型(图3)。野生型低温处理后鲜重增加了10%,而转基因株系Tr-10和Tr-17的鲜重分别增加了28%和38%。这说明HDA902基因在烟草中的表达提高了转基因烟草对低温的耐受性,促进了转基因烟草在低温胁迫条件下的生长。
2.3.2 四周龄烟草低温耐受性分析
在植物中,脯氨酸(Pro)含量的增加通常表明植物正处于不利于生长发育的逆境中,而丙二醇(MDA)含量的高低则显示膜系统是否受到伤害以及受损程度的大小。将4周龄野生型和HDA902转基因烟草进行低温(2℃)处理,并分析转基因烟草的低温耐受性。低温处理24 h时,野生型和转基因烟草叶片MDA含量均增加,野生型烟草和转基因烟草之间无显著差异;而野生型烟草的Pro含量低于转基因烟草。随着时间的增加,转基因烟草和野生型烟草之间的MDA和Pro含量在低温处理72 h后呈现明显差异,转基因烟草的MDA含量显著低于野生型,而Pro含量显著高于野生型(图5)。这些结果表明,HDA902通过影响MDA和脯氨酸的含量来提高转基因烟草对低温的耐受性。
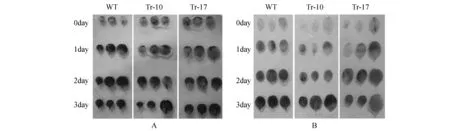
图4 低温处理下野生型烟草和转基因烟草叶片H2O2和的积累 A.NBT染色(WT.野生型烟草;Tr-10,Tr-17.不同的转基因株系);B. DAB染色Fig.4 The accumulation of H2O2 and in the leaves of wild type and transgenic tobacco after cold treatment A. NBT staining results(WT. Wild-type tobacco; Tr-10,Tr-17. Different transgenic lines); B. DAB staining results
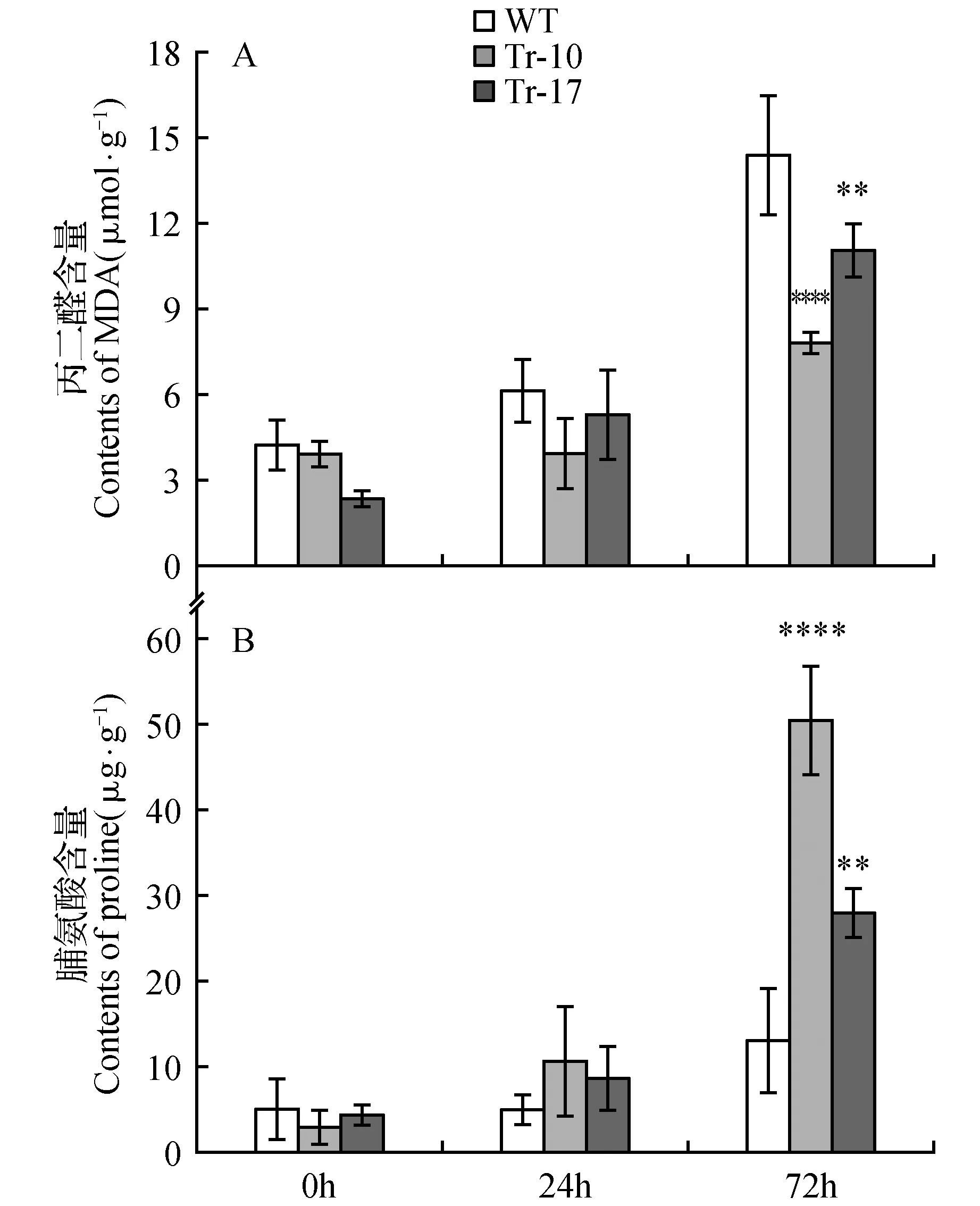
图5 低温处理下野生型烟草和转基因烟草叶片丙二醛和脯氨酸的含量 A.MDA含量(WT.野生型烟草;Tr-10和Tr-17.不同的转基因株系);B.脯氨酸含量Fig.5 Contents of MDA and Proline in wild type and transgenic tobacco leaves after cold treatment A. Contents of MDA(WT. Wild type tobacco; Tr-10,Tr-17. Different transgenic lines); B. Contents of proline
3 讨论
在植物中,组蛋白去乙酰化酶(HDAC)是一个超基因家族。目前,关于植物HDAC的研究越来越多,大多数都集中在HDAC在发育过程中的作用,HDAC在胁迫应答反应中的作用研究相对较少。虽然研究相对较少,但在草本植物和农作物中的研究表明,组蛋白去乙酰化酶在胁迫应答反应中起着重要的调控作用,不同HDAC成员在胁迫应答反应中的作用不同[14~17]。Chen[14]等研究显示,HDAC家族中的Ⅰ类酶(HDA19)酶活性被HDAC抑制剂抑制后,植株的耐盐性提高。在拟南芥中,HDA6和HDA19在盐和ABA[14]作用下对种子萌发起正调节作用,而HDA19对种子萌发和幼苗根系生长过程中盐和干旱胁迫耐受性起负调节作用[18]。在木本植物中,对HDAC的研究鲜有报道。
本实验室曾报道了杨树RPD3/HDA1类型组蛋白去乙酰化酶84KHDA903在干旱胁迫反应中的作用。84KHDA903显著提高了转基因烟草的耐旱性[19]。与盐和干旱胁迫应答反应研究相比,植物HDAC在响应低温胁迫时的功能研究相对较少。To等[9]研究发现,拟南芥HDA6基因的表达量在低温处理72 h后明显增加,说明组蛋白去酰化酶基因HDA6参与低温胁迫应答反应。Hu等[20]研究发现,当玉米植株从室温转移至低温后,HDAC103、HDAC106、HDAC108和HDAC110这4个基因表达水平呈现出迅速提高的现象。本实验室研究发现,毛果杨HDAC家族中大部分基因的表达受低温诱导[21],而毛果杨HDAC基因在低温胁迫应答反应中的功能还不清楚。
本研究首次解析了木本植物HDAC在低温胁迫中的功能。发现在低温胁迫下,HDA902转基因烟草会产生较少的活性氧,叶片丙二醛(MDA)含量较低,而脯氨酸含量较高。这些研究结果表明,毛果杨HDA902参与调控植物对低温胁迫的耐受性,而具体的调节机制有待进一步探索。
