小鼠皮肤脓肿模型构建及多枝雾水葛的药效评价
2020-04-07江炜邹国发古炽明陶曙红郭丽冰唐春萍杨超燕陈艳芬
江炜,邹国发,古炽明,陶曙红,郭丽冰,唐春萍,杨超燕,陈艳芬,3
(1.广东药科大学中药学院,广州 510006;2.广东省中医院外二科,广州 510105;3.广州市新药筛选模型体系构建与应用重点实验室,广州 510006)
皮肤脓肿是临床外科常见化脓性感染疾病,以金黄色葡萄球菌为最常见致病菌[1-2]。金黄色葡萄球菌可导致皮肤持续、反复感染,且不断出现耐药菌株,对人和动物健康及公共卫生安全造成严重威胁[3]。优质皮肤感染动物模型是评价药物疗效的首要前提,但目前多数文献报道的皮肤脓肿模型方法较粗略,评价指标模糊,复制成功率较低,不利于皮肤疾病的研究。为筛选优质皮肤脓肿模型,需要制定模型技术标准,笔者引入层次分析法(the analytic hierarchy process,AHP)[4]。AHP是一种定性与定量相结合的多目标评价分析技术,其原理是将待分析的复杂问题分解成若干层次,由专家组对所列指标通过两两比较重要程度而逐层进行判断评分,通过计算判断矩阵特征向量确定下层指标对上层指标的贡献程度,从而得到底层指标对总目标而言重要性的排列结果,即权重值,最后利用权重求各方案优劣次序。
多枝雾水葛(Pouzolziazeylanicavar.microphylla)是荨麻科雾水葛属药用植物,民间广泛用于脓肿、疮痈等疾病,具有消炎镇痛、拔脓消肿等作用[5]。笔者在既往研究的基础上,富集多枝雾水葛有效部位并将其精制成软膏,运用构建好的小鼠皮肤脓肿模型进行多枝雾水葛软膏抗感染药效评价。
1 材料与方法
1.1动物及菌株 无特定病原体(SPF)级KM小鼠,体质量18~22 g,购自广州中医药大学实验动物中心,实验动物许可证号:SCK(粤)2013-0034。在室温20~22 ℃,相对湿度50%,每天交替进行12 h光照、12 h 黑暗处理,自由饮水进食,适应性喂养3 d进行实验。金黄色葡萄球菌为标准菌株ATCC6538,由广东药科大学基础学院微生物与免疫实验教研室分离保存。
1.2药物与试剂 多枝雾水葛软膏(Pouzolziazeylanicavar.microphyllaointment,PZO,批号:20170904,广东药科大学中药学院中药化学教研室制备提供);莫匹罗星软膏(中美天津史克制药有限公司,批号:17070118);龙珠软膏(马应龙药业集团股份有限公司,批号:170702)。营养肉汤培养基(广东环凯微生物科技有限公司,批号:3102499);营养琼脂(广东环凯微生物科技有限公司,批号:3104760);戊巴比妥钠(广州瑞舒生物科技有限公司,批号:850601);苏木精-伊红染液(HE,武汉谷歌生物科技有限公司,批号:174516)。
1.3仪器 恒温培养箱(上海博讯实业有限公司,型号:HPX-9162);紫外可见分光光度计(上海菁华科技仪器有限公司,型号:752N);摇床(苏州华利达实验设备有限公司,型号:HZ-9211KB);病理切片机(上海徕卡仪器有限公司,型号:RM2235)。
1.4方法
1.4.1评价指标体系的构建 为获取皮肤脓肿动物模型制备的评价指标,笔者通过查阅文献资料及咨询专家,设计了皮肤脓肿模型评价指标资料调查表,考察评价一个动物皮肤感染模型应该考虑的方面,包括科学性、可靠性、重复性、经济性、易操作性等,建立了树状指标体系(图1),包括体征变化[6]、皮肤病变外观[7]、形态学观察[8]、病原学观察[9]等4个1级指标。采用德尔菲法[10-11]邀请5位相关专业(包括临床医学、病原微生物学、药理学、实验动物学等)的专家对指标体系各层指标相对重要性进行评分,采用和积法计算各指标权重,计算步骤:将判断矩阵每列归一化,每列经归一化后的判断矩阵按行相加,对上一步生成的向量归一化,将多位专家对各层指标权重(向量归一化数值)计算均值及一致性检验,当一致性比率(consistency ratio,CR)<0.1, 认为判断矩阵不一致的程度在容许范围内,均值即为综合权重的值。

图1 小鼠皮肤感染脓肿模型评价体系
Fig.1Evaluationsystemofskininfectionabscessmodelinmice
1.4.2动物模型的构建
1.4.2.1菌液的制备 将金黄色葡萄球菌接种于营养琼脂培养基,置恒温培养箱,培养24 h至对数生长期,加入适量无菌0.9%氯化钠溶液吹打菌落,收集菌液,紫外分光光度计计数[12],0.9%氯化钠溶液调整浓度至1×1014cfu·L-1,4 ℃保存备用。
1.4.2.2小鼠的分组及造模 小鼠正常饲养3 d,取88只,按性别和体质量分层随机分为低、中、高浓度组(菌液浓度分别为1×1012,1×1013和5×1013cfu·L-1)及对照组(无菌0.9%氯化钠溶液),每组22只,雌雄各半。造模前1 d剃除小鼠背部毛,24 h后经腹腔注射0.5%戊巴比妥钠(0.01 L·kg-1)麻醉,脱毛区消毒,皮下注入金黄色葡萄球菌菌液0.1 mL,48 h成模。
1.4.2.3观察指标 ①体征:造模前3 d至造模结束,每天称重和记录小鼠体质量,记录感染后3,15,24,48,72,96,120 h各组小鼠进食量并计算进食率(参考《中药药理研究方法学》标准,KM小鼠每天食用饲料约5 g,≥5 g为正常,则进食率为100%,进食率=100%·进食量/5 g),24 h精神状态情况。②皮肤外观变化:感染第2天开始,每天用游标卡尺测量各组小鼠脓肿长径与宽径,并按照V=π/6·L·W2计算脓肿体积,记录各组小鼠脓肿形成时间、形成率、维持时间、溃疡率、红肿及脓性分泌物情况。(V.脓肿体积;L.脓肿长径;W.脓肿宽径)。感染后第1,4,8,13天摄影记录脓肿外观。③病理组织学检查:感染后3,8,11 d,取小鼠脓肿部位组织,10%甲醛固定,常规HE染色后镜下观察。④脏器指数:称心、肝、脾、肺及肾质量,并计算脏器指数。⑤病原学检查:感染第3天,进行小鼠眼眶取血和脓肿部位皮肤组织取材,分别实施血液和皮肤细菌逆培养。
1.4.3多枝雾水葛抗皮肤感染的药效评价
1.4.3.1分组及给药 选择综合得分最高的菌液浓度,按“1.4.2.2”项方法构建小鼠脓肿模型,将造模成功小鼠随机分为模型组(不处理)、基质组、龙珠软膏组、百多邦组、PZO大剂量组(1 g·kg-1)、PZO中剂量组(0.5 g·kg-1)、PZO小剂量组(0.25 g·kg-1),每组12只。给药组和基质组每天给药2次,每次0.1 g,连续14 d。
1.4.3.2检测指标 主要包括小鼠体征变化、脓肿体积变化、皮肤病理检查、皮肤细菌含量等。

2 结果
2.1小鼠脓肿模型的综合评价指标体系 按照 AHP 程序建立了评价目标层次体系,通过计算获得各指标权重,CR<0.1通过一致性检验,见表1。
2.2体征变化 感染第一天,与对照组比较,高、中浓度组小鼠体质量显著下降(P<0.01),见图2(F=7.249,P=0.000)。感染第1~3天,与对照组比较,高、中、低浓度组小鼠进食率明显受影响,72 h后各组进食率相近,见图3。高、中浓度组小鼠精神萎靡,活动少,行动迟缓;低浓度组小鼠精神较正常,活动较多,行动较灵敏,对照组小鼠正常。
表1 小鼠皮肤感染脓肿模型评价指标权重
Table.1Indexweightofskininfectionabscessmodelinmice

目标层一级指标二级指标对应权重体征体质量变化0.018 2小鼠变化进食率0.013 7行动情况0.019 7皮肤皮肤红肿、脓性分泌物0.114 0病变脓肿体积变化0.132 6感染外观溃疡发生率0.046 8形态学组织病理切片0.248 9脓肿观察重要脏器大体观察0.052 8模型病原学血液细菌培养0.126 6检查皮肤荷菌量培养0.226 7

①与对照组比较,P<0.01;②与对照组比较,P<0.05。
图2 4组小鼠体质量变化
①Compared with control group,P<0.01;②Compared with control group,P<0.05.
Fig.2Changesofbodyweightinfourgroupsofmice

图3 4组小鼠进食率变化
Fig.3Changesoffeedingrateinfourgroupsofmice
2.3皮肤病变外观 感染后24 h,高、中浓度组小鼠接种部位明显红肿,表面大量脓性分泌物,低浓度组小鼠接种部位红肿较轻微,无脓性分泌物。高、中浓度组形成脓肿需1~2 d,低浓度组形成脓肿需1~3 d;高、中浓度组成模率100%,脓肿维持时间>14 d,高浓度组脓肿容易形成溃疡(溃疡率85%);低浓度组成模率85%,脓肿在11 d基本恢复,见图4(F=480.571,P=0.000)~6和表2。

①与对照组比较,P<0.01。
图4 4组24 h皮肤红肿及脓性分泌物评分
①compared with control group,P<0.01.
Fig.4Scoresofskinrednessandpurulentsecretionsinfourgroupsofmicein24h

图5 4组脓肿体积变化
2.4病理学检查 高、中浓度组可见明显脓肿灶,灶内充满大量嗜中性粒细胞,真皮层结构遭到破坏,胶原纤维断裂,大量炎症细胞浸润;低浓度组脓肿灶较小,表皮层、真皮层及皮下组织结构较清晰,少量炎症细胞浸润;对照组小鼠皮肤各层结构清晰,表皮层细胞层次分明,真皮层中胶原纤维排列有序,毛囊和皮肤腺等结构完整,见图7。
2.5重要器官脏器指数 与对照组比较,高浓度组脾指数升高(P<0.01),高浓度组和低浓度组肾脏指数降低(P<0.05),见表3。提示感染菌量超过一定阈值可能播散至全身,导致系统感染,引起其他脏器病变。
2.6病原学检查 皮下注射金黄色葡萄球菌第3天,与对照组比较,高、中浓度组血液细菌含量上升(P<0.01,P<0.05)。与对照组比较,高、中、低浓度组皮肤细菌含量显著上升(P<0.01),见表4。
2.7综合得分 将以上评价指标依据动物皮肤感染脓肿模型评价指标赋分标准进行打分,并计算各指标综合评分,中浓度组>高浓度组>低浓度组,见表5。
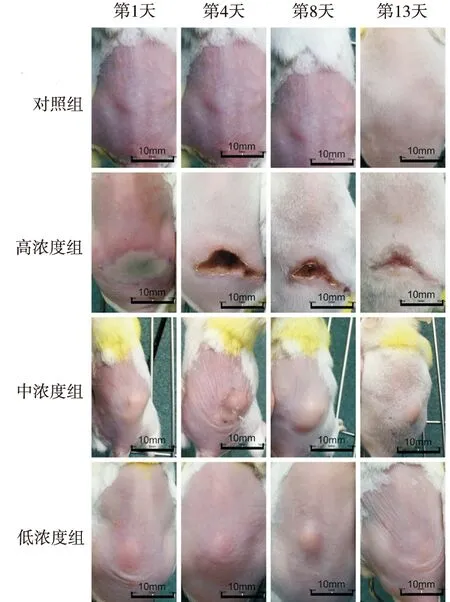
图6 小鼠皮肤脓肿外观变化
Fig.6Changesoftheappearanceofskinabscessinmice
表2 4组脓肿发展过程


组别形成时间/d成模率/%初始体积/mm3维持时间/d溃疡率/%对照组-----高浓度组1100824.74±682.0514~1685中浓度组1~210082.42±113.0516~2114低浓度组1~38514.69±17.185~120
2.8多枝雾水葛药效评价结果
2.8.1体征变化 造模1 d,各组小鼠体质量均降低,聚集成团,精神状态差。给药后,与基质组比较,各给药组小鼠体质量上升快,但差异无统计学意义。
2.8.2脓肿体积变化 模型组与基质组差异无统计学意义。给药第4天,与基质组比较,百多邦组和PZO大、中剂量组脓肿体积更小,差异有统计学意义(P<0.05),给药第8,12天,与基质组比较,各给药组脓肿体积明显减小(P<0.01,P<0.05)。说明多枝雾水葛具有消肿排脓、加快感染部位恢复作用,见表6与图8。
2.8.3皮肤细菌逆培养 给药第3天,与基质组比较,龙珠软膏组、百多邦组和PZO大剂量组皮肤细菌含量明显降低(P<0.01,P<0.05)。给药第8天和第13天,与基质组比较,各给药组皮肤细菌含量明显降低(P<0.01,P<0.05)。多枝雾水葛具有抑制细菌生长作用,见表7。

图7 4组不同时间皮肤病理特征(HE,×40)
Fig.7Pathologicalfeatureofskininfourgroupsondifferentday(HE,×40)
表3 4组重要器官脏器指数测定结果
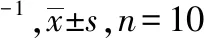

组别心指数肝指数脾指数对照组0.635±0.0515.274±1.1170.343±0.060高浓度组0.671±0.0995.496±0.8230.522±0.147①中浓度组0.705±0.1415.123±0.5590.400±0.141低浓度组0.579±0.0884.882±0.4160.365±0.07F7.9950.8857.362P0.1100.4610.001组别肺指数肾指数对照组0.760±0.0821.585±0.227高浓度组0.682±0.0991.345±0.150②中浓度组0.710±0.1131.442±0.221低浓度组0.661±0.1351.200±0.185②F2.8905.356P0.0530.050
①与对照组比较,P<0.01;②与对照组比较,P<0.05。
①Compared with control group,P<0.01;②Compared with control grup,P<0.05.
2.8.4皮肤病理检查 给药第3天,各组小鼠脓肿部位皮肤均有不同程度破坏,真皮层及皮下组织结构不清晰,炎症细胞浸润明显;给药第8天,各组均有所恢复,与模型组比较,给药组炎症细胞明显减少,胶原纤维增多;给药第13天,模型组仍有较明显脓肿灶,胶原纤维断裂,大量炎症细胞浸润,给药组基本未见脓肿灶,可见瘢痕组织,少量炎症细胞浸润。提示多枝雾水葛软膏能促进皮肤脓肿消退,减少炎症细胞浸润。结果见图9。
表4 4组血液和皮肤细菌含量测定结果

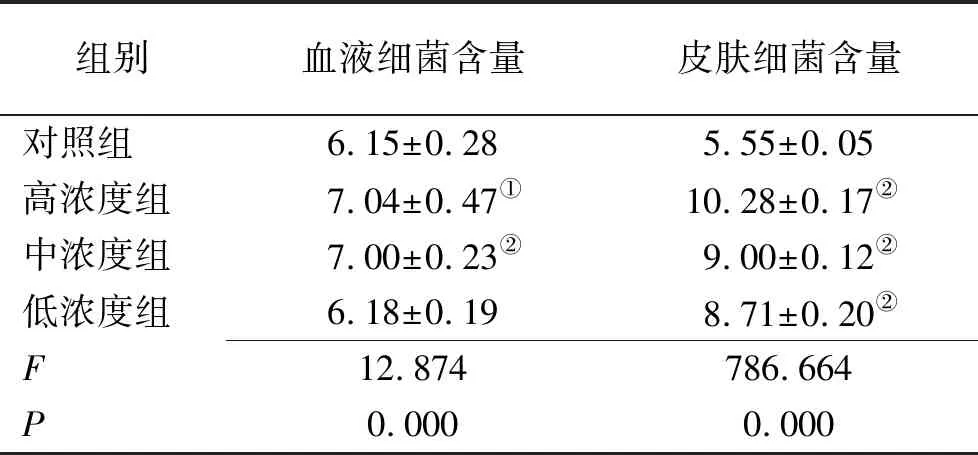
组别血液细菌含量皮肤细菌含量对照组6.15±0.285.55±0.05高浓度组7.04±0.47①10.28±0.17②中浓度组7.00±0.23②9.00±0.12②低浓度组6.18±0.198.71±0.20②F12.874786.664P0.0000.000
①与对照组比较,P<0.05;②与对照组比较,P<0.01。
①Compared with control group,P<0.05;②Compared with control grup,P<0.01.

表5 综合得分
3 讨论
优质动物皮肤脓肿模型可为研究皮肤脓肿发病机制及防治提供前期基础条件。FORD等[13]采用小鼠皮下注入金黄色葡萄球菌方法成功构建了小鼠皮肤脓肿模型,该方法后来被广泛应用于皮肤感染模型。但综合目前国内外文献报道,皮肤脓肿模型的方法描述比较粗略,评价指标单一、模糊。笔者在本研究期望通过层次分析法,建立较全面、量化的动物皮肤感染脓肿模型评价体系,实例运用建立的评价体系优选出较理想的小鼠皮肤脓肿模型,并将筛选出的小鼠皮肤脓肿模型用于多枝雾水葛软膏的抗皮肤感染评价,对筛选出的模型进一步验证。
表6 7组脓肿体积变化


组别第1天第4天第8天第12天模型组37.33±8.4681.60±11.6984.78±12.2551.41±11.59基质组31.79±9.1276.98±8.1873.69±11.0649.13±14.07龙珠软膏组37.88±8.3250.90±13.4828.52±3.98①24.41±5.97②百多邦组38.49±8.8738.51±10.08②34.53±3.36①8.94±4.97①PZO 大剂量组36.20±7.8536.69±8.56②28.24±7.57①6.41±2.45① 中剂量组39.45±9.1244.82±9.10②20.42±6.36①14.85±3.03① 小剂量组35.21±9.7246.65±7.9621.80±4.31①14.89±2.20①F0.1742.56314.1377.328P0.9700.0430.0000.000
①与基质组比较,P<0.01;②与基质组比较,P<0.05。
①Compared with matrix group,P<0.01;②Compared with matrix group,P<0.05.
模型研究结果表明,金黄色葡萄球菌中、高浓度组感染前期小鼠体质量降低,进食量少,精神差,血液及皮肤含菌量明显高于低浓度组,皮肤脓肿部位可见明显脓肿灶及炎症细胞浸润。中浓度组成模率100%,脓肿体积适中,溃疡率14%,脓肿维持时间16~21 d,高浓度组虽然成模率也是100%,但溃疡率高达85%,且易引起全身感染;低浓度组成模率85%,脓肿体积小,脓肿维持时间5~12 d。经层次分析法计算发现,综合得分最高的是中浓度组,即为本研究中筛选出的最佳金黄色葡萄球菌感染小鼠皮肤脓肿模型。通过对多枝雾水葛软膏抗皮肤感染药效评价,进一步验证了模型的稳定性,成模率达100%,病变部位体积相近。药效评价结果显示,与基质组比较,各给药组脓肿体积小,4~12 d差异有统计学意义;皮肤细菌逆培养,PZO各剂量组皮肤细菌含量明显较少;脓肿部位病理观察,给药13 d,PZO各剂量组小鼠未见脓肿灶,较少炎性细胞浸润,可见瘢痕组织。以上结果提示PZO具有显著抗皮肤脓肿感染作用。

图8 7组脓肿外观变化
表7 7组皮肤细菌逆培养结果


组别第3天第8天第13天模型组10.13±0.259.00±0.427.73±0.30基质组10.18±0.529.06±0.137.64±0.16龙珠软膏组9.13±0.13①7.96±0.26①6.77±0.31②百多邦组9.46±0.43①7.57±0.04①7.19±0.13②PZO 大剂量组9.61±0.14②8.69±0.38②6.97±0.05② 中剂量组10.08±0.318.27±0.20①7.14±0.15② 小剂量组9.79±0.248.65±0.12②7.08±0.62②F9.88015.1044.021P0.0000.0000.013
①与基质组比较,P<0.01;②与基质组比较,P<0.05。
①Compared with matrix group,P<0.01;②Compared with matrix group,P<0.05.
综上所述,本研究采用AHP建立的动物皮肤脓肿模型评价体系较全面、科学。经过多枝雾水葛软膏药效评价验证筛选出的金黄色葡萄球菌感染小鼠皮肤脓肿模型,具有操作简单、稳定及再现性好等特点,为进一步研究皮肤感染疾病的发病机制及治疗药物提供了依据。

图9 7组不同时间皮肤病理特征(HE,×40)
Fig.9Pathologicalfeatureofskininsevengroupsofmiceondifferentday(HEstaining,×40)
