五味金色缓释片处方筛选及其在比格犬体内药动学研究*
2020-04-07朱烨张洁关志宇林春莲颜洁刘婧黄潇
朱烨,张洁,关志宇,林春莲,颜洁,刘婧,黄潇
(江西中医药大学药学院,南昌 330000)
五味金色丸收载于《卫生部药品标准·藏药》,由诃子、木香、波棱瓜子、石榴子、黑冰片组成,方中诃子性平,味苦酸涩,归肺、大肠经,具有湿肠止泻、敛肺止咳、降火利咽、调和药性之功效[1]。丸剂多由原药材粉碎加工制成,生产流程长,易受微生物污染。本实验旨在以中医临床基本理论为指导,将已经为临床实践证明有确切疗效的藏族医学传统经典复方五味金色丸制备成缓释片剂,采用缓释片剂的制备工艺实现市售缓释丸剂同样的释药效果,采用液相色谱-质谱联用法(LC-MS/MS)考察五味金色缓释片在比格犬体内药动学过程,并与市售缓释丸剂进行比较,以获得药物制剂进行体内评价的依据。
1 材料
1.1仪器 Applied Biosystems(AB)Triple Quad 5500液质联用仪器(美国 Agilent 科技有限公司),高速冷冻离心机(德国Sigma公司,型号:sigma3-18K),电子分析天平(北京赛多利斯科学仪器有限公司,型号:Secura225D-1CN,感量:0.01 mg),DPH 单冲压片机(湖南吉首市中诚制药机械厂),YD-20 型片剂硬度计(天津天大天发科技有限公司)。VORTEX GENIUS3涡旋仪(IKA仪器设备有限公司),SZ-93自动双重纯水整流器(上海亚荣生化仪器厂),超纯水仪(南京易普易达科技发展有限公司),BF-2000氮气吹干仪(八方世纪公司),KQ5200B超声波清洗器(昆山市超声仪器有限公司),微量移液器(10~200 μL,100~1 000 μL,Eppendorf)。
1.2试药 五味金色浸膏粉(自制),五味金色丸(每10丸质量2.5 g,西藏藏医学院藏药有限公司,批准文号:国药准字号Z54020101,批号:131201);羟丙甲基纤维素(HPMC K4M,HPMC K15M,HPMCK100M,美国陶氏辅料有限公司),乙基纤维素 10cp(山东瑞泰化工有限公司),预胶化淀粉、微晶纤维素、蔗糖、乳糖(安徽山河药用辅料有限公司,药用级),鞣花酸对照品(南昌贝塔生物科技有限公司,批号:10379-201310,每支50 mg,质量分数>98%),去氢木香内酯对照品(中国食品药品检定研究院,批号:111525-201209,含量:99.7%),磷酸二氢钾(国药集团化学试剂有限公司,批号:201601002,含量:99.5%);磷酸(分析纯,批号:1102261,含量:99.5%)、氯化钠(批号:160103,含量:99.5%)、无水乙醇(批号:16092702,含量:99.7%)均来自西陇化工股份有限公司,甲醇(色谱纯,批号:MS1999-801,含量:99.9%)、乙腈(色谱纯,批号:AS1022-801,含量:99.9%)均来自美国天地公司。
1.3实验动物 雄性比格犬,体质量10 kg,购买于福州振和实验动物技术开发有限公司,实验动物生产许可证号:SCXK(闽)2012-0002。饲养条件,温度:16~26 ℃;相对湿度:40%~70%;噪声≤60 dB;动物照度:100~200 lx,明暗各12 h交替。
2 方法与结果
2.1五味金色缓释片的制备 按处方量称取药材,加8倍量70%乙醇,提取2 次,每次1.5 h。将提取液浓缩,200目筛(筛孔内径75 μm)过滤,干燥,与各辅料分别粉碎过100 目筛(筛孔内径150 μm),于研钵中研磨,过100目筛混合2 次,充分混合均匀后,采用直接粉末压片法制备片剂,压强70~80N,每片约250 mg。
2.2总多酚得率测定 在释放度实验各取样时间点,精密量取溶出液5 mL,微孔滤膜(孔径0.45 μm)滤过,分别置于10 mL量瓶,加福林试剂 2 mL,摇匀,静置 5 min,加入10% 碳酸钠2 mL,加水定容,摇匀,放置120 min,显色后于 770 nm波长处有最大吸收峰。同法操作,作为空白溶液,计算总多酚含量与各相应时间的累计释放量。
2.3处方考察
2.3.1缓释材料的筛选 在以EC10cp作为阻滞剂的基础上,考察缓释辅料羟丙基甲基纤维素(HPMC K100M、HPMC K15M、HPMC K4M),分别测定不同时间点缓释片的总多酚累积释放度,见图1。实验结果表明,以HPMC K15M 为骨架材料时,释药过程更平顺,更符合零级释药曲线,所制备的五味金色缓释片缓控释效果最佳,故选择HPMC K15M作为缓释辅料,与EC 10cp联合使用。
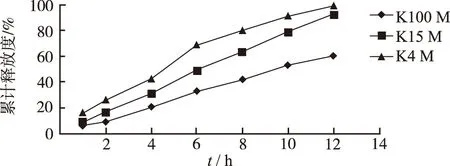
图1 HPMC型号对溶出度的影响
2.3.2HPMC K15M 用量考察 以HPMC K15M为骨架材料,分别称取占片重15%,20%,25%的HPMC K15M,其他辅料用量不变,按照制备工艺制备缓释片,考察不同HPMCK15M 用量对释放度的影响,见图2。由结果可见,随着HPMC K15M用量增加骨架片凝胶层增厚,药物扩散速度减慢,药物的释放速度降低。当HPMC K15M用量为15%时存在突释现象,缓控释制剂的稳定性降低;当HPMC K15M用量为25%时,药物释放速度最低;当HPMC K15M 用量占片重的 20% 时,释放曲线较好。

图2 HPMC用量对溶出度的影响
2.3.3EC 10cp 用量考察 以EC 10cp为阻滞剂,分别称取占片重20%,30%,40%的EC 10cp,其他辅料用量不变,按照制备工艺制备缓释片,考察不同EC 10cp 用量对释放度的影响,见图3。由结果可见,当EC 10cp药物释放较快,存在突释现象,EC 10cp用量为40%时药物释放过慢,故选择占处方量30%的EC 10cp。
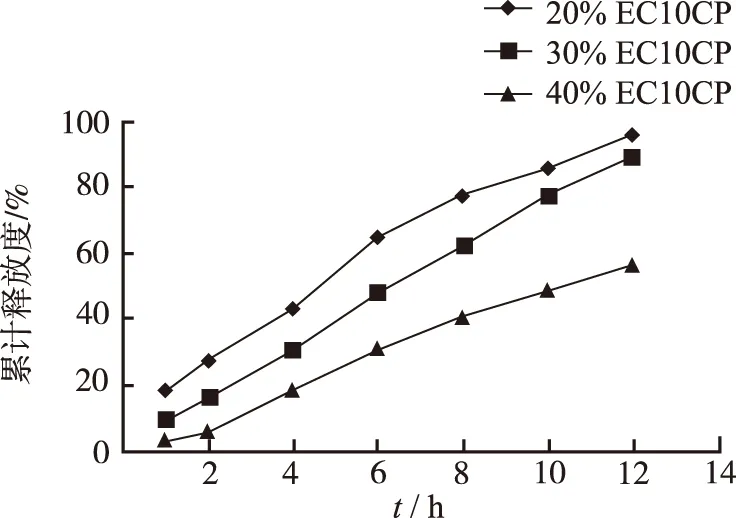
图3 EC用量对溶出度的影响
2.3.4填充剂的筛选 保持处方中其他辅料用量不变,分别加入等量乳糖、可压性淀粉、微晶纤维素、蔗糖作为填充剂,制备缓释片(硬度70~80N),对比不同填充剂对药物释放的影响,结果见图4。以可压性淀粉、蔗糖为填充剂时释药行为差异无统计学意义,但两者压成的片剂脆碎度均>1%,易松散掉粉,且前期和中期存在突释现象;以微晶纤维素为填充剂的片剂药物累积释放度最小;以乳糖为填充剂的片剂,药物释放最理想,故选用乳糖作填充剂。

图4 填充剂对溶出度的影响
2.3.5验证实验 原、辅料过100目筛,准确称取处方量的提取物浸膏粉、HPMC K15M 、EC 10cp、乳糖、硬脂酸镁,混合研磨,充分混合均匀后粉末直接压片,片剂硬度控制在60~70N。其平均片质量为0.501 2,0.500 9,0.501 3 g,片质量差异合格范围为±5%,均无超出范围的片质量。测得药物累积释放度分别为95.1%,93.9%,94.6%,表明自制五味金色缓释片缓释效果较好。
2.4色谱和质谱条件 色谱条件:色谱柱为 Agilent C18(150 mm×4.6 mm),流动相为0.1%甲酸水:乙腈,梯度洗脱(表1),流速0.3 mL·min-1,进样量10 μL,柱温30 ℃,时间6 min。
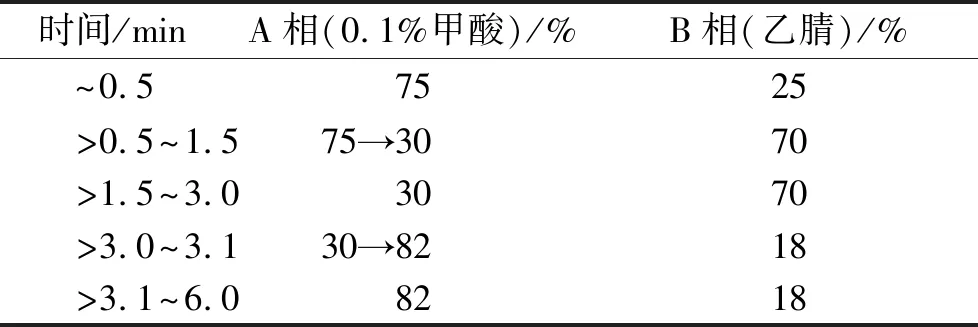
表1 梯度洗脱条件
质谱条件:电喷雾离子源(electrospray ionization,ESI),正离子检测,扫描方式:多重反应监测(multiple reaction monitoring,MRM)模式,质谱参数设置如下:离子源温度(temperuture,TEM)为500 ℃,离子源电压(ionspray voltage,IS)为5 500 V,气帘气(curtain gas,CUR)为35 psi(1 psi≈6.9 kPa),雾化气(ion source gas1,GS1)和辅助加热气(ion source gas2,GS2)为50 psi,碰撞气(collision gas,CAD)为7。鞣花酸、去氢木香内酯和芍药苷最优MRM参数见表2,详见图5。
表2 检测成分质谱信息
Table.2Massspectruminformationofthedetectedcomponents
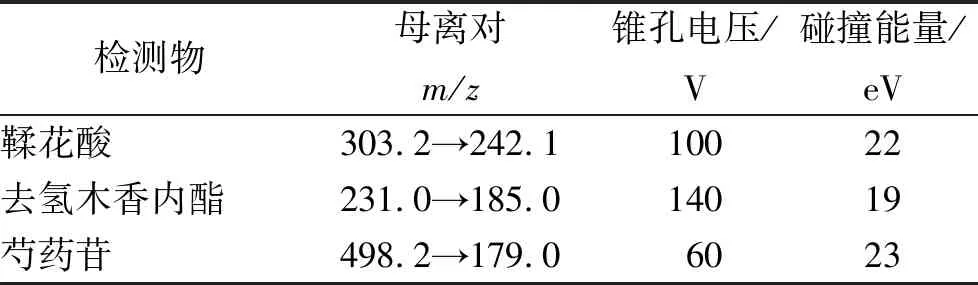
检测物母离对m/z锥孔电压/V碰撞能量/eV鞣花酸303.2→242.110022去氢木香内酯231.0→185.014019芍药苷498.2→179.06023
2.5比格犬体内的药动学研究
2.5.1给药方案与血浆样品采集 本实验采用双交叉实验设计,将 6只受试比格犬随机分成2组,一组先服用受试制剂后服用参比制剂,另一组先服用参比制剂后服用受试制剂,每次实验间隔 1 周,给药前禁食12 h,口服1片,置咽部,用温水100 mL灌服。服药后2 h开始饮水,4 h后开始进食,于用药前30 min内采集空白血样,口服后于0.5,1,2,3,4,6,8,10,12,24,30,36 h经后肢静脉采血2 mL。将采集到的血样置含肝素抗凝管中,4 000 r·min-1离心10 min(4 ℃),分离血浆,置-80 ℃冰箱保存待测。
2.5.2对照品溶液的制备 分别精密称取鞣花酸、去氢木香内酯对照品约5 mg,置10 mL量瓶,用甲醇稀释至刻度,摇匀,分别配制成502 μg·mL-1鞣花酸、503 μg·mL-1去氢木香内酯对照品储备液。同法配制506 μg·mL-1芍药苷内标溶液,于-4 ℃冰箱保存备用。
2.5.3样品的处理 取血浆样品 500 μL,置于10 mL离心管,加入20 μL芍药苷内标溶液(1000 ng·mL-1),加入50%磷酸溶液15 μL和1 mol·L-1磷酸二氢钾溶液175 μL,涡旋振荡混匀2 min,加入甲醇1 mL 和乙腈2.5 mL,混合沉淀蛋白,超声处理20 min,4 ℃ 12 000 r·min-1离心10 min,取上清液于45 ℃氮吹仪下空气吹干,残留物用甲醇400 μL溶解,涡旋振荡2 min,12 000 r·min-1离心10 min,取上清液[1-3]。
2.6方法学考察
2.6.1专属性考察 分别取不同来源的 6 个空白血浆 500 μL,除不加入内标外,其他均按样品处理方法处理(图6A);取质控样品 500 μL,加入混标10 μL,除不加入甲醇外,其他均按样品处理方法处理,得色谱图(图6B);取比格犬给药4.0 h后的血浆样品,按“样品的处理”项操作,得色谱图(图6C)。结果表明,空白血浆中内源性物质不干扰鞣花酸、去氢木香内酯和内标化合物的测定。
2.6.2线性关系考察 取犬空白血浆 500 μL,置于10 mL离心管,依次加入不同浓度鞣花酸和去氢木香内酯对照品溶液100 μL,配成鞣花酸浓度为5.02,20.08,40.16,60.24,80.32,100.4,150.60,251.5,301.20 ng·mL-1和去氢木香内酯浓度为1.006,20.12,40.24,60.36,80.48,100.6,150.9,251.5,301.8 ng·mL-1血浆样品,按“2.5.3”项下方法处理,得鞣花酸线性方程为Y=0.011 5X+0.006 75(R=0.990 8),去氢木香内酯线性方程为Y=0.005 09X+0.001 61(R=0.991 8)。

图5 鞣花酸(A)、去氢木香内酯(B)和芍药苷(C)质谱图
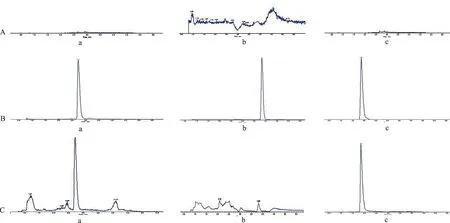
A.空白血浆;B.对照品;C.口服五味金色缓释片(25 mg·kg-1)4.0 h血浆样品加入内标溶液;a.鞣花酸;b.去氢木香内酯;c.芍药苷。
图6 样品色谱图
A.blank plasma;B.reference substance;C.plasma sample (4.0 h after oral administration ofWuweiJinsesustained release tablets at 25 mg·kg-1) spiked with internal standard;a.ellagic acid;b.dehydrocostus lactone;c.paeoniflorin.
Fig.6Chromatogramofthesamples
2.6.3精密度和定量下限 取空白血浆500 μL,加入不同浓度对照品溶液100 μL,配制成高、中、低浓度质控样品,按“2.5.3”项方法处理后进行液相色谱检测,连续测定 3 d(n=6),求得方法日内、日间精密度,结果见表3。本法测定血浆中鞣花酸、去氢木香内酯的定量下限为10 ng·mL-1。
表3 鞣花酸和去氢木香内酯在比格犬血浆中的日内与日间精密度
Table.3Inter-andintra-dayprecisionofellagicacidanddehydrocostuslactoneintheplasmaofbeagledogs

成分与浓度/(ng·mL-1)日内浓度/(ng·mL-1)RSD/%日间浓度/(ng·mL-1)RSD/%鞣花酸 109.86±0.969.749.25±0.818.76 5053.12±2.865.3851.30±1.653.22 250279.20±11.604.15276.42±15.185.49去氢木香内酯 109.37±0.687.269.53±0.778.08 5042.08±2.576.1143.13±2.966.86 250254.00±11.974.71269.00±17.536.52
2.6.4提取回收率和基质效应 取空白血浆,按照“2.5.3”项方法处理,配成鞣花酸和去氢木香内酯低、中、高浓度(分别为 10,50,250 ng·mL-1)血浆药物溶液(n=6 )并记录浓度(A1),同时取空白血浆,沉淀蛋白,吹干后加入鞣花酸和去氢木香内酯和内标芍药苷混合溶液,取样测定,记录浓度(A2)。另取上述 3 个用流动相配制的相同浓度对照品溶液直接进样,测定浓度(B),计算鞣花酸和去氢木香内酯低、中、高浓度的提取回收率[提取回收率(%)=(A1)/(A2)×100%]和基质效应[基质效应(%)=(A2)/(B)×100%]。结果见表4。
2.6.5稳定性实验 取空白血浆500 μL,加入不同浓度对照品溶液100 μL,配制成高、中、低浓度质控样品,测定处理后的血浆样品室温放置12 h、反复冻融3次、-20 ℃放置3 d稳定性。结果表明,测定偏差均在±15%内,表明血浆样品在上述条件下稳定。
表4 鞣花酸和去氢木香内酯在比格犬血浆中的提取回收率和基质效应
Table.4ExtractionrecoveryandmatrixeffectofellagicacidanddehydrocostuslactoneintheplasmaofBeagledogs%,n=6

成分与加入浓度/(ng·mL-1)提取回收率RSD基质效应RSD鞣花酸 1087.066.6291.694.99 5094.786.96103.108.93 25093.883.7899.144.10去氢木香内酯 1085.815.7292.153.35 5092.2810.5997.8210.39 25091.466.9996.514.44
2.7实验结果
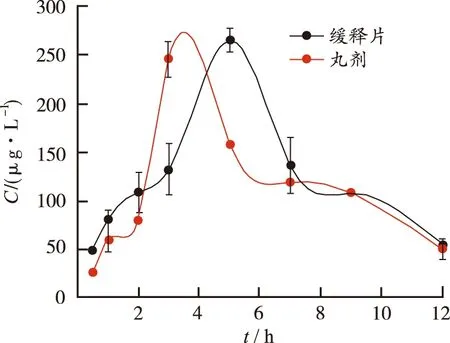
2.7.1血药浓度测定结果 比格犬口服五味金色缓释片与五味金色丸各时间点血药浓度-时间曲线见图7和图8。
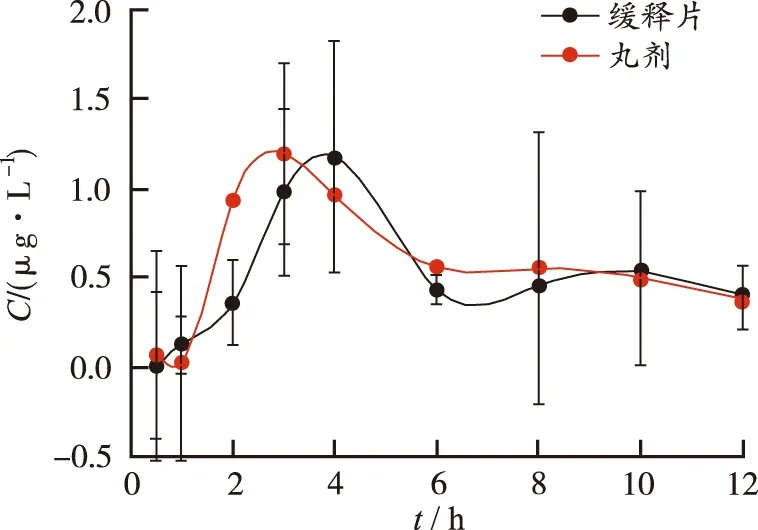



五味金色缓释片与市售缓释丸剂药动学参数比较,AUC差异无统计学意义,说明两者吸收程度生物等效;t1/2、Cmax、MRT差异无统计学意义,提示缓释片具有缓释效果。缓释片tmax显著大于市售缓释丸(P<0.05)。结果表明自制五味金色缓释片在体内缓慢释放,可较长时间维持有效血药浓度,具有更好缓释特征。


3 讨论
药物提取物成分较复杂,导致缓释制剂处方设计和制备工艺较困难。因此辅料与药物的充分研磨及研磨程度对提高片剂崩解和分散均匀性至关重要。HPMC 是最常见亲水凝胶骨架材料,与不溶性骨架材料 EC 10cp联合使用有较好的塑性变形能力,能够将药物粒子较好地包裹,降低药物释放速度[4]。
笔者在本实验选用去氢木香内酯和鞣花酸两种成分作为指标,鞣花酸内含有多酚二内酯,鞣花酸微溶于水,去氢木香内酯含有的倍半萜内酯类成分不溶于水。选择两种性质不同的成分作为药动学含测指标,可更加全面地了解缓释片在比格犬体内的药动学规律。以芍药苷为内标物,对照品与内标物分离度良好,且内源性物质对测定无干扰。经验证,该方法精密度、重复性、回收率均符合生物样品分析要求。
表5 比格犬口服给药后鞣花酸及去氢木香内酯药动学参数
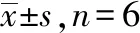

剂型与成分Ka/(h-1)t1/2ztmaxhCmax/(μg·L-1)AUC0-∞AUC0-t(μg·L-1·h)MRT0-tMRT0-∞h五味金色缓释片 鞣花酸1.22±0.1213.77±6.025.00±0.10215.67±22.374 142.76±308.532 566.10±656.0211.43±0.7127.23±2.91 氢木香内酯1.80±0.4510.81±11.634.00±0.170.99±0.1214.60±9.558.98±4.599.63±2.5722.45±14.47五味金色缓释丸 鞣花酸2.03±0.3111.17±5.543.50±0.35①189.00±72.123 885.43±685.622 390.41±156.3312.48±0.1824.10±1.77 氢木香内酯2.26±0.6311.57±3.683.00±0.00①1.28±0.9018.40±9.2213.62±9.3710.59±0.0418.69±5.84
①与五味金色缓释片比较,P<0.05。
①Compared with wuwei jinse sustained release tablets,P<0.05.
鞣花酸在24 h后血药浓度出现上升阶段。原因可能是鞣花酸在比格犬体内存在肝肠循环,鞣花酸分子在肝内生物转化、在胆囊存储、在胆汁中转运和肠重吸收之间需要延迟一段时间[5]。
五味金色缓释片具有较好的缓释效果,且释放更均匀,相同给药剂量,五味金色缓释片AUC略大于市售丸剂。传统丸剂虽然缓释性能不错,但制备工艺原始,丸剂工艺是成型后干燥,批次间可能存在差异,常常造成丸剂质量及临床疗效不稳定。制备成片剂后,有利于质量控制并符合卫生标准,缓释性能更加稳定,批次间差异较小。
