凉粉草不同极性部位抗氧化及对α-葡萄糖苷酶抑制作用研究*
2020-04-07宋晓娟卢晓莹曾唯雅伍铭坤庄伟权严萍詹若挺
宋晓娟,卢晓莹,曾唯雅,伍铭坤,庄伟权,严萍,詹若挺
[广州中医药大学中药资源科学与工程研究中心、岭南中药资源教育部重点实验室(广州中医药大学)、国家中成药工程技术研究中心南药研发实验室、广东省教育厅重点提升平台建设项目—岭南中药资源教育部重点实验室,广州 510006]
凉粉草(MesonachinensisBenth.)又名仙草、仙人草、仙人冻、薪草[1]等,为唇形科(Laiatae)凉粉草属(M.esona B1.)植物凉粉草(MesonachinensisBenth.)的干燥地上部分,其味甘、淡,性寒凉。具有清热利湿、凉血解暑作用,用于中暑、糖尿病、高血压、急性肾炎、风火牙痛、丹毒、梅毒、黄疽[2]等症的治疗。作为药食两用植物资源,凉粉草具有很高营养价值和潜在医疗保健作用,其主要成分是黄酮、酚酸和多糖(凉粉草胶)等[3],具有抗氧化、降血糖、降血脂、降血压、抗病毒、抗缺氧等生物活性[4]。国内凉粉草资源丰富,价格低廉,有广阔的开发利用前景[5]。α-葡萄糖苷酶在人体糖代谢过程中发挥着重要作用,α-葡萄糖苷酶抑制剂可以降低酶活性,减缓碳水化合物分解,从而降低血糖[6]。体外降血糖活性多采用以对硝基苯基-α-D-吡喃葡萄糖苷(4-nitrophenyl α-D-glucopyra-noside,PNPG)为底物的酶抑制剂筛选模型来衡量物质对α-葡萄糖苷酶的抑制活性[7]。酚类化合物是一类活性较强的α-葡萄糖苷酶抑制剂[8],但酚类化合物结构多样,不同结构酚类化合物对α-葡萄糖苷酶的抑制活性及作用机制存在显著差异[9]。凉粉草具有较好的医学应用价值及经济效益,但其资源尚未被系统开发,目前关于凉粉草抗氧化活性及对α-葡萄糖苷酶抑制作用的研究笔者鲜见报道。笔者在本研究采用石油醚、三氯甲烷、乙酸乙酯、水饱和正丁醇等有机溶剂对凉粉草乙醇提取物进行萃取,并分析不同极性部位抗氧化活性及对α-葡糖苷酶的抑制作用,以确定其抗氧化效果及对α-葡糖苷酶抑制作用最佳部位,为进一步研究与开发该植物奠定实验基础。
1 材料与方法
1.1试药 凉粉草药材(产地:广东省平远县上举镇,批号:20140908),经广州中医药大学中药资源科学与工程研究中心詹若挺研究员鉴定为唇形科凉粉草属植物凉粉草的全草。1,1-二苯基-2苦基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH,梯希爱化成工业发展有限公司,批号:1898-66-4)自由基;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[2,2′-azino-bis (3-ethylbenzothiazoline-6-sulfonic acid) diamm- onium salt,ABTS,美国Sigma公司,批号:30931-67-0]自由基;2,4,6-三(2-吡啶基)三嗪(2,4,6-tripyridin-2-yl-1,3,5-triazine,TPTZ,美国Sigma公司,批号:3682-35-7);维生素C(vitamin C,上海融禾医药科技有限公司,批号:170120);α-葡萄糖苷酶(S10050)、阿卡波糖(批号:S11190)、PNPG(批号:S10137)均购自上海源叶生物科技有限公司;没食子酸(Dr.Mao,批号:TN01365);酒石酸钾钠(批号:I1529064)、氯化铁(批号:L1504033)、醋酸钠(批号:J1523067)、过硫酸钠(批号:S106861)均购自上海阿拉丁生化科技股份有限公司;本实验所用分析纯无水乙醇(批号:20180301)、95%乙醇(批号:20151106)、石油醚(批号:20170820)、三氯甲烷(批号:20171105)、乙酸乙酯(批号:20150911)、正丁醇(批号:20170410)均购自天津市致远化学试剂有限公司。
1.2试剂的配制 DPPH溶液:称取DPPH适量,用95%乙醇溶解配制得20 mmol·L-1DPPH溶液。ABTS工作液:ABTS储备液(取ABTS 8.16 mg,加纯化水2 mL,得ABTS储备液)与K2S2O8储备液(取K2S2O81.4 mg,加纯化水2 mL,即得K2S2O8储备液)各1 mL,混合均匀,避光处放置12 h;临用前用95%乙醇稀释,使得其吸光度值在734 nm处为0.700±0.005。铁离子抗氧化能力(ferric ion reducing antioxidant power,FRAP)工作液:取20 mmol·L-1FeCl3溶液,10 mmol·L-1TPTZ溶液,0.3 mol·L-1醋酸钠缓冲盐溶液混合,比例为1:1:10,现配现用。
1.3仪器 1702276E酶标仪(美国BioTek 公司);Alpha 2-4 LDplus真空冷冻干燥机(德国Christ公司);BS224S电子天平(德国Sartorius公司,感量:0.1 mg);XR205SM-DR天平(瑞士Precisa公司,感量:0.01 mg);Milli-Q Synthesis纯水/超纯水系统(美国Millipore公司);KQ5200DE超声波提取仪(昆山市超声仪器有限公司);HWS28电热恒温水浴锅(上海一恒科学仪器有限公司);DZF-6050B电热鼓风干燥箱(上海福玛实验设备有限公司);R1001N旋转蒸发仪(郑州长城科工贸公司);紫外-可见分光光度计(日本岛津公司)。
1.4凉粉草提取物的制备 取凉粉草干燥细粉,加50倍量50%乙醇回流提取2次,每次30 min,过滤,合并滤液,使用旋蒸仪减压浓缩,至有机溶剂完全挥发。转入分液漏斗,加入一定量石油醚,振摇,静置,待溶液完全分层后,取下层水溶液,保留上层石油醚部,下层水溶液同法再萃取,将2次石油醚萃取液合并,减压浓缩后真空冷冻干燥,得石油醚部位。依次用三氯甲烷、乙酸乙酯、水饱和正丁醇按照相同方法萃取。萃取后的剩余水溶液,减压浓缩后真空冷冻干燥。最后得到石油醚部位、三氯甲烷部位、乙酸乙酯部位、正丁醇部位和水部位这5种凉粉草不同极性部位提取物。同时将50%醇提物减压浓缩,真空冷冻干燥,得醇提物部位。
称取凉粉草不同部位提取物,分别置经干燥的10 mL量瓶,加入50%乙醇溶解并稀释至刻度,制备1 mg·mL-1溶液,备用。临用时分别将各样品溶液稀释成5,10,20,40,80,160,320,500 μg·mL-1。
1.5抗氧化活性的测定
1.5.1对DPPH自由基的清除作用 取上述不同浓度待测样品与DPPH溶液各100 μL,先后加入96孔板,震荡均匀,置室温避光反应20 min,酶标仪在517 nm波长处测定吸光度值。以维生素C为阳性对照药,以50%乙醇为空白调零。每份样品平行测定3次,计算样品对DPPH自由基清除率及半数抑制率(IC50)值。清除率(%)=[1-(A1-A2)/A3]×100%。A1表示DPPH溶液与样品溶液混合液吸光度值,A2表示样品溶液与空白溶剂混合液吸光度值,A3表示DPPH溶液与空白溶剂混合液吸光度值。
1.5.2对ABTS自由基的清除作用 取上述不同浓度待测样品40 μL与ABTS工作液160 μL置96孔板,震荡均匀,避光反应6 min,酶标仪在734 nm波长处测定吸光度值。以维生素C为阳性对照药,以50%乙醇为空白调零。每份样品平行测定3次,计算样品对ABTS自由基清除率及IC50值,方法同“1.5.1”项。
1.5.3FRAP值的测定 将待测样品各部位提取物配制到相同且合适浓度,取样品液20 μL与FRAP工作液180 μL置96孔板,震荡均匀,37 ℃恒温箱保温20 min,740 nm波长处测定吸光度值,每份样品平行测定3次,计算FRAP值。配制80,120,160,200,240,280 μg·mL-1FeSO4溶液,以FeSO4为标准物质,浓度为横坐标,吸光度为纵坐标,绘制标准曲线。样品抗氧化能力以 FRAP 值表示:1FRAP单位=1 μg·mL-1FeSO4,即样品抗氧化能力相当于FeSO4的μg·mL-1数。
1.6对α-葡萄糖苷酶活性的抑制作用[10]将不同极性部位提取物稀释成一系列合适浓度待测样品(浓度为0.1,0.25,0.5,1,2,4 mg·mL-1),按表1加入各试剂,加入 pH值6.8的磷酸盐缓冲液 112 μL,加入 0.2 U·mL-1α-葡萄糖苷酶20 μL,抑制剂8 μL(待测样品溶液),混匀,37 ℃下保温10 min。 加入 PNPG20 μL,混匀,37 ℃下保温 10 min,再加入0.2 mol·L-1Na2CO3水溶液80 μL,405 nm波长下测定吸光度,平行测定3份,根据公式计算抑制率。本实验以阿卡波糖作为阳性对照。
表1 α-葡萄糖苷酶抑制实验各试剂加入量
Table.1Dosageofeachreagentinα-glucosidaseinhibitionexperiment

μL
样品抑制作用计算公式:抑制率(%)=[1-(B-b)/(A-a)]×100%。
Calculation formula for sample inhibition: inhibition rate %=[1-(B-b)/(A-a)]×100%.
1.7多酚的含量测定 参考文献[11]中酒石酸法测定多酚,精密移取供试品溶液1 mL,置20 mL量瓶,加入纯化水3 mL,摇匀,加入酒石酸亚铁溶液5 mL,摇匀,加入pH值7.5磷酸盐缓冲液至刻度,摇匀后静置10 min,在波长535 nm处扫描测定。

2 结果
2.1抗氧化活性
2.1.1清除DPPH自由基测定结果 结果见图1。维生素C对DPPH自由基清除作用随着浓度增加呈上升趋势,存在较好量效关系。不同极性部位随着浓度的增加,其DPPH自由基清除作用也不断增加,且乙酸乙酯部位对DPPH自由基清除能力明显高于其他部位。维生素C及凉粉草不同部位提取物对DPPH清除能力强弱为:维生素C>乙酸乙酯部位>正丁醇部位>醇提部位>水部位>三氯甲烷部位>石油醚部位。经统计学分析,浓度为5,10,20,40 μg·mL-1时,维生素C较乙酸乙酯部位差异有统计学意义(P<0.01),当样品浓度为80 μg·mL-1时,乙酸乙酯部位和同浓度维生素C清除率差异无统计学意义。不同浓度乙酸乙酯部位较水部位、三氯甲烷部位和石油醚部位差异有统计学意义(P<0.01或P<0.05),当样品浓度为10,20,40,80,160 μg·mL-1时,乙酸乙酯部位与正丁醇部位和醇提部位差异有统计学意义(P<0.01)。
2.1.2清除ABTS自由基测定结果 结果见图2。维生素C对ABTS自由基清除作用随浓度增加呈上升趋势,存在较好量效关系。不同极性部位对ABTS自由基清除能力随样品浓度增加而增加,其中乙酸乙酯部位对ABTS自由基清除能力最强。维生素C及凉粉草不同部位提取物对 ABTS自由基清除能力强弱顺序为维生素C>乙酸乙酯部位>正丁醇部位>醇提部位>水部位>三氯甲烷部位>石油醚部位。经统计学分析,浓度为5,10,20,40,80 μg·mL-1时,维生素C较乙酸乙酯部位差异有统计学意义(P<0.01),浓度为160 μg·mL-1时,乙酸乙酯部位和同浓度维生素C清除率较接近。浓度在10,20,40,80,160 μg·mL-1范围内,乙酸乙酯部位较正丁醇部位、醇提部位、水部位、三氯甲烷部位和石油醚均差异有统计学意义(P<0.01或P<0.05),当样品浓度达到320 μg·mL-1时,维生素C与各部位对ABTS自由基的清除率差异无统计学意义。
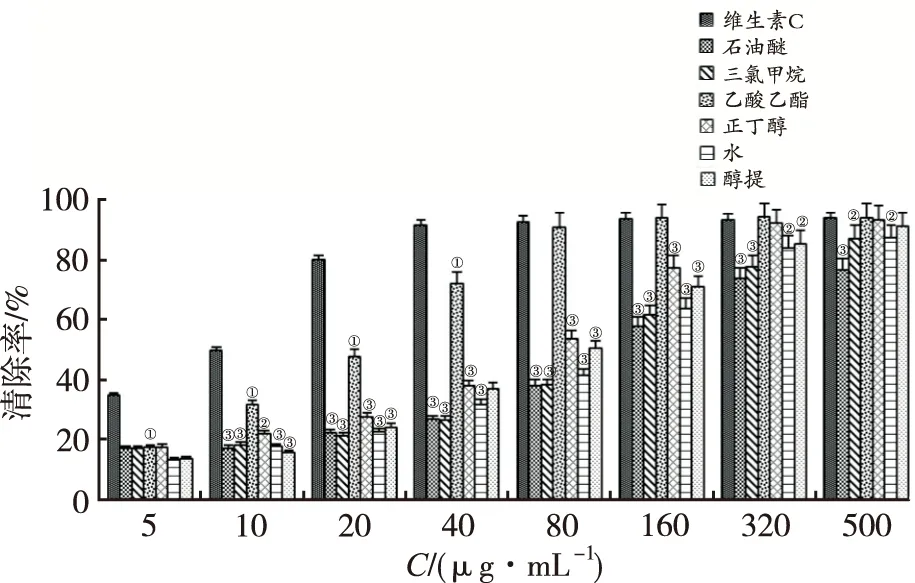
①与同浓度维生素C比较,P<0.01;②与同浓度乙酸乙酯部位比较,P<0.05;③与同浓度乙酸乙酯部位比较,P<0.01;n=3。
图1 不同极性部位对DPPH自由基清除作用
①compared with vitamin C at the same concentration,P<0.01;②compared with ethyl acetate part at the same concentration,P<0.05;③compared with ethyl acetate part at the same concentration,P<0.01;n=3.
Fig.1ScavengingeffectsofDPPH·bydifferentpolarparts
2.1.3FRAP测定结果 FeSO4标准物质线性方程为Y=0.002 3X+0.169 9,R2=0.999 9,说明线性关系较好;由图3可知,FRAP值反映总抗氧化能力的强弱,不同极性部位总抗氧化能力强弱顺序为:乙酸乙酯部位>正丁醇部位>醇提部位>水部位>三氯甲烷部位>石油醚部位。凉粉草其他极性部位总抗氧化能力均显著低于乙酸乙酯部位(P<0.01)。
2.2对α-葡萄糖苷酶抑制作用 从图4可知,阿卡波糖对α-葡萄糖苷酶抑制作用随浓度增加呈上升趋势,存在较好量效关系。凉粉草乙酸乙酯部位、正丁醇部位、三氯甲烷部位、水部位、石油醚部位和醇提部位随着浓度增加,对α-葡萄糖苷酶抑制作用也增加。其中,凉粉草正丁醇部位提取物对α-葡萄糖苷酶抑制作用最强,其次为乙酸乙酯部位。经统计学分析,在浓度为0.5,1,2 mg·mL-1,阿卡波糖较正丁醇部位差异有统计学意义(P<0.01),当样品浓度达4 mg·mL-1时,正丁醇部位和同浓度阿卡波糖抑制率较接近。当样品浓度为0.25,0.5,1,2,4 mg·mL-1时,正丁醇部位较乙酸乙酯部位、醇提部位、水部位、三氯甲烷部位和石油醚均差异有统计学意义(P<0.01或P<0.05)。

①与同浓度维生素C比较,P<0.01;②与同浓度乙酸乙酯部位比较,P<0.05;③与同浓度乙酸乙酯部位比较,P<0.01;n=3。
图2 不同极性部位对ABTS自由基清除作用
①compared with vitamin C at the same concentration,P<0.01;②compared with ethyl acetate part at the same concentration,P<0.05;③compared with ethyl acetate part at the same concentration,P<0.01;n=3.
Fig.2ScavengingeffectsofABTS+bydifferentpolarparts
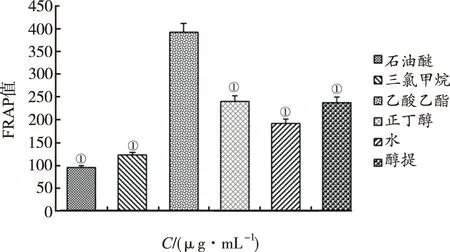
①与乙酸乙酯部位比较,P<0.01。

①compared with ethyl acetate part,P<0.01.

2.3不同极性部位抗氧化活性及对 α-葡萄糖苷酶的抑制作用 由DPPH及ABTS自由基清除率曲线可知,每批不同提取部位抗氧化活性存在差异,但乙酸乙酯部位抗氧化能力均最强,石油醚部位最弱,且均低于阳性对照药维生素C。根据IC50结果,不同批次DPPH及ABTS自由基清除能力顺序为:维生素C>乙酸乙酯部位>正丁醇部位>醇提物>水部位>三氯甲烷部位>石油醚部位。由FRAP实验结果可知,不同批次FRAP值大小为:乙酸乙酯部位>正丁醇部位>醇提物>水部位>三氯甲烷部位>石油醚部位;FRAP值越大,说明总抗氧化能力越强。再结合DPPH及ABTS自由基清除率结果,在一定程度上,DPPH及ABTS自由基清除能力越强,其总抗氧化能力也越强,具有一定的正相关性,见表2。

①与同浓度阿卡波糖比较,P<0.01;②与同浓度正丁醇部位比较,P<0.05;③与同浓度正丁醇部位比较,P<0.01;n=3。
图4 不同极性部位对α-葡萄糖苷酶的抑制效果
①compared with acarbose at the same concentration,P<0.01; ②compared with n-butanol part at the same concentration,P<0.05;③compared with n-butanol part at the same concentration,P<0.01;n=3.
Fig.4Inhibitioneffectofα-glucosidasebydifferentpolarparts
对α-葡萄糖苷酶的抑制实验表明,凉粉草正丁醇部位效果最优,其次为乙酸乙酯部位,结合抗氧化结果可知,凉粉草有效活性部位集中在乙酸乙酯和正丁醇部位。
2.4凉粉草不同极性部位多酚含量 多酚含量最高的是水部位,为12.50 mg·g-1,其次是乙酸乙酯部位(3.41 mg·g-1),之后是正丁醇部位(3.16 mg·g-1)。但抗氧化能力最强的是乙酸乙酯部位,对α-葡萄糖苷酶的抑制效果最优的是正丁醇部位。
2.5相关性分析 为进一步探索凉粉草不同极性部位多酚含量与抗氧化和对α-葡萄糖苷酶抑制作用之间相关性,笔者以Pearson 相关系数衡量不同指标之间相关性。表3表明多酚含量与DPPH IC50、ABTS IC50呈负相关,与FRAP值、α-葡萄糖苷酶IC50呈正相关,但差异无统计学意义。而3个抗氧化指标之间都有很好的相关性(P<0.01),说明某一组分在清除一种自由基能力强时,对剩余2个抗氧化指标的清除能力也强。
表2 凉粉草不同极性部位抗氧化及对 α-葡萄糖苷酶抑制作用
Table.2Antioxidationandα-glucosidaseinhibitionbydifferentpolarpartsofMesonachinensis

提取部位DPPH(IC50)ABTS(IC50)FRAP(Fe2+)(μg·mL-1) α-葡萄糖苷酶(IC50)/(mg·mL-1)石油醚111.7045.2094.540.85三氯甲烷95.8833.89122.360.53乙酸乙酯19.1318.20392.070.35正丁醇52.6724.03240.910.25水82.8728.70192.221.99醇提65.4527.87238.010.79维生素C8.5867.63——阿卡波糖———0.05
“—”表示未进行该实验
“—” indicated that the experiment was not performed
3 讨论
笔者在本实验采用 DPPH 自由基法、ABTS自由基法和FRAP法,对凉粉草醇提物不同极性部位的体外抗氧化能力进行了评价和比较。研究发现各组分均具不同程度抗氧化能力,乙酸乙酯部位抗氧化能力强于其他极性部位。对α-葡萄糖苷酶抑制实验表明,正丁醇部位效果优于其他部位。因此,可初步确定凉粉草抗氧化活性有效成分主要在乙酸乙酯部位,抑制α-葡萄糖苷酶活性成分主要在正丁醇部位。
进一步对凉粉草醇提物及其不同极性部位进行多酚含量测定,结果显示水部位多酚含量最高,这与文献报道中凉粉草水溶性成分中酚酸含量较高一致[12]。虽然石油醚和三氯甲烷部位多酚含量很低,仅有0.32和0.34 mg·g-1,但这两个部位抗氧化和对α-葡萄糖苷酶抑制作用仍有较好活性,说明凉粉草石油醚和三氯甲烷部位的抗氧化作用和对α-葡萄糖苷酶抑制作用的物质基础可能与凉粉草中的多酚类化合物不相关,且由多酚含量与抗氧化和对α-葡萄糖苷酶抑制作用之间的相关性结果也说明了这一点。
笔者在本实验通过评价凉粉草抗氧化活性和对α-葡萄糖苷酶的活性,为深入研究凉粉草活性化合物的结构鉴定,筛选高效抗氧化药物和食品抗氧化剂的研究及其深入开发奠定基础。
表3 凉粉草不同极性部位多酚含量与抗氧化和α-葡萄糖苷酶抑制作用的相关性分析
Table.3Correlationanalysisamongpolyphenolcontent,antioxidantandα-glucosidaseinhibitionofdifferentpolarpartsofMesonachinensis
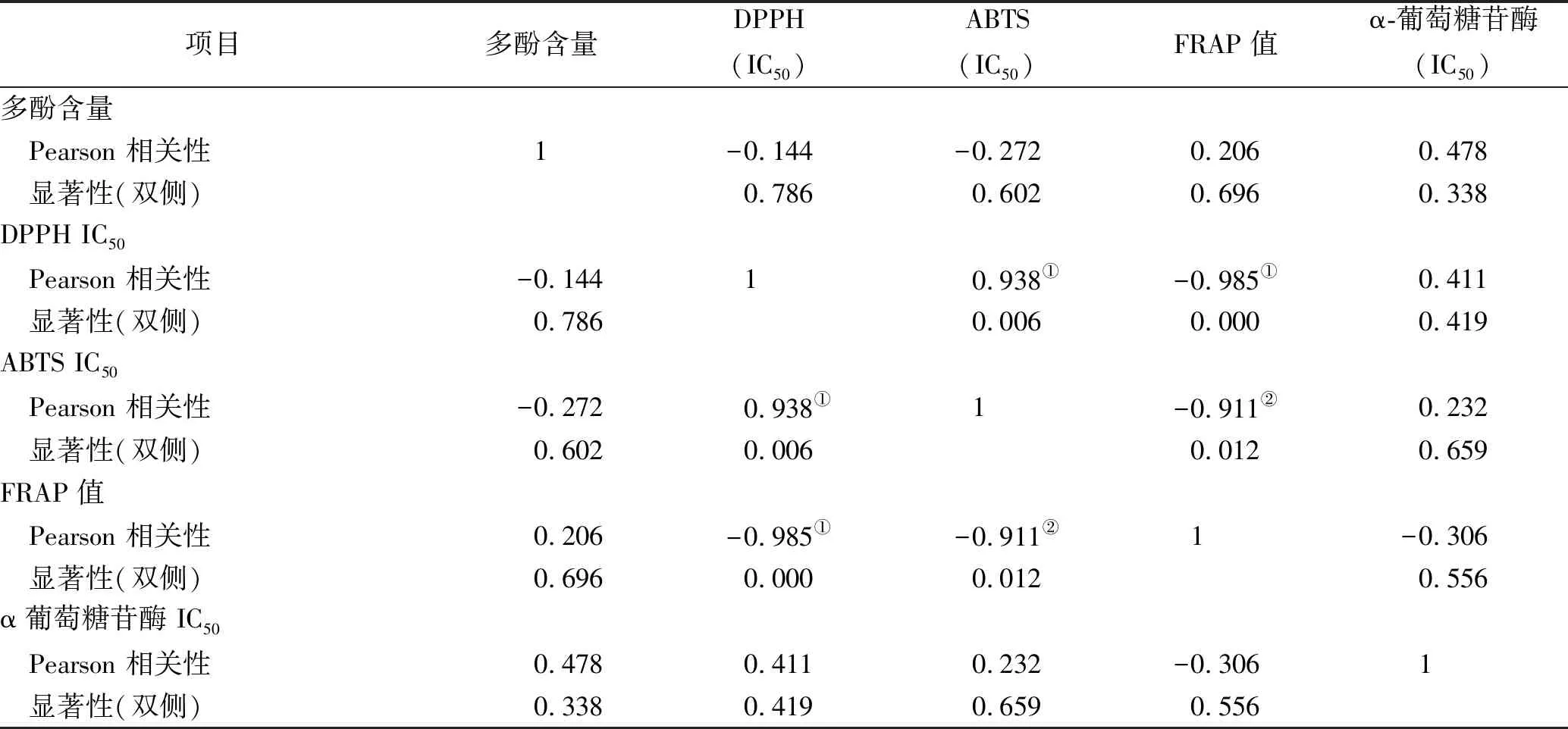
项目多酚含量DPPH(IC50)ABTS(IC50)FRAP值α-葡萄糖苷酶(IC50)多酚含量 Pearson 相关性1-0.144-0.2720.2060.478 显著性(双侧)0.7860.6020.6960.338DPPH IC50 Pearson 相关性-0.14410.938①-0.985①0.411 显著性(双侧)0.7860.0060.0000.419ABTS IC50 Pearson 相关性-0.2720.938①1-0.911②0.232 显著性(双侧)0.6020.0060.0120.659FRAP值 Pearson 相关性0.206-0.985①-0.911②1-0.306 显著性(双侧)0.6960.0000.0120.556α葡萄糖苷酶 IC50 Pearson 相关性0.4780.4110.232-0.3061 显著性(双侧)0.3380.4190.6590.556
①表示在0.01水平上显著相关;②表示在0.05水平上显著相关。
①Showed significant correlation at 0.01 level;②Showed significant correlation at 0.05 level.
