桂籽提取物对大鼠急性肺损伤的作用及其机制*
2020-04-07吕伟闵清王俊杰刘秀晏思齐周凌峰张雨晨刁婷婷白育庭
吕伟,闵清,王俊杰,刘秀,晏思齐,周凌峰,张雨晨,刁婷婷,白育庭
(湖北科技学院1.药学院;2.临床医学院,咸宁 437100)
桂花系木犀科木犀属植物,是我国长江以南地区特色植物资源。桂花种类丰富多样,银桂、金桂、丹桂等都具有较好的开发价值。桂花的花、枝叶、根茎、果实、籽均具有药用价值[1]。《本草纲目》记载桂花籽的药用价值:桂花籽,其性温其味甘,具有行气化湿、祛风止痛、温中散寒之功效;《江苏药材志》记载:桂花籽可暖胃、益肾、散寒[2]。现代研究显示,桂籽含有较丰富的活性物质,如环烯醚萜苷类、三萜类、红景天苷类物质等,环烯醚萜苷为桂籽中主要的物质。环烯醚萜苷类物质在植物中分布广泛,栀子、木瓜等木樨科植物中含量均较高。栀子、木瓜中环烯醚萜苷已被证实有较好的抗炎镇痛作用,桂籽中环烯醚萜苷是否具有用抗炎作用,笔者所见文献报道不多。为更好开发利用桂花资源,笔者初步完成了桂籽提取物的提取及含量测定。笔者在本实验进一步探讨桂籽提取物环烯醚萜苷对大鼠急性肺损伤的保护作用,以期为桂籽的开发利用提供实验依据。
1 材料与方法
1.1实验仪器 arium 611DI型超纯水系统(德国Sartorius公司);AF103AS型制冰机(意大利Scosman公司);HH.W21.600型电热恒温水浴箱(浙江金坛市富华仪器公司);TGL-20M型低温高速离心机(湖南湘仪实验仪器开发有限公司);Synergy2型多功能酶标仪(美国Bio-Tek公司);ZT-12M型全自动生物组织脱水机(湖北孝感亚光医用电子技术有限公司);BX53型光学显微镜(日本奥林巴斯);RE-301型旋转蒸发仪(郑州市亚荣仪器有限公司);BSA224S型BP211 D分析天平(德国赛多利斯集团,感量:0.01 mg);RM2235型手动轮转式切片机(Leica公司);YT-TFB型生物组织摊片机(湖北孝感亚光医用电子技术有限公司);YB-6LF型生物组织石蜡包埋机(湖北孝感亚光医用电子技术有限公司);ChampChemi Basic型自动发光凝胶成像系统(英国Syngene公司);1645050型Power/Pac 300电泳仪(美国Bio-Rad公司)。
1.2试药 桂籽2017年4月下旬采摘于湖北科技学院校园内(咸宁职业技术学院王振启教授鉴定为金阳光品种桂花的籽),去除果皮、果肉,70 ℃ 烘干桂籽,去除籽皮,剥离籽仁,粉碎,过100目筛(筛孔内径:0.15 mm)。95%乙醇(批号:20160628)、石油醚(批号:20160311)、乙酸乙酯(批号:20160308)、正丁醇(批号:20160912)均为国药集团AR级。甲醛组织固定液购于武汉科瑞生物公司(批号:20171120);髓过氧化物酶(myelo peroxidase,MPO,批号:20180812)、肿瘤坏死因子α(TNF-α,YX-201407R,批号:20180613)试剂盒均购于南京建成生物公司;NF-κBp65(批号:20180124)抗体购于Cell Signaling Technology;IκBα(AF1282)抗体购于碧云天生物技术公司(批号:0706181909);酵母购于安琪酵母股份有限公司(1552840,批号:CF20180710W2F33);泼尼松片(批号:170518)购于浙江仙琚制药股份公司。
1.3实验动物 无特定病原体(SPF)级健康雄性SD大鼠,体质量(180±20) g,购于斯贝福北京生物技术有限公司,实验动物生产许可证号:SCXK(京)2016-0002,实验动物合格证号:SCXK(京)2016-0002。温度(23±2) ℃,相对湿度45%~60%,大鼠自由饮水,每只大鼠按5 g·(100 g)-1喂食。
1.4实验方法
1.4.1桂籽粗提物的制备 取粉碎后的桂籽1272.12 g,石油醚(沸程60~90 ℃)12 L冷浸48 h脱脂,抽滤,滤液回收,滤渣阴干。取阴干的滤渣,95%乙醇加热回流提取3次,每次2 h,收集滤液浓缩得到桂籽粗提物573.80 g。浸膏加双纯水1.5 L制成较浓混悬液,依次用石油醚、乙酸乙酯、正丁醇萃取,萃取3次,合并相应萃取液,正丁醇萃取液部分即为下一步研究所用药物。实验组前期已经鉴定,所提物质为环烯醚萜总苷,含量79.08%。
1.4.2大鼠的分组、造模与给药 取健康雄性SD大鼠48只,随机数字表法分为空白对照组、模型对照组、泼尼松组和桂籽粗提物大、中、小剂量组,每组8只,适应性喂养1周,按每只20 g·d-1投喂饲料,自由饮水。适应性喂养结束后,桂籽提取物大剂量组给予桂籽提取物(osmanthus fragrous extract n-butanol portion,OFSN)400 mg·kg-1,中剂量组给予OFSN 200 mg·kg-1,小剂量组给予OFSE 100 mg·kg-1,泼尼松组给予泼尼松3 mg·kg-1,空白对照组和模型对照组给予等容量0.9%氯化钠溶液。连续灌胃10 d。模型对照组和给药组于第10天灌胃结束1 h后腹腔注射20%酵母混悬液,12 h后再次腹腔注射酵母混悬液,并给予相应药物。24 h后经腹主动脉取血,处死大鼠,开胸取肺[3-4]。
1.5检测指标
1.5.1肺指数(lung index,LI) 实验开始前称量、记录各组大鼠体质量,开胸放血,取大鼠全肺记录湿质量,肺湿质量/体质量为肺指数。
1.5.2肺湿/干比(lung wet/dry ratio,W/D) 取大鼠左肺,滤纸吸干表面血液及水分,称定质量,记录湿质量(W)。将称量后肺组织65 ℃烘箱持续烘烤72 h,记录干质量(D)。计算肺W/D。
1.5.3苏木精-伊红(HE)染色 取大鼠右肺上叶,于中性甲醛固定液保存24 h,按步骤对组织脱水、石蜡包埋、HE染色、中性树胶封片,光镜下观察肺病理变化。
1.5.4MPO、白细胞介素2(IL-2)、IL-6、TNF-α测定 取大鼠左肺上叶,按照说明书配置MPO试剂作为匀浆介质,按质量体积比1:19加匀浆介质,制备成5%组织匀浆,按照操作表操作。96孔酶标板进行实验,试剂混匀后,60 ℃ 水浴10 min,取出后在酶标仪上460 nm波长处测定各孔吸光度值,根据公式:MPO活力值(U/克组织湿质量)=(测定A值-对照A值)/11.3×取样量(克),得出各组MPO活力值。
经腹主动脉取血,离心,取上清液。实验操作步骤与测定MPO相同,分别测定血浆IL-2、IL-6、TNF-α含量。
1.5.5Western blotting法检测NF-κBp65及IκBα蛋白表达水平 取右肺下叶,按照组织与裂解液质量体积比1:9进行组织裂解[裂解液中苯甲基磺酰氟(pheylmethamesulfonyl fluoride,PMSF)、cooktail、钒化钠均为1%]。低温高速离心3030×g机4 ℃,12 000 r·min-1离心15 min后收集上清液。二奎琳甲酸(bicinchoninic acid,BCA)法测定组织蛋白浓度,30%聚丙烯酰胺凝胶电泳后转膜,脱脂牛奶封闭,NF-κBp65、IκBα一抗孵育4 ℃过夜,辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗常温孵育1.5 h后,电化学发光法(electro-chemiluminescence,ECL)显色液显色,凝胶成像系统分析目的条带灰度值。

2 结果
2.1W/D、LI、MPO活性测定结果 模型对照组大鼠W/D、LI、MPO活力值较空白对照组显著增加(P<0.05,FW/D=8.060,FLI=4.771,FMPO=22.83),说明模型成功;各给药组W/D(P<0.01)、LI(中剂量组P<0.05,大剂量组P<0.01)、MPO活力值(中剂量组P<0.05,大剂量组P<0.01)较模型对照组下降明显(FW/D中=27.49,FW/D大=31.51,FLI中=2.485,FLI大=1.703,FMPO中=4.192,FMPO大=4.069)。说明桂籽提取物对急性肺损伤大鼠有一定保护作用,结果见表1。
2.2TNF-α、IL-2、IL-6表达情况 模型对照组大鼠TNF-α、IL-2、IL-6表达较空白对照组明显升高(P<0.01,FTNF-α=2.743,FIL-2=13.96,FIL-6=210.8),说明模型成功;各给药组TNF-α、IL-2、IL-6表达较模型对照组明显下降(FTNF-α中=30.17,FTNF-α大=6.903,FIL-2中=11.61,FIL-2大=11.99,FIL-6中=3.728,FIL-6大=6.730),说明桂籽提取物有一定抗炎作用,结果见表2。
2.3NF-κBp65及IκBα蛋白表达情况 与空白对照组比较,模型对照组NF-κBp65表达明显增强;与模型对照组比较,各给药组蛋白表达均不同程度减弱;与空白对照组比较,模型对照组IκBα表达明显减少;与模型对照组比较,各给药组蛋白表达不同程度增强(P<0.01)。提示酵母所致炎症与激活NF-κB信号通路有关。结果见图2,3。
表1 OFSN对SD大鼠W/D值、LI值及肺组织匀浆MPO的影响
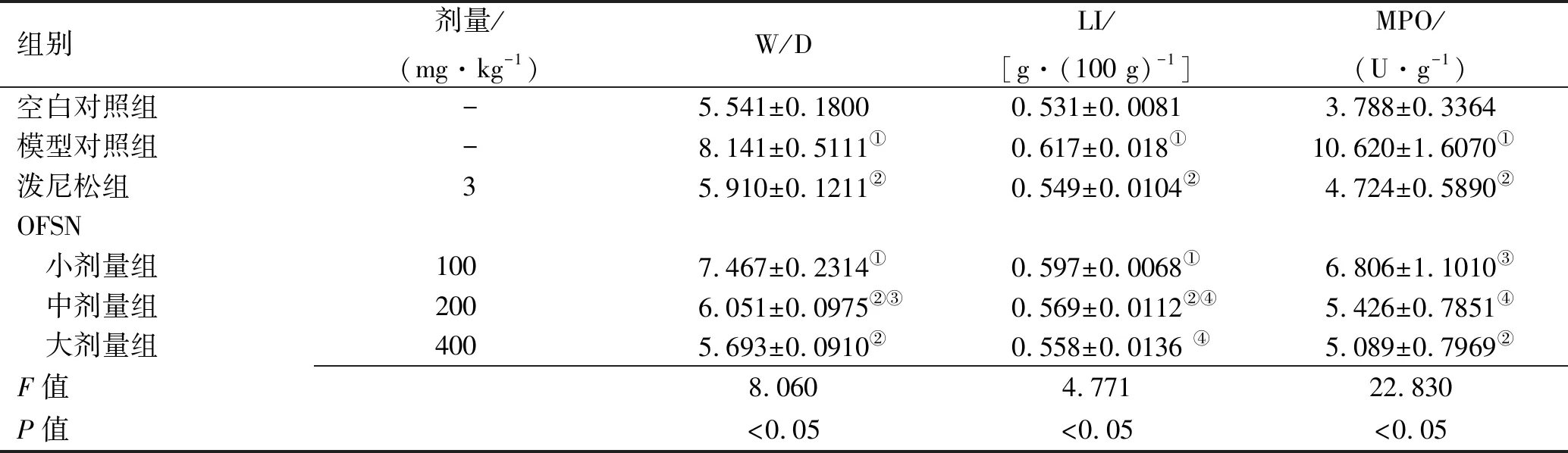
组别剂量/(mg·kg-1)W/DLI/[g·(100 g)-1]MPO/(U·g-1)空白对照组-5.541±0.18000.531±0.00813.788±0.3364模型对照组-8.141±0.5111①0.617±0.018①10.620±1.6070①泼尼松组35.910±0.1211②0.549±0.0104②4.724±0.5890②OFSN 小剂量组1007.467±0.2314①0.597±0.0068①6.806±1.1010③ 中剂量组2006.051±0.0975②③0.569±0.0112②④5.426±0.7851④ 大剂量组4005.693±0.0910②0.558±0.0136 ④5.089±0.7969②F值8.0604.77122.830P值<0.05<0.05<0.05
①与空白对照组比较,P<0.01;②与模型对照组比较,P<0.01;③与空白对照组比较,P<0.05;④与模型对照组比较,P<0.05。
①Compared with blank control group,P<0.01;②compared with model control group,,P<0.01;③compared with blank control group,P<0.05;④compared with model control group,P<0.05.
表2 OFSN对SD大鼠血浆TNF-α、IL-2、IL-6的影响
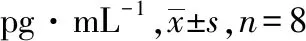

组别剂量/(mg·kg-1)TNF-αIL-2IL-6空白对照组-2.896±0.312923.38±2.100137.4±0.450模型对照组-18.520±0.1890①79.63±7.845①176.6±5.951①泼尼松组33.936±0.6092②27.75±2.795②142.3±2.294②OFSN 小剂量组10017.900±0.4149①③35.88±2.903①②168.3±4.362① 中剂量组2006.021±1.0380②④29.63±2.302②144.2±3.082②④ 大剂量组4003.938±0.4965②27.75±2.266②142.1±2.294②
①与空白对照组比较,P<0.01;②与模型对照组比较,P<0.01;③与模型对照组比较,P<0.05;④与空白对照组比较,P<0.05。
①Compared with blank control group,P<0.01;②compared with model control group,P<0.01;③compared with model control group,P<0.05;④compared with blank control group,P<0.05.
2.4形态学结果 HE染色后光镜下(×20)观察,模型对照组肺间大量炎症细胞浸润,支气管壁明显增厚,各给药组病变较模型对照组明显改善,见图1。
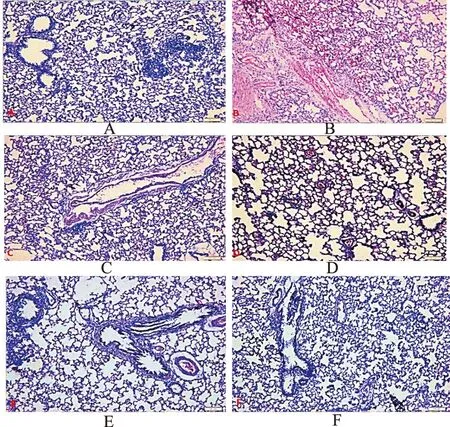
A.空白对照组;B.模型对照组;C.泼尼松组;D.OFSN小剂量组;E.OFSN中剂量组;F.OFSN大剂量组。
图1 OFSN对急性肺损伤的影响(HE,×200)
A.blank control group;B.model control group;C.prednisone group;D.OFSN low-dose group;E.OFSN medium-dose group;F.OFSN large-dose group.
Fig.1EffectofOFSNonacutelunginjury(HE,×200)
3 讨论
急性肺损伤的发生原因较复杂,目前认为主要是由于失控的炎症反应所致,其基本病理变化为肺泡上皮黏膜损伤导致肺部毛细血管通透性改变,从而诱发组织水肿[5]。当机体产生炎症细胞时,炎症细胞浸润于肺部,导致肺部发生炎症反应,甚至炎症反应失控,进一步加重肺损伤。本实验中HE染色结果表明,模型对照组肺部有明显炎性细胞浸润,提示肺损伤发生[6-7]。

①与空白对照组比较,P<0.01;②与模型对照组比较,P<0.01。

①Compared with blank control group,P<0.01;②compared with model control group,P<0.01.
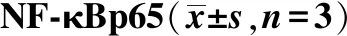
酵母所致急性肺损伤是一种全身性炎症反应。大量中性粒细胞在肺内扣押导致肺部损伤,MPO是反映中性粒细胞多少的重要指标。肺组织匀浆中MPO含量可以直接反映中性粒细胞在肺内浸润情况[8-10]。结果表明模型对照组MPO含量明显高于空白对照组,各给药组含量明显降低。有研究表明,酵母菌进入机体后会被巨噬细胞吞噬,被吞噬后不降解,从而刺激巨噬细胞分泌TNF-α。TNF-α是一种炎性因子,也是促炎因子,是炎症反应最先应答炎性因子,能促进其他炎性因子释放,如IL-2、IL-6等[11],这些炎性因子释放又能进一步激活更多的免疫细胞,从而形成炎性循环。另一方面自由基的累积在炎症发生过程中也扮演着重要角色[12-14]。巨噬细胞受到刺激后产生大量活性氧,与细胞模上的还原性辅酶Ⅰ结合,从而产生大量自由基,自由基累积加重组织损伤[15]。
NF-κB是炎症反应中心,是与炎症相关的重要信号通路[16]。有研究表明,腹腔注射酵母后激活TLR4受体,导致NF-κB特异性抑制蛋白IκB蛋白降解。在IκB的多个亚基中IκBα最重要,本实验通过检测IκBα表达量,发现在炎症通路激活后IκBα降解增多。NF-κB由亚基蛋白p65、p50组成,炎症发生时IκBα降解,从而激活NF-κB p65,调控相关炎症因子基因表达。本实验结果显示,TNF-α表达增强[17]。

①与空白对照组比较,P<0.01;②与模型对照组比较,P<0.01。

①compared with blank control group,P<0.01;②compared with model control group,P<0.01.

本实验结果表明,酵母混悬液所致急性肺损伤模型成功, 模型对照组肺部大量炎症细胞浸润。相关炎症指标在模型对照组含量升高,这一定程度上可能与调控NF-κB信号通路有关。
