豚鼠卵母细胞体外成熟过程中生发泡染色质构型的变化
2020-03-31程万静何滋林李玉明温珊高喜丹尚博高博刘畅华叶婧柳雅玲隋宏书
程万静,何滋林,李玉明,温珊,高喜丹,尚博,高博,刘畅,华叶婧,柳雅玲,隋宏书★
(1.山东第一医科大学病理学教研室,山东 泰安;2.山东第一医科大学组织学与胚胎学教研室,山东 泰安)
0 引言
胚胎工程需要大量优质的成熟卵母细胞,哺乳动物出生后卵巢中的卵母细胞减数分裂一般停滞在第一次减数分裂的双线期,此时的细胞核又称为生发泡(Germinal Vesicle,GV)[1]。性成熟后,黄体生成素(Luteinizing Hormone, LH)峰出现,卵母细胞开始恢复减数分裂,排出一个或多个卵母细胞[2]。目前胚胎工程获得的成熟卵母细胞主要来源于未成熟卵母细胞体外成熟培养(In Vitro Maturation,IVM)[3]。卵母细胞的体外成熟是指将GV期或MI期的卵母细胞在体外培养发育到第二次减数分裂中期 (MII期) 的过程[4]。有研究表明IVM的效率主要取决于卵母细胞自身的质量,而不是体外培养体系[5]。因此如何筛选优质的未成熟卵母细胞,是提高IVM效率的关键。卵子发生过程中,卵母细胞通过改变染色质结构来调节基因的表达,在卵母细胞生长发育过程中生发泡染色质构型发生明显的变化,这在许多动物上均有报道[6]。已经表明,一些动物卵母细胞的生发泡(GV)染色质构型与卵母细胞发育能力相关[7],所以卵母细胞GV染色质构型可能作为判定多种动物卵母细胞质量的标准。
目前关于牛[8],羊[7],猪[9]和小鼠[10]的GV染色质构型已经有许多研究。然而与人类生殖生理学有更多相似的豚鼠[11],GV染色质构型的系统研究未见报道。对于其他动物的研究表明,随着卵泡的生长,卵母细胞逐渐获得减数分裂潜能和发育能力,但是从相同大小卵泡中分离出来的卵母细胞仍然具有异质性,这可能对减数分裂进程,胞质成熟和之后的发育能力有影响[12]。因此,在培养之前,清楚地描述卵巢卵母细胞的形态学和生物学特点,从而获得卵母细胞质量的标准是极为重要的。
在本实验中,我们使用Hoeehst33342对豚鼠生发泡期卵母细胞进行染色。根据染色质凝集的程度,把豚鼠卵母细胞GV染色质分为3种。我们的研究发现GV染色质构型分为染色质弥散型(NSN型)和凝集在核周围型(SN-1型和SN-2型)。随着卵泡的生长,大多数动物(除了山羊外),染色质构型都有一个共同的特点,就是弥散的染色质逐渐在核周围凝集成环[13]。本实验研究了卵母细胞生长成熟过程中染色质构型的变化,这有助于明确染色质构型与成熟能力的关系。对卵母细胞染色质构型变化的研究,有助于在细胞和分子水平揭示卵母细胞减数分裂进程。
1 材料与方法
1.1 实验动物
白色 1月龄雌性清洁级豚鼠(Hartley),体重 200~250g,购自济南金丰实验动物有限公司。动物房保持12h光照-黑暗循环,通风良好,室温维持在23~26℃。本实验动物饲养等程序均严格遵守执行国家《实验动物管理条例》中的各项标准和伦理指南。
1.2 GV染色质构型的制备
将卵母细胞移到含有0.1%透明质酸酶的M2液滴中,用自制玻璃毛细管脱去卵丘细胞。再将脱去卵丘细胞的卵母细胞移到含有10ug/mL Hoechst33342的M2中,在37℃,5%的CO2培养箱中孵育5分钟。最后将卵母细胞放在载玻片上,用盖玻片压扁。先用相差显微镜观察核仁和核膜的形态,然后用正置荧光显微镜观察GV染色质构型。
1.3 卵母细胞体外成熟
IVM培养基是在TCM-199中添加10%(v/v)FCS和10IU/mL PMSG。将10-12个COCs放到100μl的微滴里,表面覆盖石蜡油,培养在37℃,5%的CO2培养箱中。一部分在培养的0,2,4,6小时后,检查IVM的COCs的GV染色质构型,另外一些COCs培养24小时后评估核成熟的能力。
1.4 体外成熟卵母细胞的收集
取1月龄性成熟前雌性豚鼠卵巢,用PBS清洗3遍。在体式显微镜下,用镊子和手术刀剥除多余的脂肪,按卵泡直径分为<0.5mm,0.5-0.8mm和0.8-1.2mm三组。用注射器针头将豚鼠卵巢不同直径的卵泡刺破后释放出卵丘卵母细胞复合体(Cumulus oocytes complexes, COCs),然后用自制玻璃毛细管在体视显微镜下收集形态完整的COCs。在M2液滴中洗3遍。
1.5 数据分析
每次实验至少重复3次,实验数据的处理均由SPSS 17.0软件分析,数据以(mean±SEM )表示。多样本间的数据比较采用单因素方差分析,多重比较使用LSD方法。如果数据不符合单因素方差分析的条件,则采用秩和检验。P<0.05为差异有统计学意义。
2 实验结果
2.1 GV染色质构型的分类
Hoechst33342染色后,用相差显微镜和荧光显微镜观察。根据染色质凝集的程度和核仁核膜的消失,将豚鼠的卵母细胞GV染色质构型分为3种,分别是NSN型,SN-1型和SN-2型。NSN型为染色质不包围核仁,染色质弥散分布在整个核浆区域(Fig.1A,B);SN-1型为部分染色质凝集在核仁周围,部分染色质弥散在核浆内(Fig.1C,D);SN-2型表现为染色质全部呈块状凝集在核仁周围(Fig.1E,F)。

图1 豚鼠卵母细胞GV染色质的构型的分类
2.2 卵泡生长过程中卵母细胞的GV染色质构型变化
表1可见,从不同直径卵泡中获取的卵母细胞GV染色质构型的变化。来源于直径<0.5mm卵泡的卵母细胞GV染色质构型全部为NSN型。随着卵泡的生长,NSN型的比例下降(P<0.05),SN-2型的比例显著增加(P<0.05),而在直径0.5-0.8mm和0.8-1.2mm卵泡中卵母细胞SN-1型百分比差异无统计学意义。

表1 豚鼠不同直径卵泡卵母细胞的GV染色质构型
2.3 豚鼠不同直径卵母细胞的GV染色质构型
表2可见,豚鼠不同直径卵母细胞的GV染色质构型。直径为60-70µm组的卵母细胞GV染色质构型全部为NSN型。直径70-79µm组的卵母细胞,NSN型比例降低,SN-1型和SN-2型百分比升高,但差异无统计学意义。而直径为80-89µm组的卵母细胞NSN型的比例降低(P<0.05),SN-2型的比例显著增加(P<0.05)。

表2 豚鼠不同直径卵母细胞的GV染色质构型
2.4 卵母细胞IVM过程中GV染色质构型的变化
在体外成熟过程中,从直径在0.8-1.2mm的卵泡中获取的卵母细胞,NSN型和SN-1型比例减少,而SN-2型和GVBD型比例增多(见表 3)。
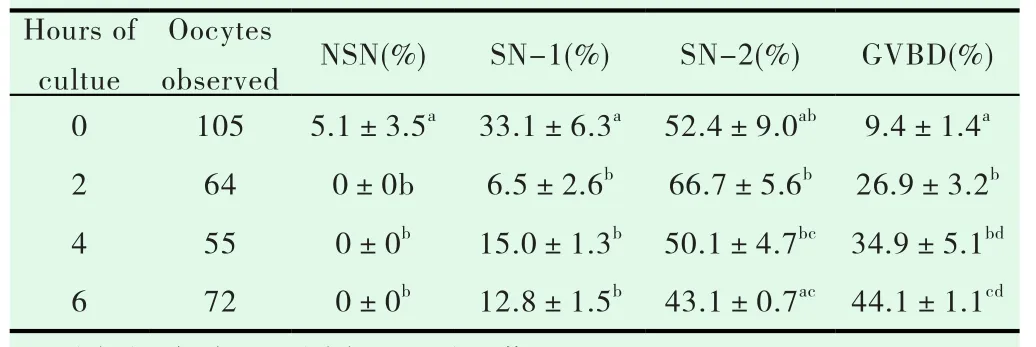
表3 直径0.8-1.2mm卵泡卵母细胞体外成熟过程中GV染色质构型的变化
3 讨论
在本实验中,我们使用Hoeehst33342对豚鼠生发泡期卵母细胞进行染色。根据染色质的凝集程度和分布情况将染色质构型分为3类:染色质弥散型(NSN型)和凝集在核周围型(SN-1型和SN-2型)。豚鼠卵母细胞环绕构型(SN-2)与小鼠的SN染色质构型和人的GV3染色质构型相似。豚鼠卵母细胞部分环绕构型(SN-2)和弥散构型(NSN)的染色质凝集状态与小鼠[10]的pSN和 NSN构型染色质构型类似,这两种染色质弥散分布于整个生发泡中,凝集程度较低。
已经证实,在小鼠[10]、马[14]、人[15]和猴子[16]中,染色质环状凝集在核仁周围,代表了卵母细胞GV构型倾向于排卵。我们研究豚鼠发现,随着卵母细胞的生长和成熟,SN-2构型比例升高,而NSN型比例逐渐降低(表1)。这说明豚鼠卵母细胞染色质构型与卵母细胞的生长成熟有关系,并且染色质环状凝集在核仁周围的构型,即SN-2型更倾向于成熟。
胚胎生物技术越来越需要体外成熟的卵母细胞。虽然已经深入的研究,但是体外产生的可存活胚胎的效率依然远不及体内产生的。目前体外产生胚胎的一个常见问题是卵母细胞胞质不能充分成熟[17]。尽管研究已经表明,随着卵泡的生长,逐渐获得减数分裂能力和胚胎发育能力,但是从同样大小卵泡中获取的卵母细胞具有异质性,这可能解释了染色质构型不同的卵母细胞减数分裂进程,胞质成熟能力和胚胎发育能力的不同[18]。因此,在培养前先根据卵母细胞不同染色质构型,作为衡量卵母细胞质量的标准是十分重要的。
总之,明确豚鼠卵母细胞生发泡染色质构型与体外成熟能力的关系,对于胚胎工程中,动物卵母细胞IVM前筛选优质卵母细胞是十分有价值的。
利益冲突:所有作者均声明不存在利益冲突。
