植物染色质组蛋白H3变体的研究进展
2015-10-21张巧玲位芳臧新田保明
张巧玲 位芳 臧新 田保明

摘要 组蛋白H3是构成染色质的重要成分之一。高等真核生物中,组蛋白H3的氨基酸序列较为保守,在染色质动态变化中,有着非常重要的作用。除共价修饰外,如组蛋白H3甲基化、乙酰化,近期研究表明,动物组蛋白H3变体(H3 variants)也是一种重要的染色质功能调节手段,但对植物中组蛋白H3的报道较少。根据近年最新研究成果,对植物组蛋白H3变体种类及其相关功能进行了总结和讨论。
关键词 H3变体;组蛋白;染色质;植物
中图分类号 S188 文献标识码 A 文章编号 0517-6611(2015)03-022-03
Advances in Chromatin Histone H3 Variants in Plants
ZHANG Qiaoling1, WEI Fang2, ZANG Xin2, TIAN Baoming2*
(1. College of Chemistry and Environmental engineering, Yangtze University, Jingzhou, Hubei 434023; 2. School of Life Sciece, Zhengzhou University, Zhengzhou, Henan 450001)
Abstract Histone H3 was one important component to regulate chromatin activity by covalent histone modifications. Histone H3 that constitutes the nucleosome displays a strong degree of conservation amomg species. However, histone H3 variants exist and it is becoming clear that they play important roles in genome regulation as well. Majority of studies concerned histone H3 variants in transcriptional regulation come from animal models, but emerging data in plants suggest functional conservation, although plantspecific roles are likely to play. Thus we review these data and speculate on the biological significance of H3 variants in plants.
Key words H3 variant; Histone; Chromatin; Plant
基金项目 河南省农业科技成果转化资金项目(112201110022)。
作者简介 张巧玲(1966- ),女,河南许昌人,副教授,硕士,从事生物化学方面的研究。*通讯作者,教授,从事生物技术与遗传育种研究。
收稿日期 20141208
在真核生物中,基因组DNA高度浓缩化形成染色体(或染色质)。在结构上,染色质作为遗传信息的重要载体,是由约147 bp的DNA与八聚体组蛋白H2A、H2B、H3和H4相互作用而构成。作为染色质的重要成分之一,这些组蛋白在高等生物中其部分氨基酸残基是十分保守的[1]。根据DNA合成和核小体组装时期的不同,可以将组蛋白分成两类:一类是与细胞周期中染色体复制紧密相连,参与新合成DNA一起装备成核小体;另一类是与染色体复制无关,在整个细胞周期都能合成并参与核小体装备的组蛋白,与前者相比,这类组蛋白在基因表达调控方面往往具有十分重要的作用[2]。
在大多数真核生物中,染色质组蛋白H3至少包括3种不同类型的变体:着丝粒H3变体(CenH3)由于其N末端氨基酸残基保守性较差,而成为一类,但它对于染色体正常分裂和分离非常重要;标准(或常规)组蛋白H3变体,即组蛋白H3.1,通常在细胞周期的DNA合成期S期合成,与DNA复制紧密相关;相反,另外一类是与DNA复制无关,该类组蛋白变体在细胞周期各个阶段都能合成,即替代型组蛋白H3.3变体。与标准组蛋白H3.1相比,两者在长度和氨基酸残基序列方面较为相似。
高等动物染色质组蛋白变体H3.1和H3.3有4个特异性氨基酸残基变异位点:在标准的H3.1变体中,其氨基酸残基变异序列是A31S87V89M90,而替代型H3.3变体中,其氨基酸残基是S31A87I89G90,这4个位点的氨基酸残基变化对于染色质组蛋白H3功能的转变具有十分关键性的影响[3]。
与动物十分类似,在高等植物中也发现有4个特异性的氨基酸残基变化位点:X31X41X87X90,且41位點的氨基酸改变具有一定的植物特异性[4]。此外,常规组蛋白变体H3.1和替代型变体H3.3在组装核小体过程中都需要特异性分子伴侣[5]。研究表明,在动物中分离纯化的H3.1/H4复合体在DNA复制期有染色质装配因子1(CAF1)与其偶联;而复合体H3.3/H4包含有HIRA蛋白因子。同时,这2种分子伴侣也分别结合其他2种组蛋白分子伴侣ASF1a和ASF1b [6]。
组蛋白变体H3.1和H3.3在染色质装备中具有不同的功能。组蛋白在N末端经翻译后修饰,可以被染色质重塑因子(chromatin remodeling factors)识别,进而影响基因的转录、修复和翻译等。在果蝇和真核动物中,与组蛋白H3.1相比,转录激活标志往往位于H3.3上。然而,部分研究也表明,拟南芥组蛋白H3.1上27位lys甲基化和H3.3上36位lys甲基化都能产生[7]。在果蝇中,H3.3变体与转录活性基因相关[8]。在非洲爪蟾蜍中,H3.3变体与转录激活的表观遗传修饰相关。因此,组蛋白H3.3变体与基因转录激活有关[9]。
与动物相比,尽管一些植物特异性染色质组蛋白H3变体已经鉴定,但这些变体的具体功能目前尚不清楚。基于此,筆者首先对植物中组蛋白H3进行系统分类,然后对近年来关于植物组蛋白H3的研究进展进行较为详细的阐述。
1 植物组蛋白H3基因的多样性
随着部分植物基因组测序的完成,相关研究表明,组蛋白H3基因家族数量和类别与植物进化过程有一定关系。在绿藻中,除着丝粒CenH3变体外,有4个组蛋白H3相关基因(HISTONE THREE RELATED,HTR),然而,在陆生植物中,HTR基因数量约有14个[10]。通过比对不同植物组蛋白H3的氨基酸序列,对不同植物的H3组蛋白进行了分类和统计。Chlamydomonas reinhardtii、Ostreococcus lucimarinus、Physcomitrella patens、Oryza sativa ssp japonica、Zea mays、Arabidopsis thaliana、Populus trichocarpa的HTR基因数量分别为4、4、16、15、14、15、13。
在2种单核藻类中,都有4个HTR基因,而在水稻和玉米以及拟南芥中,有14~15种HTR组蛋白变体[10-11]。
为了区别植物中组蛋白H3.2和H3.3变体,根据基因表达类型不同,H3.1一般不包含内含子;两者在4个氨基酸位点上有显著区别,在组蛋白H3.3中氨基酸位点是T31Y41H87L90,而在H3.1中是A31F41S87A90[12-13]。在拟南芥中组蛋白H3.3变体包括HTR4、HTR5、HTR8和HTR14,在细胞周期的各个阶段都可以检测到,为组成型表达方式。然而,与陆生植物相比,单核绿藻仅含有4个组蛋白H3基因,且对应的H3.3变体只有2种含有内含子。此外,H3.3变体的氨基酸序列与H3.1具有较高相似性,在某些氨基酸上具有特异性[14]。
此外,单核绿藻和高等植物的组蛋白H3.1变体间也有所不同。尽管两者都不包含内含子,但在氨基酸位点上有所变化,如在31、41、87和90位点上,不同植物间也有所不同。因此,可以将组蛋白H3.1分成2个亚组:H3.1A和H3.1B,前者主要是单核绿藻,对于位点是A31Y41(S/Q)87L90;后者是高等植物A31Y41S87L90(图1)。
尽管在植物和动物中组蛋白H3装配的亚基都非常保守,但对植物的研究尚不是很清楚。与动物相比,植物中CAF1复合体的同源成分是FASCIATA(FAS),其中包括FASCIATA1和FASCIATA2以及MULTICOPY SUPPRESSOR OF IRA1。复合体亚基的缺失将导致异常的细胞周期和异染色质的形成[15-17 ]。
图1 不同植物组蛋白变体H3氨基酸残基序列对比[18]
2 组蛋白H3变体与有性生殖
在哺乳动物精子形成过程中,在碱性蛋白和鱼精蛋白的协助下,替代型组蛋白参与精子细胞染色质的浓缩化[19]。同样,在植物雄配子发育过程中,在减数分裂完成后,形成2个生殖细胞(核)和1个营养细胞(核)。然后营养细胞核发育形成花粉管为精核进入胚珠提供通道。在此过程中,尽管没有类似鱼精蛋白的同源物,植物精细胞染色质也同样发生类似的浓缩化过程[20-21]。
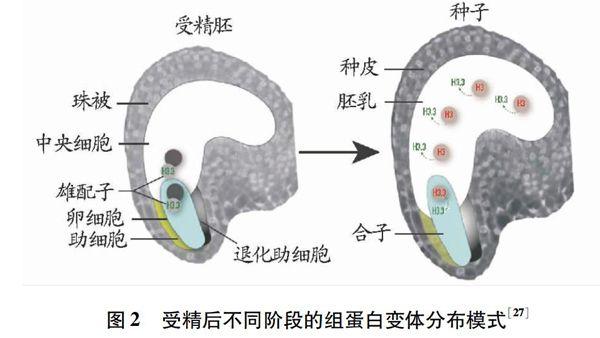
此外,转录分析表明,尽管染色质发生浓缩,但某些基因仍处于转录活性状态。对百合精细胞染色质研究表明,组蛋白H2A、H2B和H3都具有细胞特异性,这些精细胞特异性组蛋白在氨基酸序列上与营养细胞都有一定差异[22]。拟南芥转录因子DUO1可以激化组蛋白变体HTR10的表达,因此,推测HTR10可能与稳定精细胞发育有关,或者与精细胞染色质浓缩化有关[23]。在动物有性生殖过程中,受精后,精子染色质发生去浓缩化,进而与雌配子融合。在此过程中,组蛋白H3.3变体对染色质有重塑作用,去浓缩化后,来源于母本的H3.3变体参与父本精核染色质装配[24]。在果蝇中,此过程同时需要分子伴侣HIRA 和CHD1马达蛋白的协助[25]。在拟南芥中,类似的组蛋白H3变体有同样功能,雄性配子染色质去浓缩化,同时HTR10被切除后,受精过程结束,雌雄配子融合形成合子[26]。尽管在植物中也存在HIRA 和CHD1同源物,但对于HTR10的消除与染色质去浓缩化关系并不清楚[28]。受精后不同阶段的组蛋白变体分布模式见图2。
图2 受精后不同阶段的组蛋白变体分布模式[27]
3 组蛋白H3变体与共价修饰
染色质组蛋白变体上都存在一定修饰,一些修饰在同类组蛋白中是保守的,如H3.1 和H3.3 的N 端有2个保守的甲基化位点。组蛋白变体的修饰有的是在替换之前加上的,有的是在替换之后加上的,但有些修饰对组蛋白变体的功能发挥是必需的,如H2A.X的磷酸化是其DNA 修复功能必需的;CENPA(CenH3)的Ser7 的磷酸化对其在细胞质中的转运是必需的;H4 尾部的Lys5 和Lys12 的乙酰化是复制时H4 的组装所必需的[29-30]。
染色体免疫沉淀(Chromatin immunoprecipitation,ChIP)试验表明,在活跃的染色质内组蛋白的修饰较多,因此转录激活有關的组蛋白变体之上的修饰较多,如组蛋白变体H3.3 的氨基酸残基K9、K14、K18、K23 的乙酰化和K4、K79的甲基化比变体H3.1多2~5倍[31-32]。相反,染色质沉默的标志是K9甲基化,且大部分发生在组蛋白H3.1变体上[33]。
4 问题与展望
细胞可通过2个途径将信息传递到子代细胞中:DNA 密码的遗传和表观遗传。表观遗传的信息包括DNA 和染色质上的印记,具体有以下几方面:①核小体构型的变化(ATP依赖的染色体重构);②DNA 甲基化;③染色体蛋白的改变,包括组蛋白的修饰、组蛋白变体的替换、非组蛋白的改变;④非编码RNA 调控转录。因此,组蛋白变体是决定染色质结构和功能的关键因子之一。
对组蛋白变体的研究是表观遗传学新的研究热点,是对“组蛋白密码”(现在指组蛋白修饰)的新的诠释。相对于已被广泛认可的改变DNA2组蛋白相互作用的机制:ATP 依赖的染色体重构作用以及组蛋白的翻译后修饰,组蛋白的替换对于核小体结构改变作用正逐步显现出它的重要性。
然而,组蛋白H3.3变体与常规的组蛋白H3.1、变体和变体之间是通过什么复合物来完成替换?不同的组蛋白变体怎样改变染色体的结构、影响基因的表达或沉默?组蛋白变体和修饰之间的关系如何?处在不同进化地位的生物其组蛋白变体有何不同?还有多少未知的组蛋白变体?这一系列关于组蛋白变体的疑问正在得到解答,但现有的研究还十分有限,许多具体的分子机制仍不清楚,有待深入研究。
安徽农业科学 2015年
参考文献
[1] MALIK H S,HENIKOFF S.Phylogenomics of the nucleosome[J].Nat Struct Biol,2003,10(11):882-891.
[2] WOLFFE A P,KURUMIZAKA H.The nucleosome:a powerful regulator of transcription[J].Prog Nucleic Acid Res Mol Biol,1998,61:379-422.
[3] HENIKOFF S,AHMAD K.Assembly of variant histones into chromatin[J].Annu Rev Cell Dev Biol,2005,21:133-153.
[4] BERNSTEIN E,HAKE S B.The nucleosome:a little variation goes a long way[J].Biochem Cell Biol,2006,84(4):505-517.
[5] TAGAMI H,RAYGALLET D,ALMOUZNI G,et al.Histone H3.1 and H3.3 complexes mediate nucleosome assembly pathways dependent or independent of DNA synthesis[J].Cell,2004,116(1):51-61.
[6] LOYOLA A,ALMOUZNI G.Marking histone H3 variants:how,when and why? Trends[J].Biochem Sci,2007,32(9):425-433.
[7] DALAL Y,FURUYAMA T,VERMAAK D,et al.Structure,dynamics,and evolution of centromeric nucleosomes[J].Proc Natl Acad Sci USA,2007,104(41):15974-15981.
[8] WATERBORG J H,ROBERTSON A J.Common features of analogous replacement histone H3 genes in animals and plants[J].J Mol Evol,1996,43(3):194-206.
[9] AHMAD K,HENIKOFF S.Histone H3 variants specify modes of chromatin assembly[J].Proc Natl Acad Sci USA,2002,99(S4):16477-16484.
[10] GENDLER K,PAULSEN T,NAPOLI C.ChromDB:the chromatin database[J].Nucleic Acids Res,2008,36:298-302.
[11] QUIVY JP,GRANDI P,ALMOUZNI G.Dimerization of the largest subunit of chromatin assembly factor 1:importance in vitro and during Xenopus early development[J].EMBO J,2001,20(8):2015-2027.
[12] OKADA T,ENDO M,SINGH M B,et alAnalysis of the histone H3 gene family in Arabidopsis and identification of the malegametespecific variant AtMGH3[J].Plant J,2005,44(4):557-568.
[13] TACHIWANA H,OSAKABE A,KIMURA H,et al.Nucleosome formation with the testisspecific histone H3 variant,H3t,by human nucleosome assembly proteins in vitro[J].Nucleic Acids Res,2008,36(7):2208-2218.
[14] HENIKOFF S,FURUYAMA T,AHMAD K.Histone variants,nucleosome assembly and epigenetic inheritance[J].Trends Genet,2004,20(7):320-326.
[15] CHAUBETGIGOT N,KAPROS T,FLENET M,et al.Tissuedependent enhancement of transgene expression by introns of replacement histone H3 genes of Arabidopsis[J].Plant Mol Biol,2001,45(1):17-30.
[16] MENGES M,HENNIG L,GRUISSEM W,et al.Genomewide gene expression in an Arabidopsis cell suspension[J].Plant Mol Biol,2003,53(4):423-442.
[17] KAYA H,SHIBAHARA K I,TAOKA K I,et al.FASCIATA genes for chromatin assembly factor1 in Arabidopsis maintain the cellular organization of apical meristems[J].Cell,2001,104(1):131-142.
[18] DEAL RB,HENIKOFF S.Histone variants and modifications in plant gene regulation[J].Curr Opin Plant Biol,2010,14(2):116-122.
[19] LEWIS J D,SONG Y,DE JONG M E,et al.A walk though vertebrate and invertebrate protamines[J].Chromosoma,2003,111(8):473-482.
[20] BORGES F,GOMES G,GARDNER R,et al.Comparative transcriptomics of Arabidopsis sperm cells[J].Plant Physiol,2008,148(2):1168-1181.
[21] CHEN Z,TAN J L,INGOUFF M,et al.Chromatin assembly factor 1 regulates the cell cycle but not cell fate during male gametogenesis in Arabidopsis thaliana[J].Development,2008,135(1):65-73.
[22] UEDA K,KINOSHITA Y,XU Z J,et al.Unusual core histones specifically expressed in male gametic cells of Lilium longiflorum[J].Chromosoma,2000,108(8):491-500.
[23] BROWNFIELD L,HAFIDH S,BORG M,et al.A plant germlinespecific integrator of sperm specification and cell cycle progression[J].PLoS Genet,2009,5(3):e1000430
[24] ORSI GA,COUBLE P,LOPPIN B,Epigenetic and replacement roles of histone variant H3.3 in reproduction and development[J].Int J Dev Biol,2009,53(2/3):231-243.
[25] BONNEFOY E,ORSI G A,COUBLE P,et al.The essential role of Drosophila HIRA for de novo assembly of paternal chromatin at fertilization[J].PLoS Genet,2007,3(10):1991-2006.
[26] KLAPHOLZ B,DIETRICH B H,SCHAFFNER C,et al.CAF1 is required for efficient replication of euchromatic DNA in Drosophila larval endocycling cells[J].Chromosoma,2009,118(2):235-248.
[27] INGOUFF M,RADEMACHER S,HOLEC S,et al.Zygotic resetting of the HISTONE 3 variant repertoire participates in epigenetic reprogramming in Arabidopsis[J].Curr Biol,2010,20(23):2137-2143.
[28] LOPPIN B,BONNEFOY E,ANSELME C,et al.The histone H3.3 chaperone HIRA is essential for chromatin assembly in the male pronucleus[J].Nature,2005,437(7063):1386-1390.
[29] BANNISTER A J,KOUZARIDES T.Regulation of chromatin by histone modifications[J].Cell Res,2011,21(3):381-395.
[30] WYRICK J J,PARRA M A.The role of histone H2A and H2B posttranslational modifications in transcription:a genomic perspective[J].Biochim Biophys Acta,2009,1789(1):37-44.
[31] NG R K,GURDON J B.Epigenetic memory of an active gene state depends on histone H3.3 incorporation into chromatin in the absence of transcription[J].Nat Cell Biol,2008,10(1):102-109
[32] SCHNEIDER R,BANNISTER A J,MYERS F A,et al.Histone H3 lysine 4 methylation patterns in higher eukaryotic genes[J].Nat Cell Biol,2004,6(1):73-77.
[33] GARCIA B A,THOMAS C E,KELLEHER N L,et al.TissueSpecific Expression and PostTranslational Modification of Histone H3 Variants[J].J Proteome Res,2008,7(10):4225-4236.
