BMP7对脊髓损伤模型大鼠神经病理性疼痛的影响*
2020-03-30王亚平
孟 珂 王亚平
(中南大学湘雅二医院疼痛科,长沙410011)
脊髓损伤(spinal cord injury, SCI)是指外力直接或间接作用于脊髓造成损伤,在相应节段出现运动及感觉功能障碍。部分病人常在1个月内出现神经病理性疼痛,其发生率在26%~96%,严重疼痛的病人超过1/3[1]。这种疼痛复杂而顽固,极大影响病人生活质量[2],甚至导致病人自杀。目前临床上尚无有效的治疗方法,且疗效常随着时间延长效果逐渐降低[3],因此,对新的治疗方法的探索仍具有重要意义。
脊髓损伤后,损伤部位会发生多种细胞活化,其中星形胶质细胞参与了脊髓损伤后神经病理性疼痛的发展。胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)是星形胶质细胞标记物,星形胶质细胞反应性活化、增生,GFAP表达上调,分泌促炎因子、趋化因子等,参与脊髓背角感觉神经元的敏化,在神经病理性疼痛的发生和维持中起到重要作用[4~6]。Gwak等发现,阻止星形胶质细胞活化可减轻神经病理性疼痛[7]。
骨形态发生蛋白(bone morphogenetic protein,BMP)属于转化生长因子-β (transforming growth factor β, TGF-β)超家族,在神经系统发育后期调节神经元和神经胶质的分化,是决定细胞分化命运的关键信号[8]。研究发现,BMPs在神经损伤后表达水平发生改变,可能参与成年期神经组织损伤的修复,例如BMP4参与星形胶质细胞活化和神经病理性疼痛的发展[9,10]。近年来研究表明,BMP7可促进脊髓损伤后神经元存活及运动功能的恢复[11],但是BMP7对神经病理性疼痛的影响,目前尚不清楚,这可能成为影响其治疗价值的重要因素。
脊髓损伤后中枢性痛是临床疼痛诊疗中非常棘手的问题,本研究通过建立大鼠脊髓钝性损伤模型,采用疼痛行为学、免疫荧光、Western blot等方法,拟探讨:脊髓损伤后神经病理性疼痛大鼠脊髓水平BMP7的动态表达变化,以及BMP7对脊髓损伤后大鼠疼痛行为学和GFAP表达的影响,探索BMP7对神经病理性疼痛的影响和可能机制。
方 法
1.实验动物及分组
实验采用清洁级成年雄性SD大鼠60只,8~9周龄,体重300~350 g,购自湖南斯莱克景达实验动物有限公司,动物许可证号:SCXK(湘)2016-0002,在实验开始前1周分笼饲养适应环境,提供充足的水和食物,饲养温度25℃,湿度50%,每12 h光照/黑暗交替循环。
实验分为2个部分,实验1将36只大鼠采用随机数字表法分为三组:对照组(Control组,n= 6)、假手术组(Sham组,n= 6)和SCI模型组(SCI组,n= 24),分别测定三组大鼠手术前、术后3天、7天、14天、28天的50%机械缩足阈值以及腰膨大BMP7和GFAP表达。实验2将24只大鼠采用随机数字表法分为三组(n= 8): SCI组、载体+ SCI组(Vector + SCI组)、BMP7腺相关病毒+ SCI组(BMP7 + SCI组),在损伤后立即在后两组大鼠损伤局部脊髓分别注射腺相关病毒载体(1.84 × 1012v.g/ml)、BMP7 腺相关病毒 (1.84 × 1012v.g/ml)各 2 μl,分别测定手术前后50%机械缩足阈值以及腰膨大BMP7和GFAP表达。
2.主要仪器和试剂
仪器:脊髓打击器 (深圳市瑞沃德生命科技有限公司)、低温超速离心机(eppendorf公司)、Western-blot电泳及转膜槽(Bio-Rad公司)、Clinx显影及成像仪(上海勤翔科学仪器有限公司)、冰冻切片机(德国Leica公司)、荧光显微镜(OLYMPUS公司)。
试剂:BMP7腺相关病毒(rAAV-BMP7,上海吉凯基因化学技术有限公司)、驴血清(Sigma公司),兔抗BMP7(Abcam公司)、Alexa Fluor 594标记驴抗小鼠IgG(Abcam公司)、小鼠抗GFAP(Abcam公司)、小鼠抗GAPDH(Abcam公司)、明胶(Sigma公司)、SDS-PAGE凝胶配制试剂盒(上海碧云天生物技术公司)、ECL发光液(Millipore公司)。
3.Allen's模型建立
4%水合氯醛以350 mg/kg剂量腹腔注射,待大鼠对疼痛刺激无反应后将其以俯卧位固定于实验台,在T9棘突附近沿中线切开皮肤,钝性分离皮下组织和脊柱两侧肌肉,剪除T9椎板,充分暴露脊髓,将大鼠置于打击器底座,并将脊柱钳夹固定,调整打击器位置使撞针位于暴露的脊髓中央,采用10 g砝码从5 cm高度自由下落,撞击撞针造成SCI。假手术组仅剪除椎板,不进行脊髓打击;实验2的大鼠在打击后立即在损伤局部脊髓注射干预药物。
4.行为学测定
将大鼠置于特制的金属网底架上,适应环境30~60 min,待大鼠停止探索活动并安静下来,根据Chaplan等[12]的Up-Down法,用8根von Frey纤维丝(0.4 g,0.6 g,1.0 g,2.0 g,4.0g,6.0 g,8.0 g,15.0 g)刺激大鼠足底中央无脚垫处,使纤维探针弯曲成“S”形,持续8 s,观察大鼠反应,如在刺激时间内或移开探针的瞬间出现快速的缩足、舔足反应,则为阳性,记作“X”,反之为阴性,记作“O”。初始刺激强度2.0 g,出现阴性反应则刺激强度向相邻递增,阳性反应向相邻递减,每次测试间隔1 min,从出现第一次“OX”或“XO”开始,连续记录6次,需要的强度在15.0 g以上或0.4 g以下,直接记为 15.0 g 和 0.25 g。利用公式 10(xf+kδ)/10 000(Xf为最后1根von Frey纤维的对数值,k为序列对应值,δ = 0.224),计算50%机械缩足阈值。
5.蛋白质印迹
取实验1中对照组和余下两组手术后7天、14天、21天、28天大鼠,实验2中术后28天的各组大鼠,各6只,4%水合氯醛麻醉后在冰上取脊髓腰膨大,加裂解液匀浆1 min,低温离心后取上清液,以1:1比例加入上样缓冲液后沸水浴10 min,自然冷却。12%SDS-PAGE凝胶电泳,使用PVDF膜进行转膜,5%脱脂奶粉封闭1 h,分别加入一抗:兔抗BMP7 (1:350),小鼠抗GFAP (1:500),小鼠抗GAPDH (1:1 000),4℃摇床过夜。次日,洗膜3次,每次10 min,加入对应二抗,室温摇床上孵育1 h,洗膜3次,加ECL发光液,采用Clinx显影及成像系统显象并测定灰度值。
6.免疫荧光
取实验2中术后28天的各组大鼠,各2只,4%多聚甲醛灌注后取腰膨大,继续在4%多聚甲醛中外固定8 h,相继置于20%、30%蔗糖溶液中梯度脱水,采用组织包埋剂(Tissue Tek)包埋,液氮速冻。使用冰冻切片机进行冠状切片,厚度20 μm,将切片洗去组织包埋剂后通透10 min,再以10%驴血清封闭30 min,加入一抗:小鼠抗GFAP (1:500),4℃湿盒孵育过夜。次日,使用磷酸盐缓冲液(phosphate buffer, PBS) 洗片3次,每次5 min,加入相应红色荧光二抗,室温下避光孵育1 h,PBS洗片3次,甘油封片,置于荧光显微镜下观察。
7.统计学分析
采用SPSS 22.0对结果进行统计分析,使用GraphPad Prism 7绘制结果统计图。实验所得计量资料以均数±标准差()的形式表示。行为学测试结果采用非参数检验,WB结果采用单因素方差分析进行统计,组间两两比较使用LSD-t检验,以P< 0.05为差异有统计学意义。
结 果
1.SCI诱导大鼠机械痛觉过敏,BMP7表达先减少再逐渐增加,GFAP水平随时间上调50%机械缩足阈结果显示(见图1A):假手术组大鼠手术后3天和7天出现后肢机械缩足阈降低,与对照组相比,差异具有统计意义(P< 0.001),术后14天痛域恢复正常,考虑前期痛域下降为手术因素和炎症刺激所致。模型组大鼠手术后3天后肢机械痛域即出现明显下降,术后7天降至最低值,并持续至第14天,术后21天开始恢复,但直至术后28天,仍然存在显著的机械痛觉过敏,与假手术组比较,差异有统计学意义(P< 0.001)。
Western blot结果显示(见图1B,C):与假手术组相比,模型组术后7天BMP7表达明显下调(P<0.01),14~21天逐渐恢复至正常水平,术后28天表达显著上调(P< 0.01)。与此同时,星形胶质细胞标志物GFAP的表达水平随时间逐渐增加,至损伤后21天达到峰值(P< 0.001),28天开始下降,但与假手术组相比,仍处于较高水平(P< 0.01)。
2.诱导BMP7过表达显著缓解脊髓损伤后机械痛觉过敏
Western blot与免疫荧光结果显示:与局部注射载体相比,BMP7腺相关病毒组在脊髓损伤后28天BMP7表达量显著增多(P< 0.01,见图 2B),表明病毒在大鼠体内存活并成功表达目的蛋白BMP7。与SCI组相比,载体组BMP7的表达水平无明显差异。
行为学结果显示(见图2A):在实验的各个时间点,SCI组和载体组50%机械缩足阈值均无明显差异。与载体组相比较,BMP7组50%机械缩足阈在损伤后14天、21天、28天显著升高(P< 0.001),这表明局部过表达BMP7可抑制脊髓损伤后机械缩足阈的下降。
3.BMP7表达上调显著抑制脊髓损伤后背角星形胶质细胞GFAP表达
Western blot与免疫荧光结果显示:与载体组相比,BMP7组在脊髓损伤后28天GFAP表达明显下调(P< 0.05,见图2C),主要表现为脊髓背角GFAP表达减少(见图3A-C)。这表明局部过表达BMP7可以抑制大鼠脊髓损伤后期背角星形胶质细胞的持续激活。
讨 论

图1 脊髓损伤对大鼠50%机械缩足阈值和腰膨大BMP7, GFAP的影响 (n = 6,)Fig.1 Effects of spinal cord injury on 50% MWT and BMP7, GFAP in lumbar enlargement in rats (n = 6,)
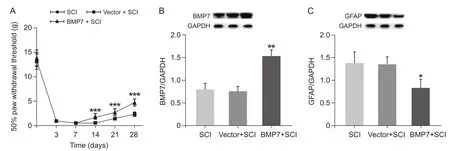
图2 转染BMP7腺相关病毒后脊髓损伤大鼠50%机械缩足阈值和腰膨大BMP7, GFAP表达的变化 (n = 8,)Fig.2 Changes of 50% MWT and expression of BMP7 and GFAP in lumbar enlargement after transfection of BMP7 adenoassociated virus (n = 8,)
脊髓损伤后引起的神经病理性疼痛主要表现为对伤害性刺激疼痛感知的增强,以及对非伤害性刺激的异常疼痛感知,与周围神经损伤相比,这种疼痛更加顽固、范围更大。脊髓损伤后常伴随更加广泛、持久的胶质变化,包括小胶质细胞迅速活化、星形胶质持续激活增生、少突胶质细胞凋亡等。其中,星形胶质细胞通过缝隙连接形成网状结构,将损伤部位的胶质反应传递到远端脊髓[4,6],引起损伤节段上、下的胶质激活,一方面,活化的星形胶质细胞可分泌大量可扩散的神经营养因子,促进神经元存活,另一方面,可产生和释放多种促炎因子和趋化因子,包括一氧化氮、前列腺素、白三烯、P物质、兴奋性氨基酸等,这些物质作用于脊髓背角神经元,可增强其对疼痛的感知和反应,从而导致中枢敏化。本研究发现,大鼠脊髓损伤后3天即出现显著且持久的机械痛觉过敏,同时伴有明显的GFAP表达上调,表明脊髓损伤后星形胶质细胞持续性激活、增生,这与先前的研究基本一致。Gwak等研究表明,应用胶质抑制剂使星形胶质细胞保持静止状态,可降低背角感觉神经元的过度兴奋,缓解神经病理性疼痛[7]。

图3 脊髓损伤后28天腰膨大背角GFAP表达情况Fig.3 Expression of GFAP in lumbar enlargement 28 days after spinal cord injury
BMPs属于TGF-β超家族,目前研究较多的有 BMP2、BMP4、BMP7亚 型。近些年 发现,BMP2可促进体外培养的少突胶质祖细胞分化为星形胶质细胞,BMP4在脊髓损伤后的星形胶质细胞质表达上调[8];BMP7具有神经保护作用,可促进中枢神经系统损伤后运动功能的恢复[12,14]。不同的BMP亚型生物学功能也许不尽相同,但总的来说,BMPs在中枢神经系统发育过程中参与调节神经元、少突胶质细胞和星形胶质细胞的分化,起到决定细胞分化命运的关键作用,并可能参与成年期中枢神经系统损伤后的再生修复调节[8,13,14]。本研究发现,相较于假手术组,脊髓损伤后28天,腰膨大BMP7表达开始上调,同时大鼠的机械缩足阈开始恢复,GFAP表达开始下调,具有时间上的一致性,因此推测BMP7可能参与脊髓损伤后神经病理性疼痛和星形胶质反应的调节,后续转染病毒的结果也证明了这一点。本研究首次发现BMP7组在损伤后28天脊髓背角GFAP表达相较SCI和载体组明显下调,且后肢50%机械缩足阈值显著上升,表明BMP7可能通过抑制脊髓损伤后期星形胶质细胞的持续激活,缓解神经病理性疼痛。然而,也有研究发现,脊髓损伤后前7天鞘内注射BMP7可改善BBB评分,促进运动功能恢复,但对损伤部位GFAP的表达无显著影响[11]。这些结果与本研究所得不同,造成这种差异的原因可能与动物模型、给药方式等因素有关。Chen等[11]在脊髓损伤后前7天给予BMP7,属于损伤早期的干预,本研究采用带有BMP7目的基因的腺相关病毒转染脊髓,可以使BMP7稳定表达,目的蛋白的表达约在损伤后2周,属于损伤后期的干预,BMP7对脊髓损伤后不同的时期其调控机制可能不同,具体机制目前尚不十分清楚,仍有待进一步研究。
综上所述,本实验发现BMP7可减轻大鼠脊髓损伤后神经病理性疼痛,可能是通过抑制脊髓背角星形胶质细胞的持续激活实现的。这为阐明BMP7调控脊髓损伤后的修复及神经病理性疼痛的发展过程提供了实验依据,并为临床治疗神经病理性疼痛提供了新的思路。
