Trx1抑制内质网应激参与运动改善心梗后骨骼肌质量减少
2020-03-16蔡梦昕齐文溥徐祖杰田振军
蔡梦昕,齐文溥,徐祖杰,2,田振军
(1.陕西师范大学 体育学院运动生物学研究所,陕西 西安 710119;2.清华大学 体育与健康科学研究中心,北京 100084)
骨骼肌是人体主要运动器官,具有高度可塑性。多种生理病理刺激可引发骨骼肌萎缩,如肌肉废用、失神经支配、禁食、衰老和系统性疾病(如心血管疾病、癌症)等(Curcio et al.,2020;Von Haehling et al.,2017)。临床研究发现,部分心肌梗死(心梗,myocardial infarction,MI),特别是心力衰竭(心衰,heart failure,HF)患者伴随骨骼肌质量、代谢和功能改变,严重影响患者生活质量(Fülster et al.,2013;Suzuki et al.,2018;Vescovo et al.,2001)。骨骼肌萎缩被认为是慢性心衰患者死亡的独立预测因子(Anker et al.,1997;Von Haehling et al.,2010)。因此,研究心梗病理发展过程中出现骨骼肌质量减少进而诱导骨骼肌萎缩现象的发生机理及干预靶点具有重要意义。
研究表明,心衰后骨骼肌发生氧化应激反应,活性氧(reactive oxygen species,ROS)和系统性炎症水平升高,蛋白质合成/降解比例失调,脂肪酸氧化降低,线粒体出现功能障碍(Gosker et al.,2000;Lavine et al.,2017;Martinez et al.,2015;Springer et al.,2017;Zizola et al.,2013)。ROS爆发可引发细胞Ca2+信号紊乱,蛋白质折叠障碍,产生内质网应激(endoplasmic reticulum stress,ERS)现象。内质网功能紊乱导致未折叠或错误折叠蛋白聚积,激活未折叠蛋白效应(unfolded protein response,UPR),并通过激活ATF6、IRE1-XBP1和PERK-eIF2-ATF4三条信号通路抑制蛋白质合成,清除未折叠蛋白或促进其折叠,发挥保护效应。但持续过度的ERS可激活多条应激反应通路,通过上调ASK1和CHOP表达,活化JNK和Caspase-12(c-Casp-12)产 生 病 理 变 化(Ellgaard et al.,2003;Hetz,2012;Zhang,2010)。研究发现,多种骨骼肌疾病可诱导ERS发生(Zito,2019)。但心梗病理进程中,骨骼肌是否产生ERS,目前鲜见文献报道。
硫氧还蛋白1(thioredoxin,Trx1)是生物体内清除细胞内ROS、抑制氧化应激反应的关键氧化还原调节蛋白(Hanschmann et al.,2013),主要通过与硫氧还蛋白互作蛋白(thioredoxin interacting protein,TXNIP)形成硫氧还蛋白酶体,在机体氧化还原状态调节中发挥重要作用(Lu et al.,2012)。ERS可诱导TXNIP表达,激活炎症反应通路(Lerner et al.,2012;Oslowski et al.,2012)。骨骼肌细胞可分泌 Trx1(Manabe et al.,2014),但 Trx1是否参与降低心梗后骨骼肌ROS水平,改善ERS及其诱导的细胞凋亡有待确证。
临床研究表明,适宜的运动锻炼可有效改善心梗患者心功能和骨骼肌萎缩(Lelyavina et al.,2019),已成为治疗心衰、抵抗运动耐受性降低和改善生活质量的有效辅助疗法(Negrao et al.,2008;Wisløff et al.,2007)。耐力运动可激活正常生理状态下骨骼肌ERS和UPR系统(Kim et al.,2011),但是否可通过抑制ERS改善心梗诱导的骨骼肌质量减少,研究尚少。Trx1抑制ERS在有氧运动改善心梗诱导骨骼肌质量减少中是否发挥作用,目前鲜见文献报道。本文聚焦于Trx1对ERS和细胞凋亡的影响,将为运动改善心梗诱导的骨骼肌萎缩提供新机制,并为相关治疗靶点筛选提供实验依据。
1 材料与方法
1.1 实验动物及模型制备
8周龄雄性C57B6L小鼠(SPF级),20~22 g,购于西安交通大学动物中心(动物使用许可证号为SCXK(陕)2017-003),饲养于陕西师范大学运动生物学研究所动物房,每笼4~5只。动物自由摄食、饮水,室内温度23℃~25℃,湿度40%~60%。小鼠适应性喂养一周后进入实验。动物研究方案符合《实验动物的护理和使用指南》规定。
适养结束后,结扎小鼠左冠状动脉前降支(left anteri‐or descending coronary artery,LAD)制备心梗模型。小鼠固定于手术操作台,采用异氟烷吸入式麻醉,除毛,暴露心前区皮肤,剪皮,选取第3肋和第4肋间隙为操作空间,将心脏于肋间隙处挤出,于左心耳和肺动脉圆锥交界下1~2 mm处进针,结扎LAD,完成后将心脏归位,排气,合胸,缝皮。以心电图和超声心动图结果判定结扎效果,选取变化一致的小鼠共16只,随机分为心梗组(MI)和心梗运动组(MI+ aerobic exercise training,ME),每组 8只。另取8只为假手术组(Sham),只穿针不结扎,作为对照。
ME组小鼠于术后第8天进行跑台持续有氧运动。训练使用8通道跑台,可满足同组小鼠同时运动,减少组内差异。运动方案参照Qin等(2019)的心梗小鼠运动模型和Schefer等(1996)的衰老小鼠运动模型。第1周为适应性训练:初始速度为6 m/min×10 min,每天递增速度和时间,至12 m/min×60 min,共5天;第2~6周为正式训练:跑速为12 m/min,60 min/天,5天/周×6周。运动过程中无动物死亡。
训练结束后次日,采用小动物多普勒超声检测仪检测小鼠心功能变化。小鼠麻醉并仰卧位固定于手术台上,脱毛净胸,超声探头置于左前胸获取M型超声心动图,监测6个连续心动周期,测量并计算左心室收缩期末径(left ventricular internal diameter at end systole,LVIDs)、左心室舒张期末径(left ventricular internal diameter at end diastole,LVIDd)、左心室短轴缩短率(fractional shortening,FS)和射血分数(ejection fraction,EF)。结果显示,与 Sham 组(LVIDs:1.57±0.07,LVIDd:3.10±0.05,FS:49.39±1.11%,EF:83.14±0.75%)相比较,MI组 LVIDs(3.35±0.27,P<0.01)与 LVIDd(4.26±0.24,P<0.01)显著升高,FS(22.96±2.15%,P<0.01)与EF(49.35±3.90%,P<0.01)显著降低;与 MI组相比较,ME 组 LVIDs(2.58±0.12,P<0.01)与 LVIDd显 著 降 低(3.76±0.07,P<0.05),FS(32.22±2.05%,P<0.01)与EF(65.87±2.78%,P<0.01)显著升高。心功能结果证实所采用运动方案安全有效。
1.2 骨骼肌样本处理与组织学实验
心功能检测结束后,迅速分离小鼠胫骨前肌,去除两侧肌腱和结缔组织,称重,取每只小鼠左侧胫骨前肌置于液氮中固定,进行Western Blotting实验。右侧胫骨前肌切分,分别取同部位组织进行生化检测实验,或置于预冷中性甲醛固定保存,进行组织学实验。甲醛固定肌组织48 h后,流水冲洗,常规石蜡包埋,5 μm连续切片。HE染色观察组织结构变化,每组样本随机选取20~30个视野,每个视野随机选取30个肌细胞进行横截面积统计。
1.3 细胞培养与干预
C2C12小鼠成肌细胞购于中国医学科学院基础医学研究所细胞资源中心。使用完全培养基(高糖DMEM,10%胎牛血清和1%青-链霉素双抗)常规培养C2C12细胞(37℃,5% CO2恒温培养),每24 h更换培养液。待细胞密度至80%时,进行干预实验。
细胞分别进行H2O2(400 μM,4 h,37℃,5% CO2)、TXN(30 ng/ul,24 h,37 ℃,5% CO2)和 Trx1抑制剂 PX-12(10 μM,24 h,37 ℃,5% CO2)干预。之后收集细胞,提取蛋白,用于Western Blotting检测。细胞爬片,进行TUNEL染色。
1.4 活性氧和抗氧化能力检测
胫骨前肌组织进行OCT包埋,制备10 μm冰冻切片,DHE染色检测肌组织ROS水平。检测方法严格按照试剂说明书执行。切片滴加清洗工作液,室温孵育5 min,移除后孵育DHE荧光探针染色工作液,37℃避光30 min,PBS洗5 min×3,甘油封片,荧光显微镜下观察并拍照。
抗氧化试剂盒检测肌组织SOD活性和MDA水平。取50 mg肌组织样品,匀浆,2 500 rpm离心10 min,取上清。使用BCA试剂盒测量蛋白浓度。总SOD活性和MDA水平检测步骤按照试剂盒说明书进行。
1.5 Western Blotting实验
提取胫骨前肌组织和细胞总蛋白,具体步骤如下:肌组织50 mg,加入预冷RIPA裂解液500 ul,电动匀浆机匀浆,静置10 min后,12 000 rpm低温离心15 min,取上清;6孔板培养细胞,干预结束后,吸去培养液,加入预冷RI‐PA裂解液200 ul,细胞刮刀刮取贴壁细胞,转移至EP管中,超声细胞破碎仪破碎细胞后静置10 min,12 000 rpm低温离心15 min,取上清。BCA法检测肌组织和细胞总蛋白含量;根据检测蛋白分子量大小配制10%~12%SDS聚丙烯酰胺凝胶,垂直电泳分离蛋白;湿转法将蛋白转移至硝酸纤维素(nitrocellulose blotting membranes,NC)膜;3%牛血清白蛋白(bovine serum albumin,BSA)室温封闭60 min;孵育一抗(3%BSA或5%脱脂奶粉稀释):MuRF1、MAFbx、Trx1、TXNIP、ASK1、p-IRE1α、IRE1α、p-PERK、PERK、ATF6、ATF4、Bcl-2、Bax(1∶1 000 稀释)、CHOP、Casp-12和 JNK(1∶2 000稀释)、GRP78(1∶4 000稀释),4℃过夜;次日复温后Tris缓冲液(tris buffered saline+Tween 20,TBST)洗膜,5 min×3;孵育辣根过氧化物酶(horseradish peroxidase,HRP)标记二抗,室温1 h;TBST洗膜后,ECL检测信号强度。GAPDH作为内部参照。
1.6 TUNEL染色
TUNEL染色检测小鼠骨骼肌细胞和C2C12细胞凋亡情况,操作步骤严格按照说明书进行。切片脱蜡置水,Proteinase K工作液处理组织30 min,37℃;磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗 2次;标本上滴加50 μl TUNEL 反应混合液(50 μl TdT+450 μl荧光素标记的dUTP液,阴性对照仅加50 μl荧光素标记的dUTP液),37℃避光反应1 h;PBS洗3次;甘油封片,荧光显微镜下观察并拍照。每个样本取3张切片,每张切片随机选取20个视野进行检测并拍摄。
C2C12细胞爬片后,甲醛固定30 min,PBS清洗5 min×3;Triton 孵育5 min,PBS洗5 min×3;孵育TUNEL工作液,37℃避光反应1 h;PBS清洗后甘油封片,荧光显微镜下观察并拍照。
1.7 数据处理与分析
光学显微镜拍摄图像,经Image-Pro Plus 5.1软件处理并分析。Western Blotting结果图像经Image J软件处理并分析。所有数据均采用SPSS 17.0软件包进行处理,采用One-Way ANOVA进行统计学分析,实验结果均以平均数±标准误(M±SED)表示,组间显著性差异水平为P<0.05和P<0.01。
2 实验结果
2.1 有氧运动显著抑制心梗小鼠骨骼肌质量减少
HE染色观察并统计胫骨前肌细胞横截面积,计算肌肉相对质量(胫骨前肌质量/体质量)。结果表明,与Sham组相比较,心梗7周后,MI组小鼠肌细胞横截面积和胫骨前肌相对质量显著降低(P<0.01);与MI组相比较,6周运动后,ME组小鼠肌细胞横截面积明显升高(P<0.05),胫骨前肌相对质量显著升高(P<0.01,图1A~C)。
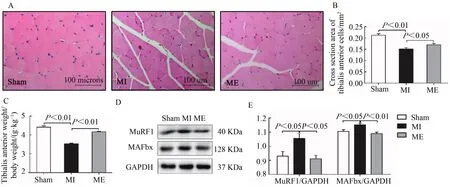
图1 有氧运动增加胫骨前肌细胞横截面积和肌肉相对质量抑制MuRF1和MAFbx蛋白表达Figure 1.Aerobic Exercise Training Increased the Cross Section Area and Relative Muscle Mass of Tibialis Anterior Cells and Inhibited the Protein Expression of MuRF1 and MAFbx
MuRF1和MAFbx是两种重要的骨骼肌特异性E3泛素连接酶,常被用作骨骼肌萎缩的标记。Western Blotting实验检测小鼠肌组织MuRF1和MAFbx蛋白表达。结果显示,与Sham组相比较,MI组MuRF1和MAFbx蛋白表达显著升高(P<0.05);与MI组相比较,ME组二者表达均显著降低(P<0.05,P<0.01,图1D、图1E)。表明,心梗降低小鼠骨骼肌质量,并伴随骨骼肌蛋白泛素化降解,持续有氧运动对骨骼肌质量减少和泛素化降解有改善作用。
2.2 有氧运动显著上调心梗小鼠骨骼肌Trx1表达,抑制TXNIP蛋白表达
Western Blotting检测有氧运动对心梗小鼠胫骨前肌Trx1和TXNIP蛋白表达的影响。结果显示,与Sham组相比较,MI组Trx1蛋白表达显著降低(P<0.01),TXNIP蛋白表达显著增加(P<0.01);与MI组相比较,ME组Trx1蛋白表达明显升高(P<0.05),TXNIP蛋白表达显著降低(P<0.01,图2)。提示,有氧运动可调节心梗后骨骼肌Trx1和TXNIP蛋白表达,改变Trx1/TXNIP复合体状态,参与调节氧化还原水平。
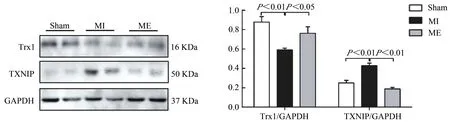
图2 有氧运动上调心梗小鼠胫骨前肌Trx1表达,抑制TXNI PP蛋白表达Figure 2.Aerobic Exercise Training Up-regulated Trx1 Expression and Down-regulated TXNIP Expression in Tibialis Anterior Tissues of MI Mice
2.3 有氧运动显著改善心梗小鼠骨骼肌氧化应激和ERS水平
DHE染色检测骨骼肌ROS水平,生化试剂盒检测胫骨前肌SOD活性和MDA含量,以反映其抗氧化能力。结果表明,与Sham组相比较,MI组胫骨前肌ROS和MDA水平均显著升高(P<0.01),SOD活性显著降低(P<0.01);与MI组相比较,ME组胫骨前肌ROS和MDA水平均明显降低(P<0.05),SOD 活性显著升高(P<0.01,图 3A~D)。提示,心梗后骨骼肌ROS水平上升,抗氧化能力降低,持续有氧运动可降低ROS水平,提升抗氧化能力。
Western Blotting检测小鼠胫骨前肌ERS相关蛋白表达。结果显示,与Sham组相比较,MI组肌组织ASK1、GRP78、磷酸化 IRE1α、ATF6、CHOP、cleaved Casp-12(c-Casp-12)和JNK蛋白表达均升高(P<0.05,P<0.01);与MI组相比,ME组小鼠胫骨前肌GRP78蛋白表达显著上调(P<0.01),ASK1、磷酸化 IRE1α、ATF6、ATF4、CHOP 和 c-Casp-12表达显著下降(P<0.05,P<0.01),JNK表达无显著变化。而磷酸化PERK表达在心梗后和运动后均无显著变化(图3E、图3F)。提示,心梗后骨骼肌ERS水平升高,持续有氧运动可调节ERS相关蛋白,尤其是调节IRE1α和ATF6两条途径,但对PERK途径影响较小。

图3 有氧运动抑制心梗小鼠胫骨前肌ROS水平和ERS相关蛋白表达Figure 3.Exercise Training Inhibited the ROS Level and Regulated the Expression of ERS-related Proteins in Tibialis Anterior Tissues after MI
2.4 有氧运动显著抑制心梗小鼠骨骼肌细胞凋亡
TUNEL免疫荧光染色结果显示,与Sham组相比较,MI组TUNEL阳性颗粒显著增加(P<0.01);与MI组TU‐NEL相比较,ME组阳性颗粒显著减少(P<0.05,图4A、图4B)。Bcl-2可拮抗促凋亡基因Bax,从而抑制细胞凋亡现象,Bcl-2/Bax的比值大小可反映细胞凋亡抑制作用的强弱。Western Blotting结果表明,与Sham组相比较,MI组Bcl-2/Bax的比值显著降低(P<0.01);与MI组相比较,ME组Bcl-2/Bax比值显著升高(P<0.01,图4C、图4D)。提示,心梗后小鼠骨骼肌细胞凋亡,持续有氧运动可调节Bcl-2/Bax比值,有效改善细胞凋亡现象。
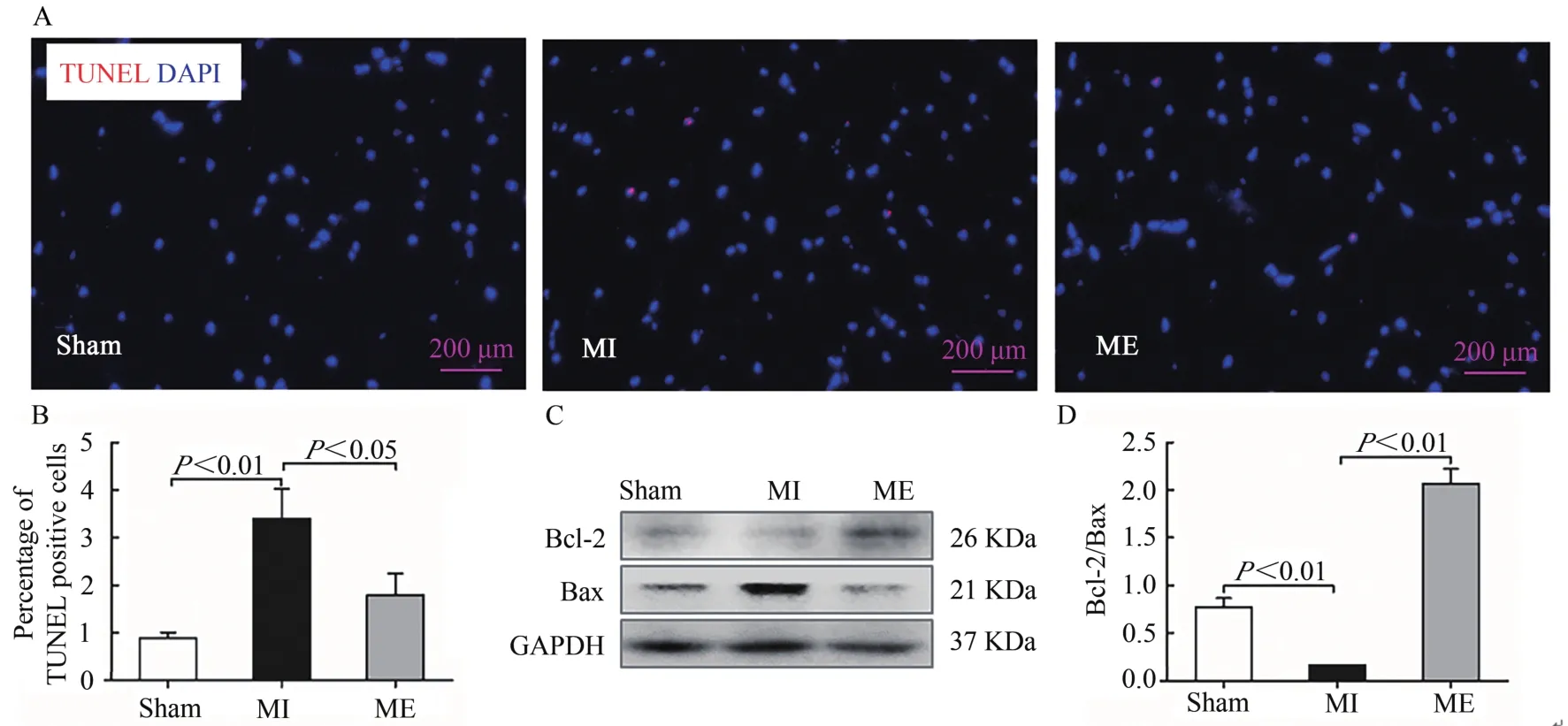
图4 有氧运动改善心梗小鼠胫骨前肌细胞凋亡Figure 4. Exercise Training Inhibited Cell Apoptosis in Tibialis Anterior Tissues after MI
2.5 Trx1显著抑制H2O2处理的C2C12细胞ERS
对C2C12成肌细胞进行H2O2干预,同时进行Trx1重组蛋白TXN和/或抑制剂PX-12干预,Western Blotting检测TXNIP和ERS相关蛋白表达。结果显示,与对照组相比,H2O2可显著增加C2C12成肌细胞TXNIP、ATF6、GRP78、CHOP和c-Casp-12蛋白表达水平(P<0.01)。提示,H2O2诱导C2C12细胞发生ERS,激活其诱导的细胞凋亡途径。与对照组相比,正常细胞PX-12或TXN干预,TXNIP和CHOP表达无显著变化,ATF6、GRP78和c-Casp-12蛋白表达均显著升高(P<0.01);二者联合干预,对TXNIP、ATF6、GRP78、CHOP和c-Casp-12蛋白表达水平均无显著差异。提示,正常条件下,抑制或增加Trx1表达,均可导致ERS反应,二者联合干预抵消其诱导的ERS。与H2O2处理组相比,PX-12干预后,H2O2处理细胞TXNIP、ATF6、GRP78、CHOP和c-Casp-12蛋白表达均无显著变化;TXN干预后,H2O2处理细胞TXNIP和c-Casp-12蛋白表达无显著差异,ATF6、GRP78和CHOP蛋白表达显著降低(P<0.05,P<0.01)。与 H2O2+PX-12组相比,再进行TXN干预显著降低了TXNIP和CHOP蛋白表达,升高GRP78和 c-Casp-12蛋 白表达(P<0.05,P<0.01);与H2O2+TXN组相比,再进行PX-12干预降低TXNIP蛋白表达,但升高ATF6、GRP78和c-Casp-12蛋白表达(P<0.05,P<0.01,图5A~F)。提示,TXN干预可改善H2O2诱导的ERS现象及其激活的细胞凋亡相关蛋白表达,PX-12并未恶化H2O2诱导的ERS现象,但可降低TXN的保护效应。
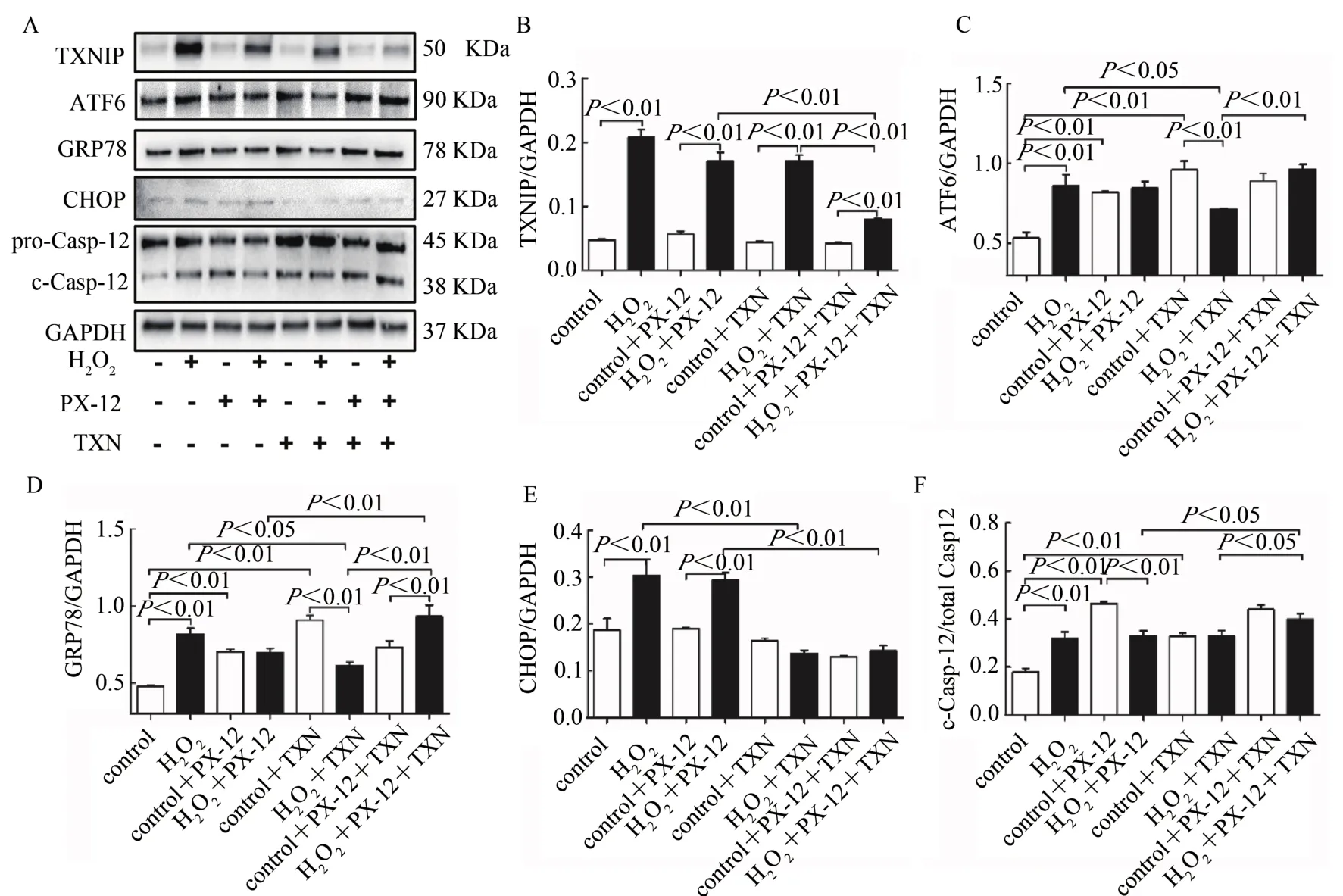
图5 Trx1改善H2O2诱导C2C12细胞ERS相关蛋白表达Figure 5.Trx1 Regulated the Expression of ERS-related Proteins in C2C12 Myoblasts after H2O2Intervention
2.6 Trx1显著抑制H2O2处理诱导的C2C12细胞凋亡
TUNEL检测C2C12成肌细胞凋亡情况。结果显示,与对照组相比,H2O2可显著增加TUNEL阳性细胞比例(P<0.01),提示,H2O2诱导C2C12细胞凋亡。与对照组相比,正常细胞PX-12和/或TXN干预,TUNEL阳性细胞比例无显著变化,提示正常条件下,抑制或增加Trx1表达,未引起细胞凋亡的进一步发生。与H2O2处理组相比,PX-12干预后,H2O2处理细胞TUNEL阳性细胞比例显著增加(P<0.01);TXN干预后,H2O2处理细胞TUNEL阳性细胞比例显著减少(P<0.01)。与H2O2+PX-12组相比,再进行TXN干预显著降低了TUNEL阳性细胞比例(P<0.01);与H2O2+TXN组相比,再进行PX-12干预增加了TUNEL阳性细胞比例(P<0.01,图6)。提示,TXN干预可改善H2O2诱导的细胞凋亡,PX-12加剧了H2O2诱导的细胞凋亡,降低TXN的有效效应。Trx1激活ERS可能为其诱导细胞凋亡的途径之一。
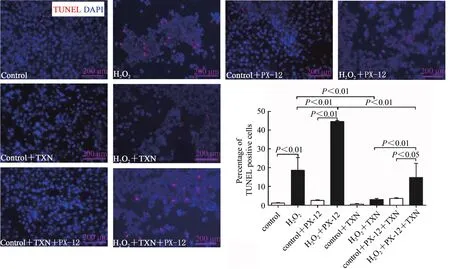
图6 Trx1改善H2O2诱导的C2C12细胞凋亡Figure 6.Trx1 Inhibited H2O2-induced C2C12 Myoblasts Apoptosis
3 分析与讨论
慢性疾病伴随的骨骼肌萎缩影响患者的生存质量,寻求有效改善骨骼肌萎缩的方式方法,探索其发病机制和干预靶点具有重要意义。研究证实,心梗患者进行适宜的运动训练,对于提升心功能、改善机体状态和缓解骨骼肌萎缩具有积极作用,然而其作用靶点和分子机制仍然是现今研究的热点问题。本文通过心梗小鼠运动干预模型,探讨运动是否上调Trx1蛋白表达、改善氧化应激、ERS水平和细胞凋亡,进而缓解骨骼肌质量减少,遏制骨骼肌萎缩的发生;通过细胞实验验证Trx1干预对H2O2处理的C2C12成肌细胞ERS相关蛋白表达和细胞凋亡的影响。本文结果证实Trx1可通过改善ERS水平在运动抑制心梗后骨骼肌质量减少中发挥作用。
3.1 有氧运动改善心梗小鼠骨骼肌质量减少
心梗后心脏泵血功能降低,导致外周血流量减少,可引发多种组织器官结构和功能异常。有文献指出,慢性心衰患者发生骨骼肌萎缩,伴随线粒体密度降低,氧化代谢能力降低,导致运动能力下降(Mancini et al.,1992;Mangner et al.,2015;Wilson et al.,1993)。因此在改善心功能的同时,抑制心梗后骨骼肌萎缩具有重要意义。
心梗7周后,小鼠胫骨前肌相对质量和肌细胞横截面积均下降,提示心梗后病理进程中伴随骨骼肌质量减少。前期研究证实,心梗后可导致大鼠比目鱼肌和胫骨前肌质量减少,而对腓肠肌影响不大(梁巧琴等,2018)。这可能与不同肌肉类型在心梗后的代谢差异以及脂质升高和DNA氧化损伤的程度有关(Mangner et al.,2015)。泛素-蛋白酶系统(ubiquitin-proteasome system,UPS)是受损蛋白质主要的水解途径,在骨骼肌萎缩过程的蛋白降解中扮演重要角色。UPS的过度激活可进一步提示骨骼肌萎缩的发生。MuRF1和MAFbx是主要的E3泛素连接酶的底物,与骨骼肌萎缩直接相关(McKinnell et al.,2004)。本文结果表明,心梗骨骼肌MuRF1和MAFbx蛋白表达显著高于Sham组,说明心梗后骨骼肌UPS水平升高,蛋白降解增强,可能是肌细胞横截面积缩小,骨骼肌质量减少的原因之一。中等强度的有氧运动可安全有效地改善心衰后心功能、骨骼肌异常和运动能力。本文结果证实,6周有氧运动后,胫骨前肌细胞横截面积和肌肉相对质量显著增加,MuRF1和MAFbx表达显著降低,说明有氧运动可有效降低骨骼肌细胞蛋白降解水平,缓解肌细胞面积减小,遏制骨骼肌质量减少现象的发生。
3.2 有氧运动改善心梗骨骼肌氧化应激、ERS及其诱导的细胞凋亡
氧化应激及其诱导的损伤反应是导致骨骼肌萎缩的重要诱因(Coirault et al.,2007;Guarnier et al.,2010)。研究发现,心衰后促氧化和抗氧化反应之间的失衡可导致骨骼肌氧化应激的产生。与健康成人相比,心衰患者骨骼肌中抗氧化酶如SOD、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)等活性下降,而ROS水平升高(Linke et al.,2005)。研究表明,ROS在骨骼肌生理病理过程中发挥重要的信使作用。正常情况下,低水平的ROS可增强细胞适应性,而过度增加的ROS则产生氧化应激,导致肌细胞凋亡/生成比例失调(Li et al.,2019)。本文结果证实,心梗后骨骼肌ROS和MDA水平显著增加,抗氧化酶SOD等活性显著降低,提示心梗骨骼肌氧化应激水平升高,抗氧化能力降低,氧化代谢能力受损。不同的运动方式可调节活性氧类的氧化还原信号(Cai et al.,2018;Henriquez-Olguin et al.,2020)。有研究表明,运动可引起抗氧化酶(包括SOD2、Trx1、prdx3和GPX1)表达的改变,从而限制常见的脑血管病氧化应激的增加。有氧运动可有效抑制心衰后骨骼肌氧化应激水平(Cunha et al.,2012),通过降低NADPH氧化酶活性,改善心衰引起的骨骼肌质量丢失(Cunha et al.,2017)。本文研究结果证实,6周有氧运动后,骨骼肌中抗氧化酶SOD活性高于MI组,且ROS和MDA水平低于MI组。说明,有氧运动可有效改善骨骼肌抗氧化能力,降低氧化应激水平。骨骼肌作为主要的运动器官,在训练过程中可发生适应性变化。规律运动可上调抗氧化分子产生,以抑制ROS产生的负性效应,如中和氧自由基的过度生成,改善骨骼肌组织内环境,使肌肉发生适应性变化(Steinbacher et al.,2015)。因此推测,有氧运动抑制心梗骨骼肌ROS过度增加,改善组织微环境,发挥运动保护效应。
骨骼肌ER在肌肉收缩功能中发挥重要作用。研究表明,ROS的急剧升高可直接导致细胞Ca2+稳态失衡,蛋白质合成、折叠和转运障碍,ER功能紊乱,进一步引发ERS反应(Zhang,2010)。目前研究认为,ERS诱导的UPR通路在多种情况下对骨骼肌质量和代谢功能的调节起着关键作用(Afroze et al.,2019)。ERS反应对于维持正常骨骼肌质量和功能至关重要,完全抑制ERS反应可诱导癌症恶病质中的骨骼肌萎缩(Bohnert et al.,2016)。而肌萎缩性侧索硬化症(ALS)小鼠中,症状出现前早期骨骼肌ERS反应被激活,并随着疾病的进展而增加,ALS转基因小鼠中PERK、IRE1α、GRP78和CHOP表达显著增加,且快肌表达水平高于慢肌,表明肌细胞应激导致蛋白质转化减少,发生肌萎缩(Chen et al.,2015)。Deldicque等(2013)指出,ERS可直接影响骨骼肌质量,长期过度的ERS可导致细胞死亡,阻断肌肉合成代谢,导致肌肉质量下降。本文结果显示,心梗后骨骼肌ERS相关蛋白表达显著增加,说明骨骼肌存在内质网功能障碍,其原因可能与氧化应激水平升高导致的Ca2+稳态失衡有关,同时发现凋亡诱导信号ASK1、CHOP、c-Casp-12和JNK均表达升高,TUNEL阳性结果增加,Bcl-2/Bax比值降低,说明心梗骨骼肌中存在ERS诱导的细胞凋亡,可能是骨骼肌质量减少的重要机制。有研究提出,衰老过程中UPR反应蛋白表达逐渐降低,运动可通过增加伴侣分子表达,恢复UPR反应,降低ERS诱导的细胞损伤(Deldicque,2013)。本文结果表明,运动下调磷酸化 IRE1α、ATF6、ATF4、ASK1、CHOP和c-Casp-12蛋白表达,说明在一定程度上抑制了ERS水平及其诱导的凋亡信号,但同时运动上调了GRP78蛋白表达,这与文献报道一致,说明运动可能通过激活分子伴侣表达,促进正性ERS反应,维持体内平衡,但同时抑制ERS凋亡信号,降低细胞凋亡的发生。运动作用的具体分子机制及其对各个ERS下游通路的调节作用仍需进一步研究。
3.3 有氧运动上调Trx1表达改善骨骼肌ERS的可能机制
正常生理状态下,机体存在抗氧化防御体系,来维持细胞内氧化还原稳态。Trx1是机体重要的内源性氧化还原调节蛋白,可将二硫化物还原成硫醇基团来还原被氧化的蛋白,并调控细胞ROS水平,调节细胞氧化还原状态。目前关于Trx1对机体的保护效应多集中在改善炎症反应和氧化应激损伤等方面,对于心梗骨骼肌Trx1与ERS的研究报道有限。有研究发现,Trx1过表达可抑制败血病小鼠血浆和肺中炎性因子及ERS标志蛋白表达,并认为Trx1可通过抑制ERS调节炎性应答(Chen et al.,2016)。对帕金森综合征的研究发现,降低Trx1表达可导致PC12细胞ERS反应,过表达Trx1调节ERS相关蛋白变化,抑制诱导的ERS反应(Zeng et al.,2014)。此外,ERS反应中可形成IRE1-TRAF2-ASK1复合物,诱导细胞凋亡(Homma et al.,2009;Nishitoh et al.,1998)。而Trx1可与ASK1 N端的Trx结合域结合,从而抑制ASK1的活化(Kekulandara et al.,2018;Powis et al.,2001)。据此推测,上调骨骼肌Trx1表达,是抑制ERS反应及其诱导细胞凋亡水平的重要途径。
TXNIP能够与Trx1结合形成Trx1/TXNIP氧化还原酶体,通过二硫键交换抑制Trx1还原活性和表达(Nishiya‐ma et al.,1999;Yoshihara et al.,2014)。 ROS 可 促 进TXNIP从细胞核转位入细胞质,激活ASK1、NLRP3等细胞凋亡和炎症相关蛋白表达(Mohamed et al.,2014)。而ROS诱导的ERS通过PERK和IRE1α进一步促进TXNIP在转录水平和转录后水平的表达(Lerner et al.,2012;Os‐lowski et al.,2012),抑制ERS元件可下调脑损伤后TXNIP的表达,提示TXNIP在ROS和ERS及其诱导的细胞凋亡过程中发挥重要作用(Zhao et al.,2017)。本文结果发现,心梗后骨骼肌Trx1蛋白表达显著下降,TXNIP表达显著增加,二者表达比例发生变化。其原因可能是骨骼肌ROS水平持续升高,ERS反应过度,激活了TXNIP表达,进而抑制Trx1活性和表达。6周持续有氧运动后,骨骼肌Trx1蛋白表达显著高于心梗组,TXNIP表达显著降低,说明运动可激活Trx1表达,抑制TXNIP对Trx1的调节作用。Trx1表达升高可调节多种抗氧化酶活性,如SOD(Das et al.,1997),进一步清除组织ROS,改善氧化还原状态。推测,运动抑制了心梗后骨骼肌ROS水平,降低ERS反应,抑制TXNIP表达,进而减弱TXNIP对Trx1的抑制作用。运动上调Trx1表达可进一步抵抗心梗后骨骼肌ROS,缓解ERS反应,进而降低TXNIP表达,形成良性循环。
为进一步研究Trx1是否参与调节ERS反应,本研究对C2C12细胞进行H2O2干预,模拟氧化应激损伤,验证外源性进行Trx1重组蛋白和抑制Trx1对ERS和细胞凋亡的影响。结果显示,正常条件下,抑制或增加Trx1表达,均可导致ERS反应,但细胞凋亡水平无显著变化,证实Trx1在细胞正常生理功能维持中发挥重要作用,其表达或作用功能异常均可使细胞产生应激,导致代偿性的ERS反应,调节细胞ER稳态,促使细胞恢复正常生理功能。H2O2干预使C2C12成肌细胞TXNIP及ERS相关蛋白及其凋亡途径蛋白表达显著上调,细胞凋亡程度显著增加,证实氧化应激损伤可激活ERS反应和TXNIP的表达水平,启动凋亡信号,诱导细胞凋亡。TXN干预有效降低ATF6、GRP78和CHOP蛋白表达,但对TXNIP蛋白表达影响不大,说明上调Trx1蛋白可有效降低氧化应激导致的ERS水平,降低细胞凋亡,其对TXNIP及其他ERS相关蛋白的调节作用程度不同,Trx1介导的直接途径仍需进一步研究探讨。PX-12干预并没有进一步加重ERS水平,但细胞凋亡程度显著增加,PX-12可降低TXN对ERS及细胞凋亡的有效抑制效应,推测ERS途径可能是Trx1抑制细胞凋亡的途径之一。
综上推测,心梗诱导骨骼肌ROS水平升高,Trx1蛋白表达减少,抗氧化能力降低,诱导ERS水平升高;ERS可进一步激活TXNIP蛋白表达,降低Trx1蛋白表达,进一步增加ROS水平,形成恶性循环,从而导致骨骼肌细胞凋亡和质量丢失。升高Trx1水平可缓解氧化应激导致的ERS反应,抑制细胞凋亡水平。有氧运动可上调Trx1蛋白表达,抑制TXNIP表达,改善ROS和ERS水平,抑制心梗后骨骼肌细胞凋亡,从而缓解骨骼肌质量丢失,遏制骨骼肌萎缩的发生(图7)。
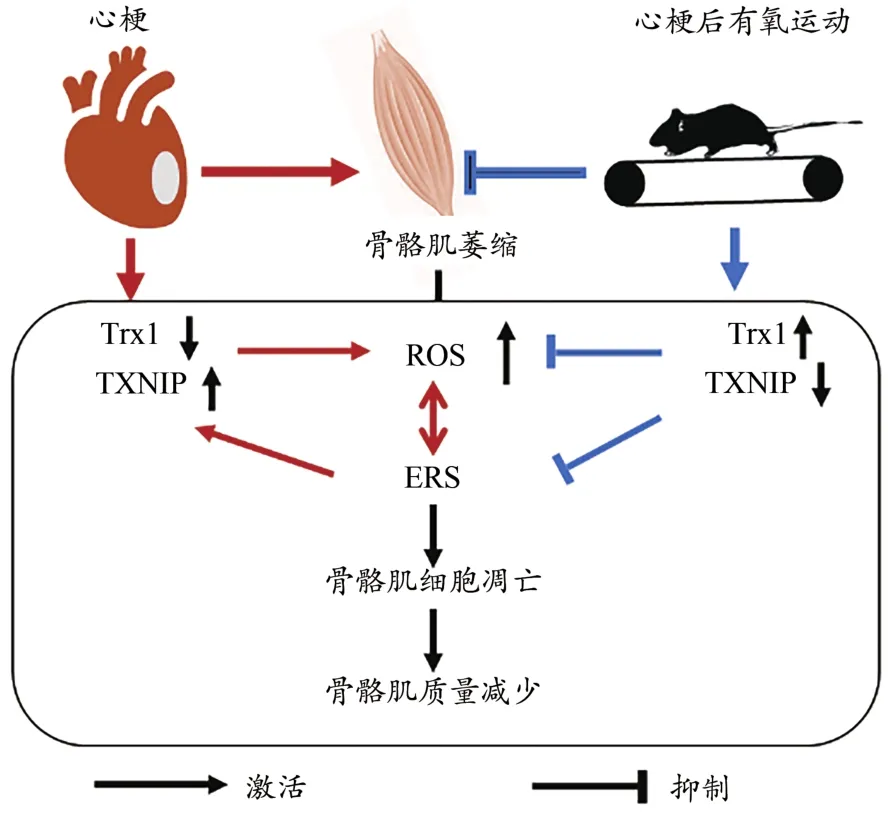
图7 运动上调Trx1抑制心梗小鼠骨骼肌质量丢失可能机制Figure 7.Possible Mechanism of Exercise-induced Trx1 in Inhibiting the Loss of Skeletal Muscle Mass after MI
骨骼肌可为机体运动、姿势维持和呼吸提供机械动力,同时,在调节机体新陈代谢方面发挥重要作用。骨骼肌与多种组织器官存在“交叉对话”,并可发挥内分泌功能。多种病理条件和衰老都可导致骨骼肌质量减少,甚至发生骨骼肌萎缩现象。如何有效抑制骨骼肌萎缩的发生,缓解病理进程的发展,已成为运动医学领域关注的热点问题。目前针对运动改善骨骼肌萎缩的分子机制研究,主要集中在运动促进肌浆网钙释放和再摄取,促进蛋白合成,降低UPS过度激活,降低炎性水平,提高有氧代谢能力和促进生长因子表达等方面。本研究针对心梗诱导慢性心衰过程中并发的骨骼肌萎缩现象,从氧化应激-ERS-细胞凋亡这一途径,探讨运动改善骨骼肌质量减少的可能机制。研究结果显示,上调心梗骨骼肌Trx1表达可能是运动改善骨骼肌氧化应激,降低ERS反应,抑制肌细胞凋亡,缓解骨骼肌质量减少的重要靶点。
本文仍存在不足之处:1)通过细胞实验初步确定Trx1参与运动改善ERS水平,抑制细胞凋亡,缓解骨骼肌质量减少,但未进行动物体内抑制或过表达Trx1对骨骼肌ERS和细胞凋亡的影响等相关实验,关于Trx1在运动保护效应中的作用及所占效应比例值得进一步研究。2)氧化应激在骨骼肌萎缩中发挥重要作用,如调节UPS系统的活性,促进炎症反应等,本文聚焦于ERS反应,缺乏对炎症反应和UPS系统在运动保护效应中的探讨,氧化应激、ERS、炎症反应以及蛋白降解之间的关系值得深入探索。3)运动可激活多种肌肉因子表达,参与抑制骨骼肌萎缩(Piccirillo,2019),有研究发现促进骨骼肌生长有助于改善梗死后心脏功能(Araki et al.,2012)。肌肉因子的表达是否可改善ERS及其引发的肌细胞凋亡?运动改善心梗后心功能,是否与其对骨骼肌萎缩的改善效应及生长促进效应有关?运动如何加强骨骼肌和心脏之间的“交叉对话”,其中参与的肌肉因子筛选及可能机制值得进一步探讨。
4 结论
Trx1在改善ERS水平及其诱导的细胞凋亡过程中发挥重要作用;有氧运动可上调心梗骨骼肌Trx1表达,降低氧化应激水平,缓解ERS反应和细胞凋亡,降低蛋白泛素化降解过程,抑制心梗后的骨骼肌质量减少。
