杂交技术培育金针菇尿嘧啶营养缺陷型双核体菌株
2020-03-11鲍大鹏万佳宁卢绪志余养朝张光忠茅文俊王周陈力
鲍大鹏 万佳宁 卢绪志 余养朝 张光忠 茅文俊王 莹 周陈力
(1上海市农业科学院食用菌研究所/农业农村部南方食用菌资源利用重点实验室/国家食用菌工程技术研究中心/上海市农业遗传育种重点开放实验室,上海 201403;2江苏华绿生物科技股份有限公司,江苏 泗阳 223700)
金针菇[Flammulina velutipes(Fr.)Singer.]是一种重要的栽培食用菌,因其味道鲜美,口感脆嫩滑爽,且具有较高的营养价值、药用价值,深受广大消费者青睐,市场前景较好[1-2]。金针菇栽培产业的健康发展依赖优良菌种。金针菇菌种通常以无性繁殖方式进行复制,而优良菌种的选育需要投入大量的人力、物力和时间成本[3-4]。因此对金针菇菌种的开发与研究具有重要意义。
营养缺陷型菌株是指经过人工诱变或自然突变丧失了合成某种营养物质能力的菌株,其在基本培养基中无法正常生长,只能在完全培养基或者在补充特定营养物质的基本培养基上才可以正常生长[5]。目前在真菌中已报道的营养缺陷型菌株的筛选标记有腺嘌呤[6]、组氨酸[7]、亮氨酸[8]、蛋氨酸[9]、尿嘧啶[10]、色氨酸[11]、核菌素[12]、精氨酸[13]、肌醇[14]、脯氨酸[15]等。尿嘧啶是常见的筛选标记,且尿嘧啶合成代谢路径中的关键酶编码基因pyrG已经被成功克隆;pyrG编码的乳清苷-5′-磷酸脱羧酶(orotidine-5′-phosphate decarboxylase,OMPDC)能够催化真菌中尿嘧啶合成途径的最后一步酶反应,通过脱羧作用催化乳清酸核苷酸转化为尿苷酸[16-17]。5-氟乳清酸(5-fluoroorotic acid,5-FOA)是尿嘧啶合成途径中乳清酸核苷酸的底物类似物,能够被pyrG基因编码的酶转化为5-氟尿嘧啶核苷酸,该物质有很强的细胞毒性能够抑制野生型菌株的生长[18]。pyrG基因发生突变后可以使营养缺陷型菌株丧失合成OMPDC 的能力,不能代谢有毒的5-氟尿嘧啶核苷酸,从而获得5-FOA 抗性[19]。目前金针菇的全基因组测序已经完成,这为金针菇尿嘧啶营养缺陷型的分子鉴定和分子标记提供了基础[20]。
卢绪志等[21]通过紫外诱变成功获得了金针菇尿嘧啶营养缺陷型单核体菌株,该菌株在不含尿嘧啶的基本培养基中无法正常生长。本研究在此基础上运用杂交方法培育出尿嘧啶营养缺陷型的金针菇双核体菌株,旨在建立一种可以用于鉴别、标记菌种的方法,为金针菇菌种分子遗传学研究提供一定的理论依据。
1 材料与方法
1.1 材料
金针菇尿嘧啶营养缺陷型单核体菌株NG1-65、NG1-92 和NG1-95(交配型均为A1B1)由上海市农业科学院食用菌研究所遗传工程实验室获得并保存。野生型单核体菌株DG1-29(交配型为A2B2)由上海市农业科学院食用菌研究所遗传工程实验室从金针菇野生型双核体菌株G1 菌株分离得到,G1 由上海市农业科学院食用菌研究所菌种保藏中心提供。
1.2 方法
1.2.1 培养基制作和配方 1)马铃薯培养基(potato dextrose agar,PDA):PDA 粉末(美国BD 公司)39 g,加水至1 L,灭菌,倒平板,供菌丝活化与菌丝培养使用。
2)马铃薯葡萄糖液体培养基(potato dextrose broth,PDB):PDB 粉末(美国BD 公司)24 g,加水至1 L,灭菌后用来培养菌丝。
3)尿嘧啶马铃薯培养基(potato dextrose agar add uracil,PDAU):在PDA 培养基中添加0.05 mmol·L-1的尿嘧啶(美国SIGMA 公司)。
4)筛选培养基(potato dextrose agar add uracil and 5-FOA,PDAUF):在PDA 培养基中添加0.05 mmol·L-1的尿嘧啶及0.5 g·L-15′-氟-乳清酸[生工生物工程(上海)股份有限公司]。
5)基本培养基(minimal midium,MM):20 g 葡萄糖、1.0 g KH2PO4、1.5 g(NH4)2HPO4、0.3 g MgSO4·7H2O、500 μg Thiamine HCL、15 g 琼脂粉、加水至1 L,灭菌后倒平板备用。
6)尿嘧啶基本培养基(minimal medium add urail,MMU):在基本培养基中添加0.05 mmol·L-1尿嘧啶。
7)筛选培养基(minimal medium add uracil and 5-FOA,MMUF):在基本培养基中添加0.05 mmol·L-1尿嘧啶及0.5 g·L-15′-氟-乳清酸。
1.2.2 亲本的选择 将金针菇营养缺陷型菌株NG1-65、NG1-92、NG1-95 分别与金针菇单核体菌株DG1-29 进行杂交后得到3 株双核体菌株SGN1、SGN2、SGN3(交配型均为A1B1+A2B2)并进行出菇试验。
1.2.3 金针菇的单孢分离及单核菌丝群体的建立 双核体菌株SGN1、SGN2、SGN3 出菇后选择菇形完整、无病虫害的新鲜子实体于无菌环境下收集自然弹射的孢子。将收集到的孢子放入装有无菌水的EP 管中制备孢子悬液,血球计数板计数后再用无菌水稀释至104·mL-1个单孢子[22]。取100 μL 孢子液涂布到PDAUF 培养基上,于25℃生化培养箱内倒置培养,一般7 d 内可见到孢子萌发的菌丝体。将孢子萌发的菌丝体转接到PDAU 培养基上,培养5 d 后再挑边缘菌丝体于新的PDAU 培养基上,重复5 次后[23]置于显微镜(Zeiss Axio lab A1 正立显微镜,德国)上检查,挑出无锁状联合的菌丝体备用,淘汰有锁状联合的菌丝体。
1.2.4 尿嘧啶营养缺陷型单孢子的选择 将无锁状联合的菌丝体分别接种于MM、MMU、MMUF 培养基上。挑选出能在MMU 和MMUF 培养基上生长但在MM 上不生长的单孢子萌发的菌丝体,即为尿嘧啶营养缺陷型单孢萌发菌株。
1.2.5 金针菇尿嘧啶营养缺陷型单孢子的交配 将尿嘧啶营养缺陷型单孢萌发菌株配对在MMU 培养基上进行杂交。杂交菌丝融合后,挑出融合处菌丝进行镜检,有锁状联合的为尿嘧啶营养缺陷型双核体菌株。
1.2.6 金针菇尿嘧啶营养缺陷型纯合体菌株的5-FOA 验证 将金针菇尿嘧啶营养缺陷型双核体菌株继代5 次后,分别接种于MM、MMU、MMUF 培养基上,观察其生长情况。
1.2.7 尿嘧啶营养缺陷型双核体菌株基因组DNA 的提取与分子标记验证 采用CTAB 法[24]提取金针菇尿嘧啶营养缺陷型纯合体菌株基因组DNA。根据金针菇pyrG(GenBank:KY401432)基因设计分子标记引物(表1)。PCR 扩增体系为50 μL,包含:TaKaRa ExTaq(5 U·μL-1)0.5 μL,10×Ex Taq Buffer(Mg2+Plus)5 μL,dNTP Mixture(2.5 mmol·L-1)4 μL,模板DNA(100 ng·μL-1)1 μL,正反向引物各1 μL,双蒸水(ddH2O)37.5 μL。PCR反应程序:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸2 min,30~35 个循环;72℃延伸10 min;4℃保存备用。对PCR 产物进行切胶回收后,用限制性内切酶于37℃水浴酶切1 h,电泳检测酶切结果。
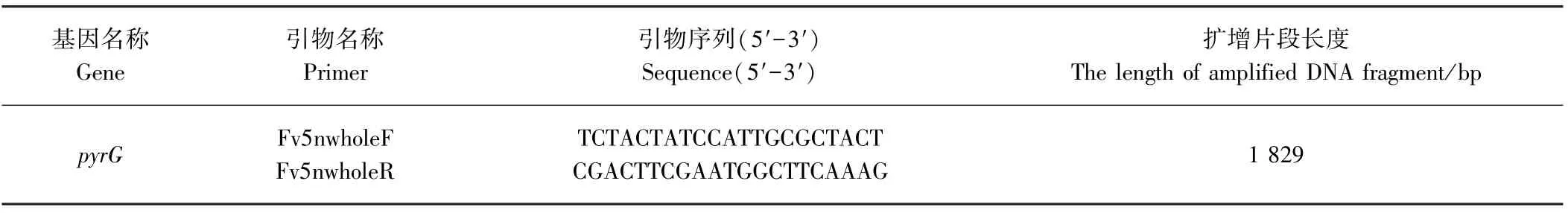
表1 pyrG基因的PCR 引物Table 1 The primers to amplify pyrG genes
1.2.8 金针菇尿嘧啶营养缺陷型双核体菌株的生长速率测定 PDA 平板上的生长速率:将金针菇尿嘧啶营养缺陷型双核体菌株接种于PDA 平板上,25℃培养。当菌丝开始萌发时,在菌丝的前端画线当作菌丝的生长起始线,3 d 后划第2 条线,测量距离,计算日均生长速率,设3 次生物学重复。
PDAU 平板上的生长速率:将金针菇尿嘧啶营养缺陷型双核体菌株接种于含有0.05 mmol·L-1尿嘧啶的PDA 平板上,并采用上述相同的培养方法和测量方法,测量生长速率。
1.3 数据统计与分析
采用SPSS 软件(IBM SPSS Statistics 19)对金针菇尿嘧啶营养缺陷型双核体菌株生长速率的数据进行分析和绘图。
2 结果与分析
2.1 金针菇的单孢分离及单核菌丝群体的建立
3 株杂交菌株SGN1、SGN2 和SGN3 均能够正常出菇,收集担孢子。将孢子稀释涂布于PDAUF 培养基上培养,获得325 个萌发菌落,其中SGN1 孢子再生菌株有111 株,SGN2 孢子再生菌株有110 株,SGN3 孢子再生菌株有104 株。在PDAU 培养基上经过5 次转接后置于显微镜下检查,获得无锁状联合的单核体菌株206 株,其中SGN1 孢子单核体菌株有59 株,SGN2孢子单核体菌株有68 株,SGN3 孢子单核体菌株有79株,平均单核体比例为63.4%。这些尿嘧啶营养缺陷型单核体菌株能在MMU 和MMUF 培养基上生长但在MM 培养基上不生长(图1)。
2.2 尿嘧啶营养缺陷型单孢子的交配
SGN1、SGN2 和SGN3 衍生的尿嘧啶营养缺陷型单孢菌株中各随机选取10 株分别进行两两配对。培养7 d 左右,挑出杂交融合处菌丝进行镜检,有锁状联合的判定为尿嘧啶营养缺陷型双核菌丝。最终从SGN1 亲本得到金针菇尿嘧啶营养缺陷型自交双核菌株12 个(命名为UG1-1 ~UG1-12),从SGN2 亲本获得杂交菌株12 个(命名为UG2-1~UG2-12),从SGN3亲本获得杂交菌株14 个(命名为UG3-1~UG3-14)。

图1 尿嘧啶营养缺陷型单核体菌株SGN3-2 与G1 在不同培养基上的生长情况Fig.1 The growth of the uracil auxotrophic monokaryon SGN3-2 of F.velutipes and F.velutipes stain G1 strains on different medium
2.3 金针菇尿嘧啶营养缺陷型纯合体的5-FOA 验证和分子鉴定
将杂交得到的38 株金针菇尿嘧啶营养缺陷型双核体菌株继代5 次后,分别接种于MM、MMU、MMUF培养基上,这些杂交菌株可以在MMU 和MMUF 培养基上生长但在MM 培养基上不生长(图2)。

图2 尿嘧啶营养缺陷型双核体菌株UG1-6 与G1在不同培养基上的生长情况Fig.2 The growth of the uracil auxotrophic dikaryons UG1-6 of F.velutipes and F.velutipes stain G1 on different medium
提取金针菇尿嘧啶营养缺陷型双核体菌株基因组DNA 进行pyrG基因的PCR 检测。金针菇野生型菌株的pyrG基因共有3 个XhoⅠ酶切位,尿嘧啶营养缺陷菌株NG1-92 的pyrG基因在236 位的碱基发生替换T→C,突变相应引起XhoⅠ酶切位点(C/TCGAG)的缺失,只保留了2 个XhoⅠ酶切位,根据这个变化,设计出一种快速鉴定金针菇尿嘧啶营养缺陷菌株的方法。提取尿嘧啶营养缺陷型双核体菌株基因组DNA 后对pyrG基因进行PCR 扩增,经过琼脂糖凝胶电泳并割胶回收,对回收产物进行XhoⅠ酶切,酶切后进行琼脂糖凝胶电泳检测,尿嘧啶营养缺陷型双核体菌株的pyrG基因扩增产物有3 条酶切条带(949、655、225 bp),野生型菌株有4 条酶切条带(949、655、177、48 bp)(图3)。
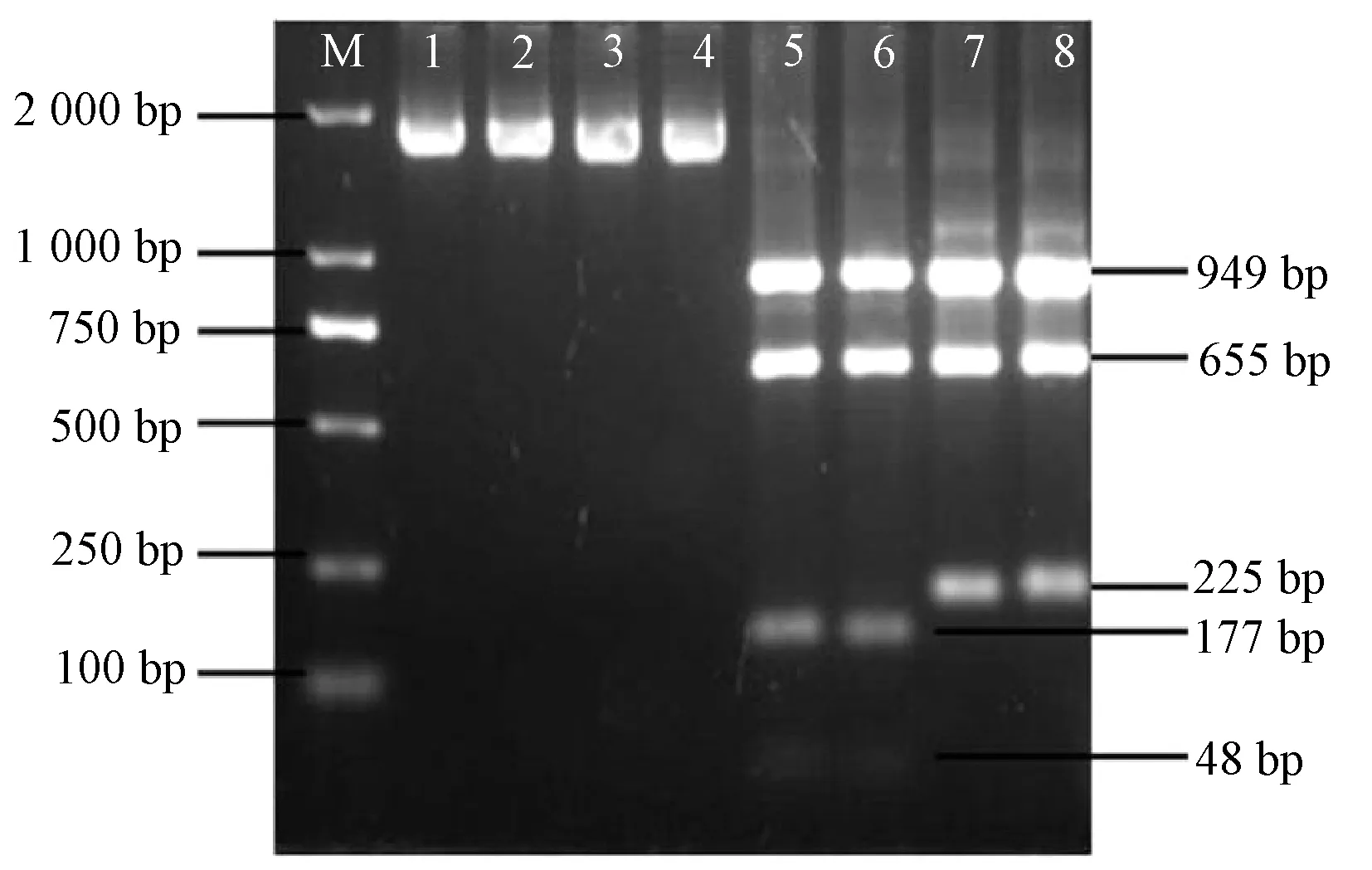
图3 金针菇尿嘧啶营养缺陷型双核体菌株的pyrG 基因扩增片段的XhoⅠ酶切结果Fig.3 Uracil auxotrophic dikaryotic strains of F.velutipes cut by XhoⅠ
2.4 金针菇尿嘧啶营养缺陷型菌株的生长速率测定
随机挑选15 株金针菇尿嘧啶营养缺陷型双核体菌株(UG1-1、UG1-2、UG1-6、UG1-7、UG1-10、UG2-1、UG2-2、UG2-5、UG2-7、UG2-9、UG3-1、UG3-3、UG3-5、UG3-8、UG3-9)接种于PDA 培养基和PDAU培养基,待菌丝萌发,3 d 后开始测量生长情况。由图4 可知,15 株金针菇尿嘧啶缺陷型菌株在PDA 培养基上的生长速率平均为5.19 mm·d-1,普遍低于野生型G1 14.09 mm·d-1。在添加了尿嘧啶的PDAU 培养基上金针菇尿嘧啶缺陷型菌株生长速率平均为11.68 mm·d-1,与PDA 培养基上的生长速率相比都有不同程度的提高,平均增加了125.15%。而野生型G1 在添加了尿嘧啶PDA 的培养基上生长速率为13.91 mm·d-1,与在PDA 培养基上没有太大变化,甚至还有所降低。表明尿嘧啶作为一种营养物质有助于提高金针菇尿嘧啶营养缺陷型菌株的生长速率。
3 讨论
营养缺陷型菌株可进行产物代谢途径分析,改变代谢通路积累目标产物,该类菌株已被广泛应用于工业微生物领域[25-26]。目前已有将营养缺陷型菌株运用于食用菌中的研究报道,如曹照平等[27]通过超声联合1%硫酸二乙酯复合诱变筛选出了高产虫草素的黄嘌呤和鸟嘌呤双重营养缺陷型蛹虫草菌株,为虫草素的规模化生产提供了技术支持。营养缺陷型菌株在育种学和遗传学领域也有重要作用[28]。如孙丹[29]利用CRISPR(clustered regularly interspaced short palindromic repeats)技术对蛹虫草中尿嘧啶合成的关键酶基因RUA3(在金针菇中为pyrG基因)进行编辑,使其成为一种新型的分子标记,为菌种优化奠定了基因工程基础。本试验所获得的尿嘧啶营养缺陷型双核体菌株中,反复继代多次后尿嘧啶营养缺陷型作为分子标记保持了良好的继代稳定性,可作为分子生物学研究的宿主菌株。
诱变育种可以大大缩短育种年限,但诱变使基因突变方向不可控,诱发有益突变基因的频率低,可能带有额外的不理想的表型。本研究中有些杂合子在MMU 培养基上生长的菌丝形态和生长速度不同于PDAU 培养基,说明除pyrG基因突变外,紫外诱变还引起了其他基因的改变。实际应用中需要扩大诱变后代群体来获得所需要的表型。
尿嘧啶营养缺陷型菌株是常见的营养缺陷型菌株,目前已经在卷枝毛霉[30-31]、米曲霉[32]、假丝酵母和鲁氏酵母[33]、香菇[34]等真菌中成功通过物理诱变、化学诱变或基因敲除技术获得。尿嘧啶广泛存在于生物中,在制备常用培养基所用的马铃薯、胰蛋白胨[35]、酵母提取物等成分中均含有痕量尿嘧啶,从而导致尿嘧啶缺陷型菌株的背景生长。为避免背景尿嘧啶的影响,筛选培养基选择了不含尿嘧啶的基本培养基。本研究通过单单自交得到38 株金针菇尿嘧啶营养缺陷型双核体菌株,这些菌株在不含尿嘧啶添加物的基本培养基中无法正常生长,在PDA 培养基上生长速率低于野生型菌株,在添加尿嘧啶的PDAU 培养基上可以不同程度地恢复正常生长,表明尿嘧啶营养缺陷型菌株通过表型的差异可有效区分。
尿嘧啶营养缺陷型双核体菌株在食用菌中的运用目前只在香菇中有相关报道,对香菇的尿嘧啶营养缺陷型双核体菌株进行栽培试验,均可以正常获得子实体[36]。表明营养缺陷型双核体菌株具有一定栽培价值和育种亲本价值,进一步增大杂交菌株筛选数量有望获得产量显著提高的尿嘧啶营养缺陷型双核体菌株。实际生产应用中,营养缺陷型菌种的出菇需要加入尿嘧啶,必定会增加生产成本,但是尿嘧啶缺陷型可以作为一种新型的分子标记追踪菌株,用于菌种鉴别。
4 结论
本研究通过单单自交获得了金针菇尿嘧啶营养缺陷型双核体菌株,且该金针菇尿嘧啶营养缺陷型作为分子标记可稳定遗传,这为利用尿嘧啶营养缺陷型菌株的表型和基因型进行菌种保护和鉴别提供了技术基础。下一步可利用尿嘧啶或者其他类型的营养缺陷型菌株的表型和基因型设计保护菌种和判别菌种的技术策略,建立一套利用营养缺陷型菌株开展金针菇杂交育种、菌种鉴别、知识产权保护的技术体系。
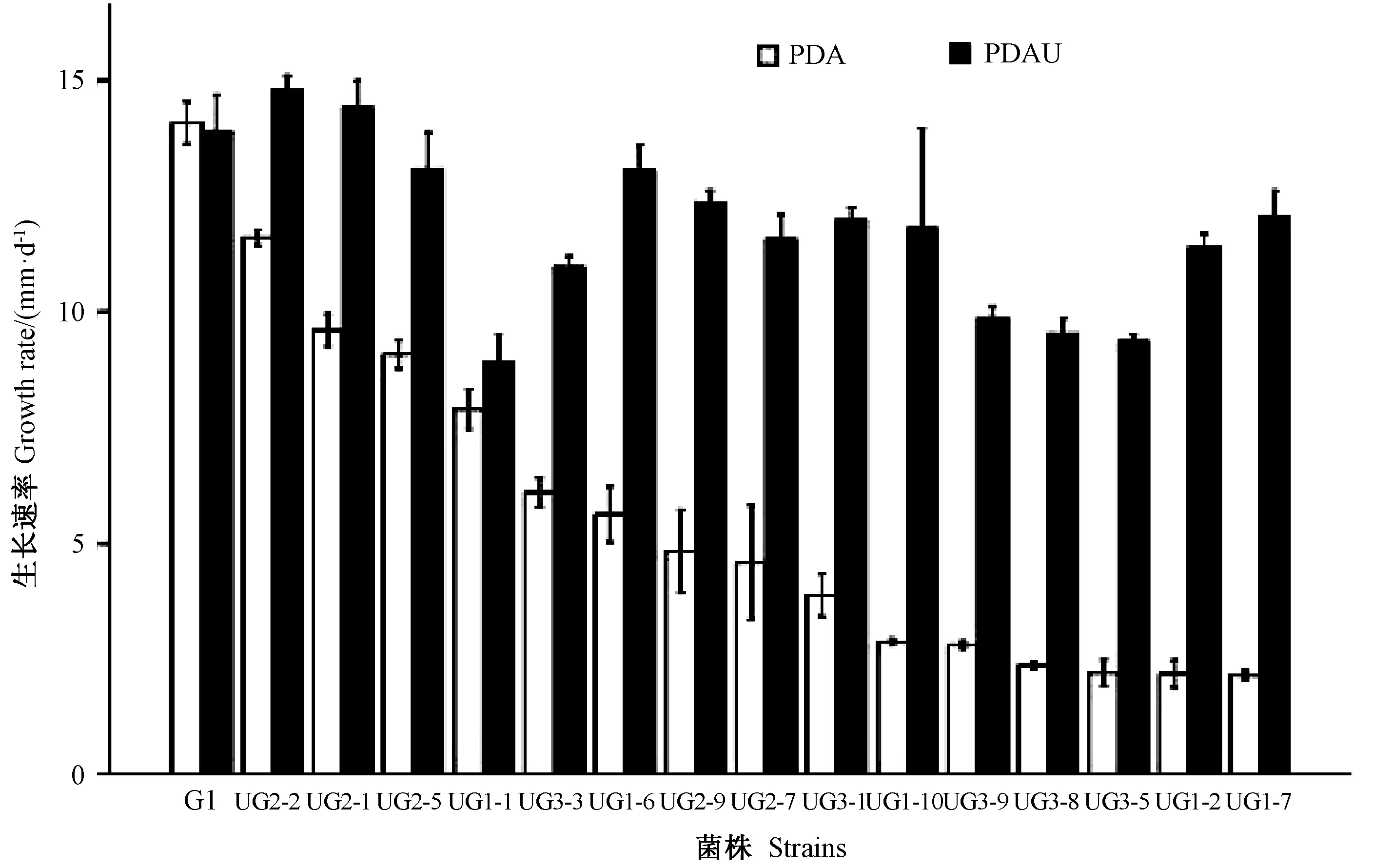
图4 金针菇尿嘧啶营养缺陷型双核体菌株在PDA 和PDAU 培养基上的生长速率Fig.4 Growth rate of uracil auxotrophic dikaryotic strains of F.velutipes on PDA and PDAU media
