大黄素甲醚氨基酸衍生物的合成及其杀菌活性
2020-03-09孟振国赵炽娜吴清来李俊凯
孟振国, 朱 祥, 赵炽娜, 常 悦, 吴清来, 李俊凯,2*
(1.长江大学 农学院,湖北 荆州 434025; 2.长江大学 农药研究所,湖北 荆州 434025)
目前,发展和创制绿色农药已成为国内外研究热点,是农业持续发展的一项基本保证。为此,人们在植物源天然产物中寻找有活性的新药或者先导化合物,并利用其开发出具有活性高、选择性强、安全低毒和环境友好型的农药新品种,这也是未来农药的发展趋势[1-4]。大黄素甲醚是从蓼科植物虎杖(PolygonumcuspidatumSieb. Et Zncc)等植物中提取出来的一类蒽醌化合物[5],是大黄重要的成分之一[6],属单蒽核类1,8-二羟基蒽醌衍生物。大黄素甲醚被广泛应用于医药领域,具有抗肿瘤、抗病毒和修复受损DNA等生理活性[7-9],近年也在农业领域开始有所运用。薛敏峰等[10]通过田间药效试验表明0.5%大黄素甲醚水剂对各类白粉病菌有明显优于其他同类药剂的防治效果;杨宇红等[11]采用温室盆栽法表明大黄素甲醚对植物病原菌黄瓜白粉病菌表现出显著的抑制活性。作为一种天然产物,大黄素甲醚的蒽醌结构通常具有较强的抑菌活性[12]。同时,氨基酸也是自然界常见的具有重要生理与结构功能的小分子化合物,常作为重要的化工原料被广泛应用到新农药研制中,含酰胺结构的化合物在除草、杀虫、杀菌上有一定的生物活性[13-15],因此,本研究借助溴乙酸乙酯作为桥链将大黄素甲醚与氨基酸类化合物耦合,引入酰胺基,设计合成系列结构新颖、简便易得的新型大黄素甲醚氨基酸衍生物,并对其抑菌活性进行了筛选,以期为合成抑菌活性更好的大黄素甲醚衍生物提供基础数据。
1 实 验
1.1 原料、试剂与仪器
大黄素甲醚、氯化亚砜(纯度98%)、二氯甲烷(DCM)、二甲基亚砜(DMSO)、 N,N-二甲基甲酰胺(DMF)、三乙胺(Et3N)、 1,4-二氧杂环己烷(二氧六环)、溴乙酸乙酯和各类氨基酸酯盐酸盐及其他试剂均为市售分析纯。
水稻纹枯病菌(RhizoctoniasolaniKuhn)、水稻稻瘟病菌(PyriculariaoryzaeCavara)、油菜菌核病菌(Sclerotiniasclerotiorum(Lib.)de Bary)、草莓灰霉病菌(BotrytiscinereaPersoon)、烟草赤星病菌(Alterariaalternate(Fr)Keissler)和香樟炭疽病菌(ColletotrichumgloeosporioidesPena.) ,由长江大学农学院病理实验室提供。
Varian- 400 型核磁共振仪,以CDCl3和DMSO-d6为溶剂,以 TMS为内标;Thermo Scientific Q ExactiveTM液相质谱联用仪,美国Thermo Fisher Scientific公司。
1.2 合成方法
1.2.1中间产物2a~4a的合成 参考文献[16]方法。称取4 g 大黄素甲醚、10 g 无水碳酸钾和800 mL N,N-二甲基甲酰胺(DMF)于1 000 mL的圆底烧瓶,搅拌5 min后,加入2.8 g 溴乙酸乙酯,室温下搅拌过夜,薄层层析(TLC),展开剂为V(乙酸乙酯) ∶V(石油醚)=1 ∶2的混合液,跟踪至反应基本结束,用稀盐酸调节pH值至2~3,抽滤,烘干得黄色粗产物。用硅胶柱层析纯化,洗脱剂为V(乙酸乙酯) ∶V(石油醚)=1 ∶3的混合液,得化合物2a,其为同分异构体(2a1和2a2),黄色固体4.0 g。
参考文献[17]方法,将4.0 g黄色固体2a用二氧六环溶解于250 mL圆底烧瓶,加入1.7 g LiOH·H2O的水溶液,常温搅拌5 h,用稀盐酸调节pH值至2~3,抽滤,烘干得黄色粗产物3a,其为同分异构体(3a1和3a2)。
参考文献[18]方法,称取2.0 g3a和60 mL二氯甲烷于500 mL的圆底烧瓶,加入三滴DMF和5.0 g 氯化亚砜,冷凝回流过夜,减压蒸出多余氯化亚砜,留下化合物4a1和4a2不经纯化用50 mL二氯甲烷溶解,直接用于后续反应。
1.2.2化合物(5a~5i)的合成通法 以5a合成为例。参考文献[18]方法,称取0.71 g甘氨酸乙酯盐酸盐和2.1 g三乙胺缚酸剂(物质的量比1 ∶5)用50 mL二氯甲烷溶解于100 mL圆底烧瓶,室温搅拌10 min,将游离出的甘氨酸乙酯加入到1.2.2节的圆底烧瓶中,室温反应5 h,薄层层析,展开剂为V(乙酸乙酯) ∶V(二氯甲烷)=1 ∶8 的混合液,跟踪至反应基本结束,用硅胶柱层析,洗脱剂为V(乙酸乙酯) ∶V(二氯甲烷)=1 ∶8的混合液,纯化得黄色固体。
1.2.3化合物(6a~6h)的合成通法 参考文献[17]方法。将1.0 g5a异构体(5a1和5a2)的黄色固体用二氧六环溶解,按物质的量比1 ∶5加入0.5 g LiOH·H2O的水溶液,常温搅拌5 h,用稀盐酸调节pH值至2~3,抽滤,烘干得黄色产物6a。同样方法分别合成6b~6h,具体合成路线见图1。

图1 大黄素甲醚氨基酸衍生物的合成路线
1.3 结构表征
以 CDCl3和DMSO-d6为溶剂,用核磁共振仪进行1H NMR(400 MHz) 分析; 用高分辨质谱仪进行HRMS (M+),m/z分析。
1.4 杀菌活性测定
以大黄素甲醚为阳性对照,二甲基亚砜(DMSO)为空白对照,采用菌丝生长速率法[19],在产物浓度为0.2 mmoL/L的条件下测杀菌活性。于(24±1) ℃ 的培养箱内培养,每个处理采用十字交叉法测量其菌丝扩展直径,按式(1)计算抑制率。采用DPS7.05进行差异显著性分析。
相对抑制率=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100%
(1)
2 结果与讨论
2.1 目标化合物的结构表征
本研究合成一系列的异构体化合物(5a~6h),选择部分化合物5a、5b、6a、6c和6e进行表征(其余化合物的表征数据见辅助材料)。
化合物5a1:1-大黄素甲醚氧乙酰基甘氨酸乙酯,分子式C22H21NO8,黄色粉末。1H NMR(400 MHz, CDCl3)δ:8.92 (d,J=16.8 Hz, 1H, NH ), 7.60 (d,J=1.6 Hz, 1H, H-7), 7.50 (d, 1H, H-5), 7.10 (d,J=1.6 Hz, 1H, H-4), 6.66 (d,J=2.4 Hz, 1H, H-2), 4.67 (d,J=11.6 Hz, 2H, H-17), 4.30 (q,J=7.2 Hz, 2H, H-19), 4.24 (d,J=5.6 Hz, 2H, H-21), 4.00 (s, 2H, H-15), 3.94 (s, 1H, H-15), 2.52 (s, 1H, H-16), 2.45 (s, 2H, H-16), 1.33 (t,J=7.2 Hz, 3H, H-22);HRMS (M+),m/z:428.133 3。
化合物5a2:8-大黄素甲醚氧乙酰基甘氨酸乙酯,分子式C22H21NO8,黄色粉末。1H NMR(400 MHz, CDCl3)δ:8.92 (d,J=16.8 Hz, 1H, NH ), 7.80 (d,J=1.6 Hz, 1H, H-7), 7.33 (d,J=1.6 Hz, 1H, H-5), 7.00 (d,J=2.4 Hz, 1H, H- 4), 6.72 (d,J=2.4 Hz, 1H, H-2), 4.67 (d,J=11.6 Hz, 2H, H-17), 4.30 (q,J=7.2 Hz, 2H, H-19), 4.24 (d,J=5.6 Hz, 2H, H-21), 4.00 (s, 2H, H-15), 3.94 (s, 1H, H-15), 2.52 (s, 1H, H-16), 2.45 (s, 2H, H-16), 1.33 (t,J=7.2 Hz, 3H, H-22);HRMS (M+),m/z:428.133 3。
化合物5b1:1-大黄素甲醚氧乙酰基丙氨酸乙酯,分子式C20H17NO8,黄色粉末。1H NMR(400 MHz, CDCl3)δ:8.95 (dd,J=16.8, 7.3 Hz, 1H, NH), 7.61 (d,J=1.6 Hz, 1H, H-7), 7.50 (d,J=2.4 Hz, 1H, H-5), 7.11 (dd,J=1.6, 0.8 Hz, 1H, H- 4), 6.66 (d,J=2.4 Hz, 1H, H-2), 4.71 (q,J=7.2 Hz, 1H, H-19), 4.64 (d,J=11.6 Hz, 2H, H-17), 4.27 (q,J=7.2 Hz, 2H, H-21), 4.00 (s, 2H, H-15), 3.94 (s, 1H, H-15), 2.52 (s, 1H, H-16), 2.45 (s, 2H, H-16), 1.59 (d,J=7.2 Hz, 3H, H-24), 1.31 (t,J=7.2 Hz, 3H, H-22);HRMS (M+),m/z:442.148 5。
化合物5b2:8-大黄素甲醚氧乙酰基丙氨酸乙酯,分子式C20H17NO8,黄色粉末。1H NMR(400 MHz, CDCl3)δ:8.95 (dd,J=16.8, 7.3 Hz, 1H, NH), 7.81 (d,J=1.6 Hz, 1H, H-7), 7.33 (d,J=2.4 Hz, 1H, H-5), 7.01 (dd,J=1.6, 0.9 Hz, 1H, H- 4), 6.72 (d,J=2.4 Hz, 1H, H-2), 4.71 (q,J=7.2 Hz, 1H, H-19), 4.64 (d,J=11.6 Hz, 2H, H-17), 4.27 (q,J=7.2 Hz, 2H, H-21), 4.00 (s, 2H, H-15), 3.94 (s, 1H, H-15), 2.52 (s, 1H, H-16), 2.45 (s, 2H, H-16), 1.59 (d,J=7.2 Hz, 3H, H-24), 1.31 (t,J=7.2 Hz, 3H, H-22);HRMS (M+),m/z:442.148 5。
化合物6a1:1-大黄素甲醚氧乙酰基甘氨酸,分子式C29H27NO9,黄色粉末。1H NMR(400 MHz, DMSO-d6)δ:12.97 (s, 1H, H-8), 12.84 (s, 1H, H-20), 8.56 (t,J=5.6 Hz, 1H, NH), 7.48 (d,J=1.6 Hz, 1H, H-7), 7.31 (d,J=2.4 Hz, 1H, H-5), 7.18 (d,J=1.6 Hz, 1H, H- 4), 7.03 (d,J=2.4 Hz, 1H, H-2), 4.80 (d,J=16.4 Hz, 2H, H-17), 4.04 (dd,J=5.6, 2.8 Hz, 2H, H-19), 3.98 (s, 3H, H-15), 2.42 (s, 3H, H-16);HRMS (M+),m/z:400.102 0。
化合物6a2:8-大黄素甲醚氧乙酰基甘氨酸,分子式C29H27NO9,黄色粉末。1H NMR(400 MHz, DMSO-d6)δ:13.17 (s, 1H,H-8), 12.84 (s, 1H, H-20), 8.56 (t,J=5.5 Hz, 1H, NH), 7.66 (d,J=1.6 Hz, 1H, H-7), 7.42 (d,J=2.4 Hz, 1H, H-5), 7.15 (d,J=1.5 Hz, 1H, H- 4), 6.85 (d,J=2.5 Hz, 1H, H-2), 4.76 (d,J=16.4 Hz, 2H, H-17), 4.04 (dd,J=5.6, 2.8 Hz, 2H, H-19), 3.92 (s, 3H, H-15), 2.47 (s, 3H, H-16);HRMS (M+),m/z:400.102 0。
化合物6b1:1-大黄素甲醚氧乙酰基丙氨酸,分子式C24H25NO8S,黄色粉末。1H NMR(400 MHz, DMSO-d6)δ:13.02 (s, 1H, H-8), 12.93 (s, 1H, H-20), 8.64 (d,J=7.2 Hz, 1H, NH), 7.44 (d,J=1.6 Hz, 1H, H-7), 7.26 (d,J=2.4 Hz, 1H, H-5), 7.14 (d,J=1.2 Hz, 1H, H- 4), 6.98 (d,J=2.4 Hz, 1H, H-2), 4.72 (dd,J=15.2, 2.8 Hz, 2H,H-17), 4.38 (p,J=7.2 Hz, 1H, H-19), 3.93 (d,J=20.4 Hz, 3H, H-15), 2.42 (d,J=17.6 Hz, 3H, H-16), 1.44 (dd,J=7.2, 1.6 Hz, 3H, H-21);HRMS (M+),m/z:414.117 6。
化合物6b2:8-大黄素甲醚氧乙酰基丙氨酸,分子式C24H25NO8S,黄色粉末。1H NMR(400 MHz, DMSO-d6)δ:13.22 (s, 1H, H-8), 12.93 (s, 1H, H-20), 8.64 (d,J=7.0 Hz, 1H, NH), 7.60 (d,J=1.6 Hz, 1H, H-7), 7.76 (d,J=2.4 Hz, 1H, H-5), 7.09 (d,J=1.2 Hz, 1H, H- 4), 6.80 (d,J=2.4 Hz, 1H, H-2), 4.72 (dd,J=15.2, 2.8 Hz, 2H,H-17), 4.38 (p,J=7.2 Hz, 1H, H-19), 3.93 (d,J=20.4 Hz, 3H, H-15), 2.42 (d,J=17.6 Hz, 3H, H-16), 1.44 (dd,J=7.2, 1.6 Hz, 3H, H-21);HRMS (M+),m/z:414.117 6。
化合物6c1:1-大黄素甲醚氧乙酰基苯丙氨酸,分子式C23H23NO8S,黄色粉末。1H NMR(400 MHz, DMSO-d6)δ:13.07 (s, 1H, H-20), 12.92 (s, 1H, H-8), 8.61 (d,J=8.0 Hz, 1H, NH), 7.51 (d,J=1.6 Hz, 1H, H-7), 7.34 (d,J=2.4 Hz, 1H, H-5), 7.22~7.19 (m, 4H, H-23, H-24, H-26, H-27), 7.17 (d,J=2.8 Hz, 1H, H-25), 7.15~7.10 (m, 1H, H- 4), 7.03 (d,J=2.4 Hz, 1H, H-2), 4.80 (s, 1H, H-17), 4.78~4.74 (m, 1H, H-17), 4.68 (q,J=7.6 Hz, 1H, H-19), 3.95 (d,J=18.4 Hz, 3H, H-15), 3.19~3.16 (m, 1H, H-21), 3.06 (dd,J=13.6, 7.6 Hz, 1H, H-21), 2.45 (d,J=14.8 Hz, 3H, H-16);HRMS (M+),m/z:490.149 8。
化合物6c2:8-大黄素甲醚氧乙酰基苯丙氨酸,分子式C23H23NO8S,黄色粉末。1H NMR(400 MHz, DMSO-d6)δ:13.12 (s, 1H, H-8), 13.07 (s, 1H, H-20), 8.61 (d,J=8.0 Hz, 1H, NH), 7.69 (d,J=1.6 Hz, 1H, H-7), 7.17 (d,J=2.6 Hz, 1H, H-5), 7.22~7.19 (m, 4H, H-23, H-24, H-26, H-27), 7.17 (d,J=2.8 Hz, 1H, H-25), 7.15~7.10 (m, 1H, H- 4),6.87 (d,J=2.4 Hz, 1H, H-2), 4.80 (s, 1H, H-17), 4.78~4.74 (m, 1H, H-17), 4.68 (q,J=7.6 Hz, 1H, H-19), 3.95 (d,J=18.4 Hz, 3H, H-15), 3.19~3.16 (m, 1H, H-21), 3.06 (dd,J=13.6, 7.6 Hz, 1H, H-21), 2.45 (d,J=14.8 Hz, 3H, H-16);HRMS (M+),m/z:490.149 8。
化合物6e1:1-大黄素甲醚氧乙酰基亮氨酸,分子式C24H25NO8,黄色粉末。1H NMR(400 MHz, DMSO-d6)δ:12.93 (s, 1H, H-8), 12.87 (s, 1H, H-20), 8.46 (dd,J=7.6, 2.0 Hz, 1H, NH), 7.36 (d,J=1.6 Hz, 1H, H-7), 7.17 (d,J=2.4 Hz, 1H, H-5), 7.09 (d,J=1.6 Hz, 1H, H- 4), 6.90 (d,J=2.4 Hz, 1H, H-2), 4.68 (dq,J=17.2, 14.4 Hz, 2H, H-17), 4.37 (td,J=8.0, 5.6 Hz, 1H, H-19), 3.93 (s, 2H, H-15), 3.88 (s, 1H, H-15), 2.38 (d,J=16.4 Hz, 3H, H-16), 1.81 (tt,J=11.6, 5.6 Hz, 1H, H-22), 1.72 (t,J=7.6 Hz, 2H, H-21), 0.96 (dd,J=18.4, 6.4 Hz, 6H, H-23, H-24);HRMS (M+),m/z:456.164 4。
化合物6e2:8-大黄素甲醚氧乙酰基亮氨酸,分子式C24H25NO8,黄色粉末。1H NMR(400 MHz, DMSO-d6)δ:13.14 (s, 1H, H-8), 12.87 (s, 1H, H-20), 8.46 (dd,J=7.6, 2.0 Hz, 1H, NH), 7.51 (d,J=1.6 Hz, 1H, H-7), 7.29 (d,J=2.4 Hz, 1H, H-5), 7.00 (d,J=1.6 Hz, 1H, H- 4), 6.75 (d,J=2.4 Hz, 1H, H-2), 4.68 (dq,J=17.2, 14.4 Hz, 2H, H-17), 4.37 (td,J=8.0, 5.6 Hz, 1H, H-19), 3.93 (s, 2H, H-15), 3.88 (s, 1H, H-15), 2.38 (d,J=16.4 Hz, 3H, H-16), 1.81 (tt,J=11.6, 5.6 Hz, 1H, H-22), 1.72 (t,J=7.6 Hz, 2H, H-21), 0.96 (dd,J=18.4, 6.4 Hz, 6H, H-23, H-24);HRMS (M+),m/z:456.164 4。
在合成目标化合物(5a~5i)和(6a~6h)时,通过核磁氢谱和高分辨基本确定为两种同分异构中的位置异构体(见图1),大黄素甲醚上1,8号位上的羟基位置都可以发生成醚反应,故所合成的尚未报道的新化合物都是异构体。从目标产物的1H NMR表征数据中可知,蒽醌上羟基的氢主要出现在δ13.00~13.40,酰胺基团上的氢主要出现在δ8.50~8.90,蒽醌上的氢主要出现在化学位移δ6.63~7.90,蒽醌上甲氧基上的氢主要出现在δ3.80~4.10,蒽醌上甲基上的氢主要出现在δ2.40~2.55,且因为是异构体故存在积分不够1的峰。
2.2 抑菌活性
在0.2 mmoL/L的浓度下,化合物的杀菌活性测定结果见表1。由表1可知:大多数目标化合物对6种供试病原菌的抑菌活性均比对照药剂效果好,其中化合物6e对水稻纹枯病菌和香樟炭疽病菌表现出中等偏上的活性,显著高于其他19个异构体的生物活性,且对水稻稻瘟病菌、油菜菌核病菌和烟草赤星病菌都有一定的抑菌活性,但对于草莓灰霉病菌无明显抑菌效果,本研究中并未发现有很高抑菌活性的化合物。初步构效关系表明:该系列目标化合物的杀菌活性较先导化合物有所提高,氨基酸结构的引入增加了目标化合物的杀菌活性[20]。大多数水解后化合物比其水解前氨基酸酯的杀菌效果更好,其中效果最好的是6e,但水解后含有2个羧酸的化合物杀菌效果一般。6b、6d、6e和6g的活性差异表明此类衍生物的抑菌活性与R1碳链长度和结构有很大相关性,长度为4个碳原子的异丁基时活性最佳。
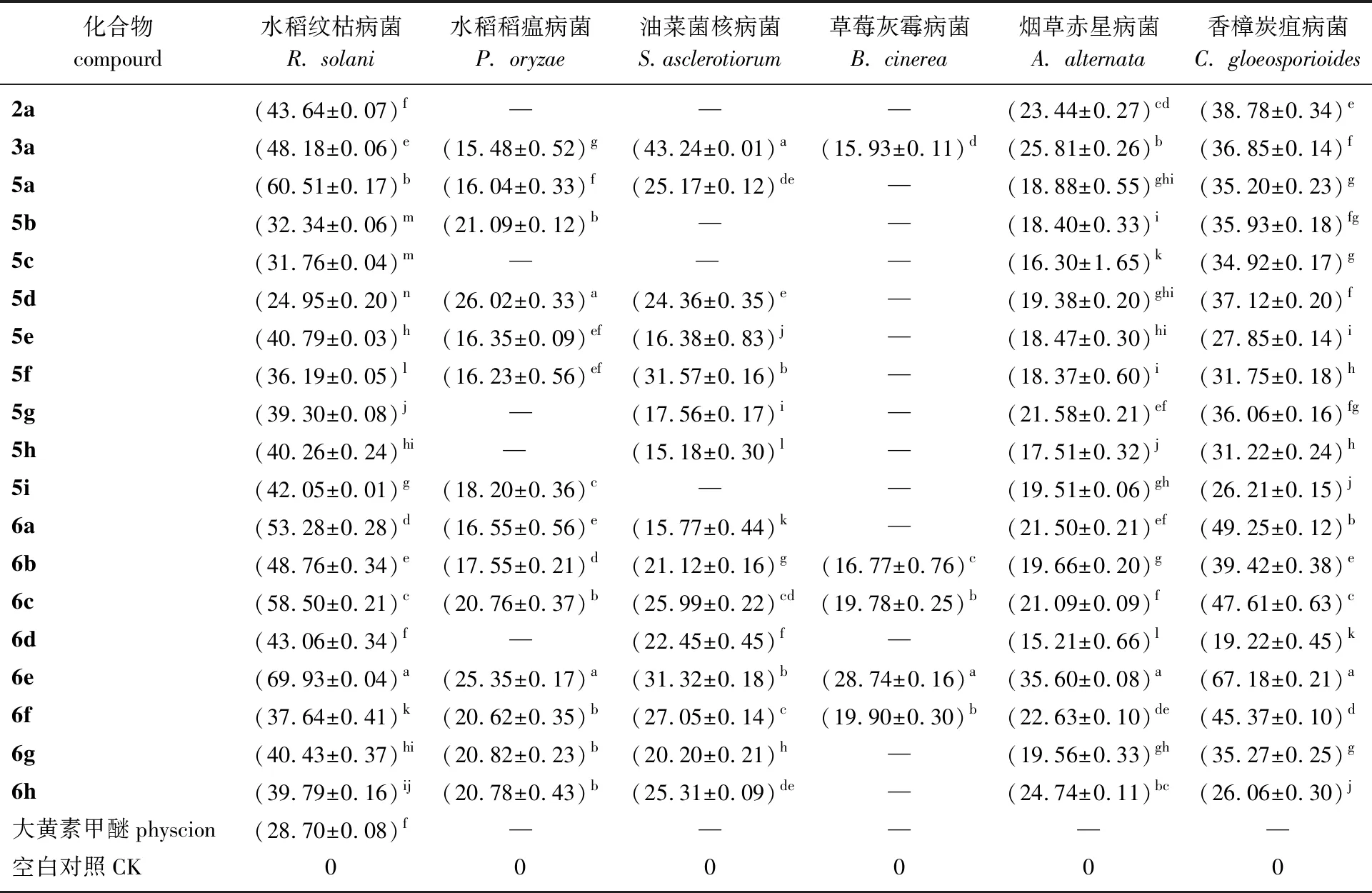
表1 化合物在0.2 mmoL/L下的杀菌活性1)
1) —:表示活性均在10%以下poor activity is below 10%; 同列不同小写字母表示不同产物在0.05水平存在显著差异(p<0.05) different lowercase letters in the same column indicate that different products have significant differences at 0.05 level (p<0.05)
3 结 论
以溴乙酸乙酯为桥链,大黄素甲醚作为先导化合物,将氨基酸结构引入到大黄素甲醚中得到系列的大黄素甲醚酰胺类化合物,所得大部分目标化合物在浓度0.2 mmoL/L下均表现出比先导化合物大黄素甲醚更好的抑菌活性,但并没有发现抑菌活性高的化合物。本研究通过初步构效关系分析,为大黄素甲醚的结构改造与修饰方向打下了一定的基础。
辅助材料(Supporting Information)5c~5h、6b、6d、6f~6h的表征数据。这些材料可免费从《林产化学与工业》网站(http:∥www.cifp.ac.cn)下载。
