不同培养条件对六妹羊肚菌菌丝形态的影响*
2020-03-08王万坤杨彝华
郑 旋,康 超,杨 玲,向 准,王万坤,王 芳,杨彝华
(贵州省生物研究所,贵州 贵阳 550009)
羊肚菌(Morchella spp.)属子囊菌门(Ascomycota) 盘菌纲 (Pezizomycetes) 盘菌目 (Pezizales)羊肚菌科 (Morchellaceae) 羊肚菌属 (Morchella)[1],又名羊肚菜、羊肚蘑等,因其菌盖表面凹凸不平,形似羊肚而得名,是一种珍贵的食(药)用菌。羊肚菌具有化痰理气,益肠胃[2],抗氧化、抗肿瘤及保肝保肾等功效,兼具食用价值和药用价值[3],市场价格高,但深受人们喜食。羊肚菌是羊肚菌属所有种类的统称,并非单一物种,常见品种有黑脉羊肚菌(M.angusticeps)、粗柄羊肚菌 (M.crassipes)、美味羊肚菌(M.esculenta)、梯棱羊肚菌(M.importuna)、六妹羊肚菌(M.sextelata) 等[4]。目前国内羊肚菌栽培品种主要为梯棱羊肚菌(M.importuna)、六妹羊肚菌(M.sextelata) 和七妹羊肚菌(M.septimelata)[4-5],栽培方式主要采用固体菌种大田栽培、林下栽培2种模式[6]。固体种在栽培过程中存在成本高、劳动强度大、栽培周期长、污染率高等问题[7],无法满足羊肚菌规模化栽培需求。而采用液体菌种栽培,具有发菌时间短、生长速度快、萌发点多、污染率低、成本低廉等优势[8-9]。目前,金针菇、杏鲍菇等食用菌已经开展了液体菌种工厂化栽培[10-11],而羊肚菌的液体菌种生产还处于探索阶段。研究羊肚菌液体菌种生产技术,对羊肚菌的产业化发展具有重要意义。近几年,羊肚菌液体培养研究主要集中在碳源、氮源,温度、pH、接种量等因素对菌丝生物量[12-16]及对胞外多糖产量的影响[9]。因此,通过考察不同培养条件对羊肚菌菌丝生长形态的影响,可为羊肚菌液体培养条件优化和菌种制备提供一定依据。
1 材料与方法
1.1 菌种
试验采用国内栽培面积较大的六妹羊肚菌(M.sextelata),GZCC 0016菌株分离自贵州省铜仁市石阡县采集的鲜标本,保存于贵州省生物研究所。
1.2 试剂
葡萄糖、KH2PO4、MgSO4·7H2O、NaNO3、FeSO4、腐殖酸酸钠均为分析纯,酵母粉、蛋白胨、酵母膏均为生化试剂,马铃薯、黄豆粉、腐殖土等为市购。
1.3 仪器
LDZX-75KBS立式压力蒸汽灭菌器,上海申安医疗器械厂;SW-CJ-2D超净工作台,苏州净化设备有限公司;MGC-300H人工气候箱、DHP-9082恒温培养箱,上海一恒科学仪器有限公司;ZWY-1102恒温培养振荡器,上海智诚分析仪器制造有限公司;TGL-16台式离心机,四川蜀科仪器有限公司;GZX-9140MBE鼓风干燥箱,上海博讯实业有限公司。
1.4 培养基
PDA培养基(PDA):马铃薯200 g、葡萄糖20 g、琼脂20 g,自来水1 000 mL,pH自然;PDA加富培养基(PDAP):马铃薯200 g、葡萄糖20 g、琼脂20 g,KH2PO41.5 g、MgSO4·7H2O 1.0 g,水 1 000 mL,pH自然;黄豆粉加富培养基(PHD):黄豆粉5 g~10 g、葡萄糖20 g、蛋白胨1 g,酵母粉0.5 g,水1 000 mL,pH自然;普通标准培养基(PT):葡萄糖10 g、酵母膏2 g、琼脂 20 g,KH2PO40.5 g,水1 000 mL,pH自然;葡萄糖硝酸钠培养基(NA):葡萄糖 30 g、琼脂 20 g,NaNO31.5 g、MgSO4·7H2O 0.5 g、KH2PO41.0 g,FeSO40.01 g,水 1 000 mL,pH自然;土汁培养基(PTZ):马铃薯200 g、腐殖土 100 g、葡萄糖 20 g、琼脂 20 g,水 1 000 mL,pH自然;腐殖酸盐培养基(PFZ):马铃薯200 g、葡萄糖20 g、琼脂20 g,腐殖酸酸钠0.5 g,水1 000 mL,pH自然;液体种基础培养基(PD):马铃薯200 g、葡萄糖20 g,自来水1 000 mL,pH自然。
以上培养基均121℃灭菌30 min,备用。
1.5 试验方法
1.5.1 菌种活化
将保存的六妹羊肚菌GZCC 000016菌株接种到PDA平板(直径9 cm),活化5 d~7 d,备用。
1.5.2 不同固体培养基中羊肚菌菌丝的变化
分别将1.4中的培养基制作成平板(直径9 cm)培养基,挑取活化的六妹羊肚菌菌块(0.3 cm2)1块接种于培养基中央,重复3次,25℃恒温黑暗培养32 d,测定培养期内菌丝疏密度、长势、颜色、生长速率等指标。
1.5.3 液体种培养条件单因素试验
1) 添加玻璃珠试验
配置液体种基础培养基(PD),500 mL培养瓶装液100 mL,分别添加10颗、20颗、30颗、50颗、100颗、150颗、200颗玻璃珠,重复3次,121℃灭菌30 min。冷却至室温后,接种3块0.5 cm2活化后的六妹羊肚菌菌块,置于恒温振荡器上,150 r·min-1、25℃恒温黑暗培养5d,以不加玻璃珠为对照试验。测定液体培养液中菌丝球数量、大小、菌丝生物量、菌液颜色等。
2)增稠剂筛选试验
根据前期预试验结果,按质量、体积浓度分别在PD培养基中添加0.1%、0.3%、0.5%、0.7%、0.9%海藻酸钠 (SA),及 0.1%、0.3%、0.5%、0.7%、0.9%、1.1%、1.3%、1.5%羧甲基纤维素钠(CMC-Na),共13种处理,每个处理3次重复,500 mL玻璃三角瓶装液100 mL,121℃灭菌30 min。冷却至室温后,接种3块0.5 cm2活化的六妹羊肚菌菌块,置于恒温振荡器上,150 r·min-1、25℃恒温黑暗培养5 d,以不加粘稠剂为对照试验。测定液体培养液中菌丝球数量、大小、菌丝生物量、菌液颜色等。
3) 静置培养试验
在添加增稠剂试验的基础上,配置PD+增稠剂培养基,500 mL玻璃三角瓶装液100 mL,121℃灭菌30 min。冷却至室温后,接种3块0.5 cm2活化的六妹羊肚菌菌块,在25℃恒温黑暗条件下,先分别静置培养0、1 d、2 d、3 d、4 d、5 d,后置于恒温振荡器上,150 r·min-1分别培养5 d、4 d、3 d、2 d、1 d、0,以不添加增稠剂为对照试验。测定液体培养液中菌丝球数量、大小、菌丝生物量、菌液颜色等。
4)装液体积筛选试验
在前期试验基础上,分别在500 mL玻璃三角瓶中添加50 mL、100 mL、150 mL、200 mL、250 mL、300 mL、350 mL、400 mL的液体培养基,121℃灭菌30 min。冷却至室温后,接种3块0.5 cm2活化的六妹羊肚菌菌块,置于恒温振荡器上,150 r·min-1、25℃恒温黑暗培养5 d,测定液体培养液中菌丝球数量、大小、菌丝生物量、菌液颜色等。
1.5.4 培养条件正交试验
通过单因素试验方法对静置天数,培养基粘度,装液体积3个因素进行筛选,以最优结果进行正交试验设计,因素与水平表见表1。

表1 L9(34)正交试验设计因素及水平表Tab.1 Orthogonal experiment factors and levels of L9(34)
1.5.5 菌丝球计数
培养完成后,分别取1 mL不同处理的培养液,加蒸馏水稀释至10 mL并摇匀,取1 mL稀释液倒入底面有方格的平板中,置于黑色背景下,记录菌丝球数量[16]。
1.5.6 菌丝生物量测定
培养完成后,过滤三角瓶内的培养液,收集过滤后的菌丝体置于垫有聚丙烯薄膜的玻璃平板内,并在55℃烘箱中烘干至恒重,记录羊肚菌菌丝体生物量。
1.5.7 数据统计
2 结果与分析
2.1 不同培养基对羊肚菌菌丝形态影响
考察不同培养基中羊肚菌菌丝的生长状态,结果见图1、表2。

表2 不同培养基对羊肚菌菌丝生长的影响Tab.2 Effects of different mycelium on the growth of Morchella sextelata
由图1可知,随着培养时间的增加,菌落颜色逐渐变深,产生由“白色→灰白→黄色→棕色”的变化。PHD、PTZ、PFZ培养基中菌丝量大,菌丝较细,致密,气生菌丝多,贴壁生长,菌丝呈帚状分支;NA、PT培养基中菌丝量较少,菌丝较粗、稀、气生菌丝少,绒毛状;在PDA、PDAP培养基中生长适中。表明各培养基均适合羊肚菌生长,且生长速率快,后续试验则以PDA培养基为活化培养基。不同培养基对六妹羊肚菌菌丝生长的影响见表2。
由表2可知,随着培养天数的增加,菌落直径逐渐增加。PHD、PTZ、NA、PFZ、PT培养基中菌丝生长最快,到第3天则铺满整个平板,PDA、PDAP培养基中生长较慢;第4天铺满平板。其中NA培养基中菌丝萌发最快,在接种后的4 h~6 h时后即开始萌发,PT培养基菌丝萌发最慢。通过对前5 d菌丝日平均生长速率的统计,不同培养基中羊肚菌菌丝生长速率表现不同。第1天时,NA培养基中菌丝生长速率最快,随后趋于平缓,于第3天后下降;PT培养基中日平均生长速率最慢,随培养时间的增加,第3天时生长速率最快,随后下降。
2.2 玻璃珠对羊肚菌菌丝的影响
考察液体培养基中添加不同数量玻璃珠对羊肚菌菌丝形态的影响,结果见表3。
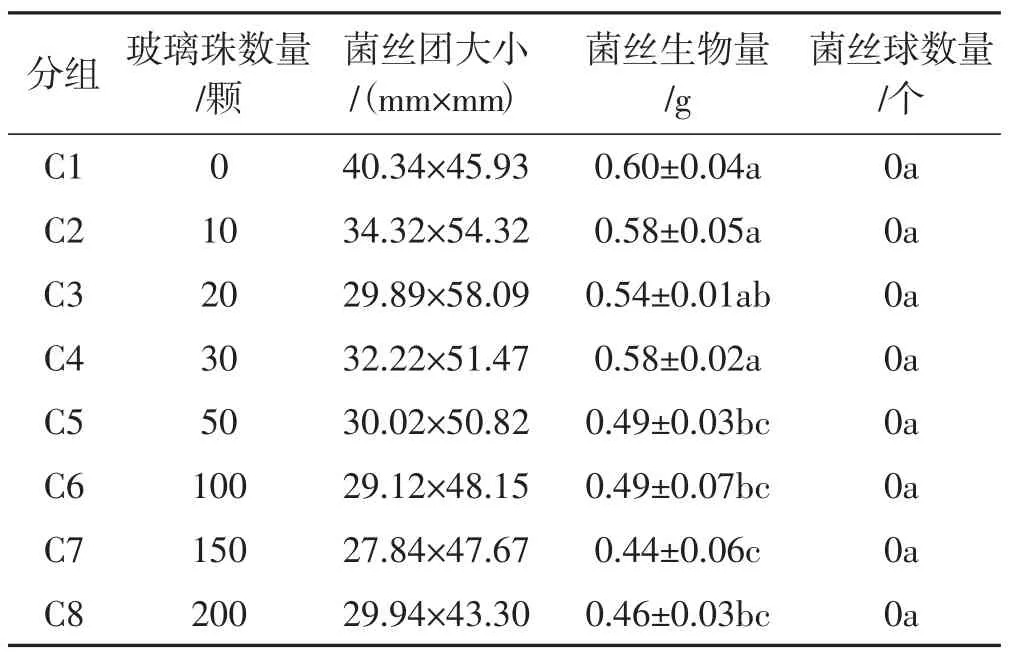
表3 玻璃珠数量对羊肚菌菌丝形态的影响Tab.3 Effects of glass beads on the mycelium morphology of Morchella sextelata
从表3可以看出,无论是否添加玻璃珠,羊肚菌菌丝均仅形成一个团块状菌丝(菌丝团),而无菌丝球的形成。且随着玻璃珠数量的增加,菌丝团大小和菌丝生物量逐渐减小,但菌丝团大小变化不明显,而菌丝生物量减少具有显著性差异。表明培养基中添加玻璃珠,并不能形成菌丝球,且对菌丝生长和菌丝生物量积累有一定抑制作用。
2.3 增稠剂对羊肚菌菌丝的影响
考察液体培养基中添加不同增稠剂对羊肚菌菌丝形态的影响结果见表4,增稠剂对羊肚菌菌丝生物量的影响见图2,增稠剂对羊肚菌菌丝浓度的影响见图3。
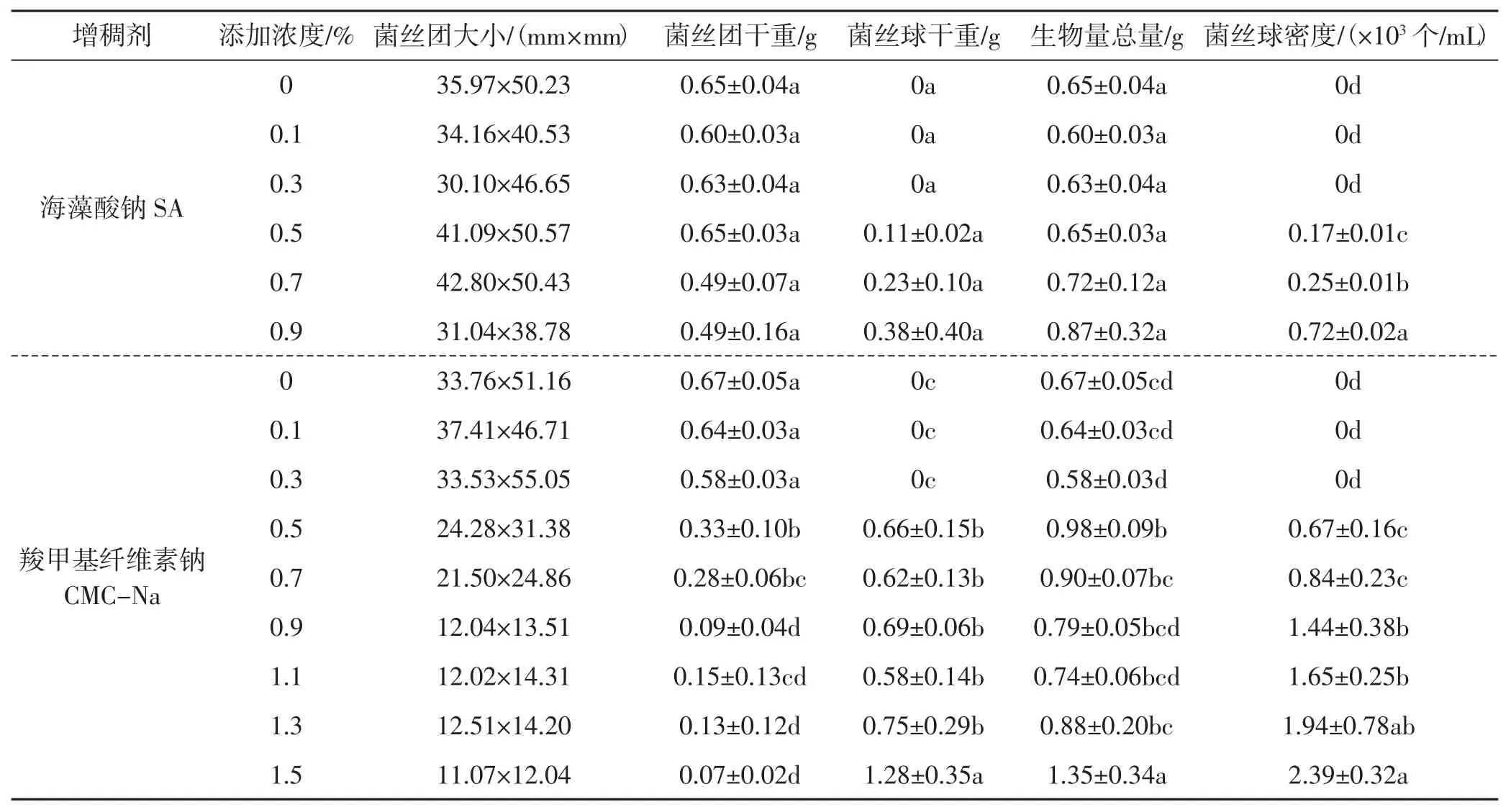
表4 增稠剂对羊肚菌菌丝形态的影响Tab.4 Effects of thickening agent on the mycelium morphology of Morchella sextelata
由表4可知,培养基中添加0~0.3%海藻酸钠时,仅形成菌丝团,而无菌丝球;当添加浓度为0.5%时,培养液菌丝以菌丝团为主,有少量菌丝球形成,但菌丝表面光滑,无毛刺,形似黄豆。由图2、图3可知,当海藻酸钠添加浓度为0.7%~0.9%时,菌丝团变小,菌丝球数量逐渐增多,且光滑菌丝球减少,放射状菌丝球增多,至浓度0.9%时,菌丝球密度达0.72×103个/mL。随着海藻酸钠浓度增加,菌丝球逐渐形成,但羊肚菌菌丝团大小、菌丝团生物量及生物量总量变化不显著。
由表4可知,培养基中添加0~0.3%羧甲基纤维素钠时,仅形成菌丝团,而无菌丝球。由图2、图3可知,当添加浓度为0.5%~1.5%时,随浓度的增加,菌丝团变小,菌丝球数量逐渐增多,呈放射状,有毛刺,均匀分布于培养液中,至浓度1.5%时,菌丝球密度达2.39×103个/mL。随着羧甲基纤维素钠浓度增加,羊肚菌菌丝团生物量逐渐减少,差异显著;菌丝球生物量及总生物量逐渐增加,差异显著;表明添加羧甲基纤维素钠,有利于羊肚菌菌丝生物量的积累。
结果表明,菌丝团的形成与增稠剂浓度呈负相关,菌丝球形成及数量与增稠剂浓度呈正相关。且在同一浓度下,羧甲基纤维素钠能形成放射状菌丝球,且数量多,菌丝球小,菌丝球均匀,可认为羧甲基纤维素钠为最优增稠剂。食用菌液体菌种菌丝球密度一般要达到 1.0×103个/mL~1.5×103个/mL[17],同时结合生产成本,研究以0.9%浓度为羧甲基纤维素钠最优添加浓度,此时菌丝球密度为1.44×103个/mL。
2.4 静置培养对羊肚菌菌丝的影响
在添加0.9%浓度羧甲基纤维素钠增稠剂的基础上,考察静置培养天数对羊肚菌菌丝形态的影响,结果见图4。
从图4可以看出,对照组菌丝体随着静置培养天数的增加,由菌丝团向菌膜变化,至第5天,菌膜与液面大小一致,并漂浮于液面上。添加羧甲基纤维素钠菌丝萌发后则形成小菌丝团和菌丝球,随着静置培养时间的增加,菌丝团向菌膜变化,至第5天,菌膜与液面大小一致,并漂浮于液面上,较对照组长势差;菌丝球则随静置培养时间的增加逐渐减少,至第5天,则无菌丝球形成。静置培养对羊肚菌菌丝生物量及菌丝球密度的影响见图5。
由图5A可知,随着静置培养天数的增加,试验组菌丝球密度呈先上升后下降的趋势,静置第1天时,菌丝球密度最大,为2.70×103个/mL;由图5B可知,菌丝球生物量亦先上升后下降,最大值也在静置第1天。试验组和对照组菌丝生物总量先上升后下降,但二者有明显区别,试验组在静置1 d时最高,对照组在静置2 d时最高,随后下降。结果表明,添加增稠剂,静置培养1 d为最优静置天数。
2.5 装液体积对羊肚菌菌丝的影响
考察液体培养时装液体积对羊肚菌菌丝形态的影响,结果见表5。

表5 装液体积对羊肚菌菌丝形态的影响Tab.5 Effects of working volume on the mycelium morphology of Morchella sextelata
从表5可以看出,随着装液体积的增加,菌丝团大小和菌团生物量逐渐减少,菌丝球生物量和生物量总量逐渐增加,至最大装液量时,质量均达到最大。当体积达150 mL时,达到菌丝球最大密度3.35×103个/mL,而体积在200 mL、250 mL时,也能获得较好的菌丝球密度,分别为2.78×103个/mL和3.11×103个/mL。从菌丝球总量看,其变化趋势也呈先上升后下降的趋势,当体积达250 mL,菌丝球总量达最大,为7.78×105个。结合试验最终目的,即获得最大菌丝球总量,同时结合菌丝浓度,以装液体积250 mL为最优体积。
2.6 正交试验结果
根据单因素试验结果,以静置天数、增稠剂浓度、装液体积为试验因素,设计3因素3水平正交试验。分别以菌丝生物量,菌丝球密度,菌丝球总量为考察对象,进行正交设计表L9(33),试验结果及直观分析表见表6,各考察对象方差分析表见表7、表8、表9。
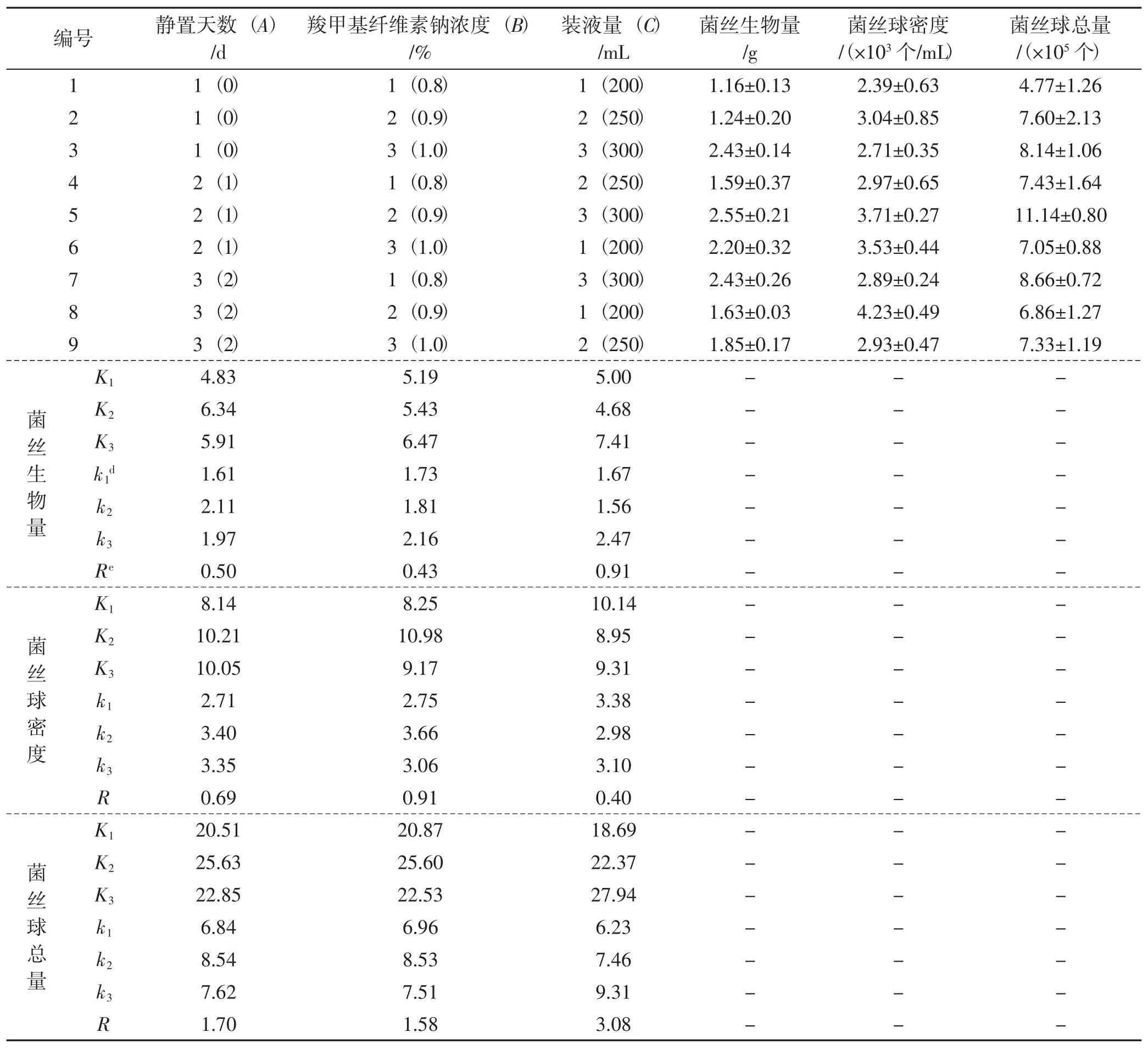
表6 L9(33)正交试验结果及直观分析表Tab.6 The L9(33)orthogonal table and visual analysis

表7 羊肚菌菌丝生物量方差分析表Tab.7 Variance test of mycelial biomass for Morchella sextelata
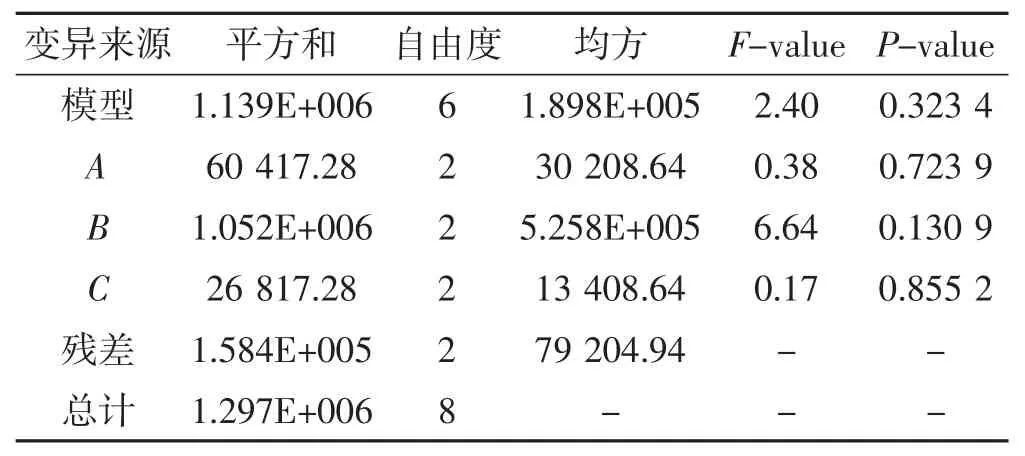
表8 羊肚菌液体种菌丝球密度方差分析表Tab.8 Variance test of concentration of mycelial pellets for Morchella sextelata

表9 羊肚菌菌丝球总量方差分析表Tab.9 Variance test of total number of mycelial pellets for Morchella sextelata
由表6可知,3个试验因素对羊肚菌菌丝生物量影响的R值大小为RC>RA>RB,表明各因素影响顺序为C>A>B。由表7可知,A、C两个因素对羊肚菌菌丝生物量影响显著,其中装液体积(C)为最主要因素,其次为静置培养天数(A),羧甲基纤维素钠浓度(B)影响不显著;表明在培养过程中,静置培养天数及装液体积对羊肚菌菌丝生物量的形成具有显著作用。按照各因素的最优水平,A2B3C3水平组合为菌丝生物量试验最优组合。由表8可知,菌丝球密度方差分析模型不显著,表明各试验因素对菌丝球密度无显著影响,通过直观分析表直接选择最优组合A2B3C3。
从表6可以看出,3个试验因素对羊肚菌菌丝球总量影响的R值大小为RC>RA>RB,表明各因素影响顺序为C>A>B。从表9看出,A、B、C三个因素对羊肚菌菌丝球总量影响显著,其中装液体积(C)为最主要因素,静置培养天数(A)为次要因素,羧甲基纤维素钠浓度(B)影响最小;表明在培养过程中,3个因素对羊肚菌菌丝球总量的形成具有显著作用。按照各因素的最优水平,A2B2C3水平组合为菌丝球总量试验的最优组合。
通过对菌丝生物量及菌丝球总量的分析和比较,分别得出A2B3C3和A2B2C3两个不同组合,结合Design-Expert软件分析及推荐组合(A2B2C3),分别对A2B3C3和A2B2C3组合进行验证。结果表明,A2B3C3菌丝生物量(1.73±0.11) g·300-1mL-1,菌丝球总量(8.66±1.24) ×105个;A2B2C3菌丝生物量 (2.45±0.05) g·300-1mL-1,菌丝球总量 (10.65±0.39)×105个;而软件预测结果为2.61 g·300-1mL-1,菌丝球总量11.24×105个。试验结果与预测结果接近,故本研究选择A2B2C3组合,即羧甲基纤维素钠0.9%,500 mL装液量300 mL,静置培养天数1 d。
3 讨论
3.1 培养方法对羊肚菌菌丝生长的影响
试验比较了不同培养基、玻璃珠、增稠剂、静置天数和装液量对羊肚菌菌丝、生物量和菌丝球密度的影响,不同培养方法对羊肚菌菌丝生长影响差异显著。研究结果表明,玻璃珠可以作为菌丝分散剂[18-20],降低菌丝球的大小,改变菌丝形态。试验添加不同数量玻璃珠后,对羊肚菌菌丝形态影响不大,仅形成菌丝团,且随着数量增加,生物量逐渐减少,表明玻璃珠的剪切力对菌丝生长及生物量积累有抑制作用,与报道一致[20]。
3.2 增稠剂对羊肚菌菌丝生长的影响
增稠剂能明显改变液体粘性,可以改变真菌菌丝形态[21-23]。研究选择食品行业普遍使用的羧甲基纤维素钠(CMC-Na)[24]和海藻酸钠[25]作为增稠剂,添加低浓度羧甲基纤维素钠和海藻酸钠时,只产生菌丝团;随着浓度增加,菌丝球数量增多,菌物生物量增加,同等条件下以羧甲基纤维素钠效果最好。试验以0.9%的羧甲基纤维素钠为最优浓度。分段培养对菌丝形成及代谢物积累有一定的影响[26-27],试验以静置1 d时,菌丝球及菌丝生物量最大,表明前期静置培养有利于菌种对培养基环境适应,利于后期菌丝的形成,而随着静置时间增加,菌丝生物量逐渐减少,可能是菌丝萌发过多,且总培养时间较短,不利于菌丝球及菌丝的形成。
3.3 对羊肚菌生物量的影响
制备液体菌种时,以单次培养获取最大生物量最佳,但同时要考虑液体培养时,培养基中溶氧量对微生物的影响。试验以菌丝球密度及菌丝球总量为考察指标,结果以500 mL装液300 mL液体培养基为最佳装液量,菌丝球密度高,菌丝球总量大,较刘达玉等[28]和季向阳等[29]结果更优。对增稠剂、静置天数、装液量进行优化试验,菌丝生物量最大达2.45 g·300-1mL-1(8.17 mg·mL-1),优于李红[12]和金朝霞等[9]的研究结果。菌丝球密度达到3.55×103个/mL,较许瀛引等[13]的结果稍高,菌丝球密度高,萌发点多。
4 结论
以六妹羊肚菌为试验材料,通过单因素试验,正交优化试验对玻璃珠、增稠剂、静置天数、装液体积4个因素进行筛选及优化。最优培养条件为0.9%羧甲基纤维素钠,500 mL装液体培养基300 mL,在25℃黑暗条件下先静置培养1 d后,150 r·min-1条件培养4 d;菌丝生物量最大可达2.45 g·300-1mL-1,菌丝球密度达到3.55×103个/mL,生物量大,菌球浓度高。为羊肚菌液体菌种制备和液体发酵培养提供了技术支撑。
