TUDCA通过抑制内质网应激及氧化应激减轻CCl4所致小鼠急性肝损伤
2020-03-08苏艾荣许金金蒋秀琴
苏艾荣,许金金,蒋秀琴
(南京医科大学第二附属医院 临床分子基因检测中心,江苏 南京 210003)
肝脏是内源性及外源性化合物转化代谢的主要场所。药物服用剂量不当、不慎摄入毒物、病毒感染以及大量饮酒均会导致肝功能的急性损伤。急性肝损伤如果不能得到及时有效的治疗会引发严重的、不可逆转的后果,诸如肝纤维化、肝硬化甚至肝癌。四氯化碳(CCl4)诱导小鼠或者大鼠肝损伤是一种广泛使用的急性、慢性肝损伤动物模型,可以用来评价药物对肝损伤的保护作用及其机制[1]。CCl4引起肝损伤的发病机制,主要是通过细胞色素p450系统导致自由基产生[2]。研究发现,当细胞受到自由基攻击时,内质网膜受损导致细胞内钙离子稳态失衡进而引发内质网应激(endoplasmic reticulum stress),内质网应激发生后可以进一步加重细胞内自由基的产生,导致细胞损伤更加严重[3]。
牛磺熊去氧胆酸(tauroursodeoxycholic acid, TUDCA)是一种广泛存在于人类和动物体内的天然结合型胆汁酸。已有的研究表明,TUDCA促进胆汁酸的分泌和转运,对CCl4诱导的肝纤维化具有抑制作用[4]。Ozcan等[5]的研究发现,TUDCA通过调节内质网应激信号通路恢复2型糖尿病小鼠的血糖稳态。Hassan等[6-7]的研究结果显示,TUDCA抑制流感病毒及呼吸道合胞病毒的复制,其抗病毒机制也是通过调节内质网应激信号通路发挥作用。本研究复制了急性肝损伤的小鼠模型,观察 TUDCA对CCl4所致急性肝损伤是否有作用,并进一步探究其可能的机制,为临床从内质网应激角度治疗急性肝损伤提供实验依据。
1 材料与方法
1.1 材料
实验动物与分组:健康4周龄雄性BALB/c小鼠24只,体重20~25 g,购于南京大学模式动物所。动物饲养于室温[(22±2)℃],于实验前适应性饲养1周,随机分为对照组、CCl4组、TUDCA预处理组3组,每组8只。TUDCA(PubChem CID:101593705) 购自Sigma-Aldrich(sigma,美国);CCl4(分析纯级)购自南京生兴生物技术有限公司;放射免疫沉淀法缓冲液(RIPA)、甘油醛-3-磷酸脱氢酶(GAPDH)及c-Jun氨基末端激酶(cJUN N-terminal kinase,JNK)2抗鼠单克隆抗体购自Santa Cruz(Santa Cruz,美国);特异性免疫球蛋白重链结合蛋白(binding immunoglobulin protein,Bip)、肌醇需求酶1(inositol-requiring kinase 1,IRE1)和 磷酸化JNK(p-JNK) 抗体购自 Cell Signaling Technology(Beverly,美国)。抗磷酸化IRE1兔单克隆抗体购自Abcam(Cambridge,美国)。
1.2 方法
1.2.1 造模及给药方法 TUDCA预处理组小鼠按照250 mg·kg-1腹腔注射TUDCA,早8:00与晚8:00分别注射1次,一日总剂量为500 mg·kg-1,共持续7 d;CCl4组及对照组小鼠给予同样体积的生理盐水。用玉米油和CCl4按照1∶1比例配制CCl4油溶液,在第7天TUDCA腹腔注射2 h后,TUDCA预处理组及CCl4组小鼠均按照1 ml·kg-1腹部皮下注射CCl4油剂,对照组同样方法给予同样剂量的生理盐水,所有实验动物自由饮水、摄食。
1.2.2 取材 CCl4注射后24 h用1%戊巴比妥钠麻醉动物,腹主动脉取血,4 ℃过夜,3 000 r·min-1离心留取血清,存放于-20 ℃备用;留取同样部位肝脏(右叶)标本,分为3份备用:1份置于4%多聚甲醛溶液中固定,72 h后进行石蜡包埋,制作病理切片;另外2份迅速置于液氮中,随后转移至-80 ℃保存,分别用来提取总RNA及总蛋白的后续检测。
1.2.3 血清丙氨酸氨基转移酶(AST)和天冬氨酸氨基转移酶(ALT)检测 微板法检测血清AST及ALT含量,试剂盒购自南京建成生物工程研究所,实验方法参照说明书。
1.2.4 血清丙二醛(MDA)及总超氧化物歧化酶(SOD)水平检测 通过检测血清中MDA和SOD含量,反映CCl4所致的肝组织中细胞膜脂质过氧化程度,试剂盒由南京建成生物工程研究所提供,实验方法参照说明书。
1.2.5 RNA提取、PCR 和实时荧光定量PCR分析 使用TRIzol试剂(Life Technologies,美国)提取肝组织中的总RNA,取1 μg总RNA在20 μl反应体系中采用反转录PCR 试剂盒(TOYOBO,日本)进行反转录。PCR所用引物序列为:X盒结合蛋白1(X-box binding protein 1, XBP1):上游 5′-GAACCAGGAGTTAAGAACACG-3′,下游 5′-AGGCAACAGTGTCAGAGTCC-3′;内参基因GAPDH:上游 5′-GCCGGACTCATCGTACTCC-3′,下游 5′-GTGACGTTGACATCCGTAAAGA-3′。实时荧光定量PCR设置3个复孔,所用引物:Bip:上游 5′-ACTTGGGGACCACCTATTCCT-3′,下游5′-ATCGCCAATCAGACGCTCC-3′;GAPDH:上游5′-TGAACGGGAAGCTCACTGG-3′,下游5′-TCCACCACCCTGTTGCTGTA-3′。
1.2.6 蛋白免疫印迹实验 小鼠肝组织匀浆后使用RIPA裂解液在冰上裂解30 min,4 ℃、12 000×g离心10 min,取上清,使用BCA蛋白定量试剂盒(Pierce,美国)进行总蛋白定量检测。分别取60 μg总蛋白变性,聚丙烯酰胺凝胶电泳分离,蛋白转印到PVDF(Millipore,美国)膜上,室温封闭1 h,一抗4 ℃孵育过夜,PBST洗涤后加入荧光标记的二抗孵育1 h,PBST洗涤后在Odyssey(LI-COR,美国)仪器扫描显示结果。
1.3 统计学处理
2 结 果
2.1 TUDCA对小鼠急性肝损伤的保护作用
为了检测TUDCA预处理对小鼠肝组织损伤的作用,本实验检测了小鼠血清中ALT和AST的活力,结果显示,CCl4组小鼠血清ALT和AST活力显著上升(表1)。与CCl4组相比较,TUDCA预处理组小鼠血清ALT和AST活性降低具有统计学意义(图1A、B)。肝脏HE染色进一步显示TUDCA预处理对肝细胞损伤的保护作用:对照组小鼠肝细胞以中央静脉为中心向四周呈放射状整齐排列,组织结构完整(图1C);CCl4组小鼠肝细胞排列紊乱,显示弥漫性脂肪变性,大量空泡形成(图1D);TUDCA预处理组小鼠肝细胞排列接近对照组,结构相对完整,未见明显的肝细胞脂肪变性(图1E)。以上结果提示,TUDCA预处理对CCl4所致的急性肝损伤具有显著的保护效果。
表1 各组小鼠血清ALT和AST活性比较(±s,n=8)

表1 各组小鼠血清ALT和AST活性比较(±s,n=8)
组 别ALT活性/U·L-1AST活性/U·L-1对照组22.3±5.815.7±2.4CCl4组150.6±9.7a138.4±8.3aTUDCA预处理组103.8±10.6b110.4±7.2bF值420.92777.88P值0.000.00
a 与对照组比较,P<0.05;b与CCl4组比较,P<0.05
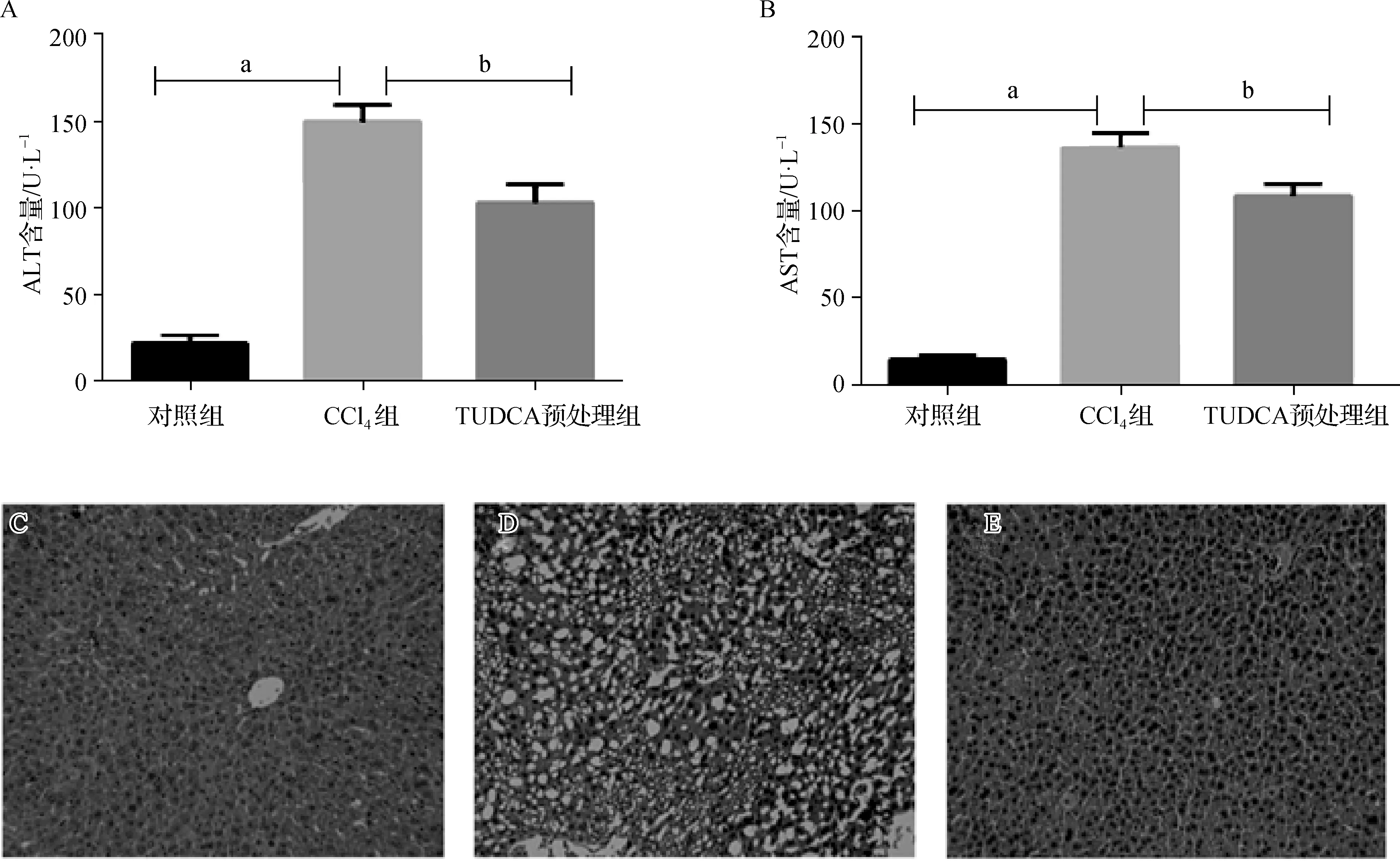
图1 TUDCA预处理对CCl4所致急性肝损伤的保护效果 A、B. 各组小鼠血清中ALT(A)及AST(B)活性比较;a与对照组比较,P<0.05;b 与CCl4组比较,P<0.05;C~E. 对照组(C)、CCl4组(D)、TUDCA预处理组(E)小鼠肝组织HE染色结果(×400)
2.2 TUDCA预处理减轻自由基对小鼠肝组织的攻击
表2显示,与单独的CCl4作用相比,TUDCA预处理显著降低了血清MDA含量(图2A),提升了血清SOD活性(F=749.87,P<0.05,图2B)。结果提示,TUDCA显著减少了由CCl4在肝脏代谢中产生的自由基,从而缓解自由基对肝组织的损伤。
表2 各组小鼠血清SOD活性和MDA含量比较(±s,n=8)
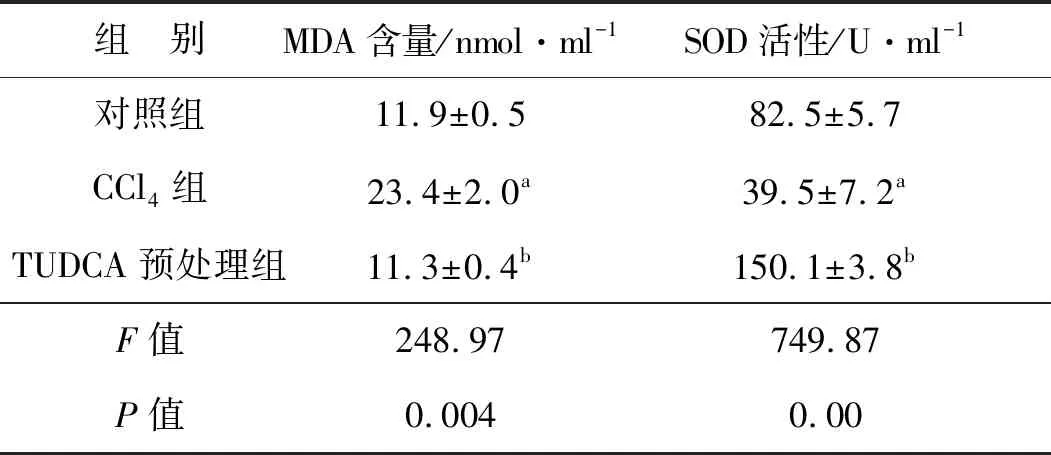
表2 各组小鼠血清SOD活性和MDA含量比较(±s,n=8)
组 别MDA含量/nmol·ml-1SOD活性/U·ml-1对照组11.9±0.582.5±5.7CCl4组23.4±2.0a39.5±7.2aTUDCA预处理组11.3±0.4b150.1±3.8bF值248.97749.87P值0.0040.00
a 与对照组比较,P<0.05;b 与CCl4组比较,P<0.05
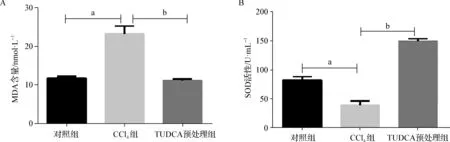
a 与对照组比较,P<0.05;b 与CCl4组比较,P<0.05
2.3 TUDCA预处理抑制CCl4刺激产生的内质网应激
因为Bip的表达变化可以作为内质网应激发生的标志[8],因此本研究检测了各组小鼠肝脏组织细胞中Bip的表达。与对照组比较,CCl4组小鼠肝组织中Bip的蛋白和基因表达均显著升高,而TUDCA预处理组小鼠肝组织中的Bip表达接近对照组(图3),提示TUDCA预处理显著抑制了CCl4急性肝损伤所致的内质网应激程度。

a 与对照组比较,P<0.05;b 与CCl4组比较,P<0.05
2.4 TUDCA预处理抑制CCl4对IRE1信号通路的激活
内质网应激发生时,在Bip表达升高的同时,往往伴随下游信号通路的激活。本研究进一步检测了内质网应激发生时激活的IRE1的变化。IRE1的磷酸化程度代表该通路的活化程度,CCl4组小鼠肝组织中磷酸化IRE1蛋白比例明显增加,与之相比,TUDCA预处理组小鼠肝组织中IRE1磷酸化水平显著降低(图4A)。为了进一步证实TUDCA预处理对IRE1信号通路的影响,我们检测了IRE1下游信号分子的变化情况。IRE1核酸内切酶活性剪切XBP1(unspliced XBP1,XBP1u)成为剪切型XBP1(spliced XBP1,XBP1s)[9]。由图4B可以看出,CCl4组小鼠肝组织中XBP1u被剪切为XBP1s,而TUDCA预处理组未检测到XBP1s,进一步证实TUDCA预处理抑制了IRE1的激活;此外,本研究还检测了IRE1激酶活性的变化情况。IRE1激酶活性激活时,可以通过募集肿瘤坏死因子受体相关因子-2(TRAF2)蛋白进而激活JNK分子,诱导细胞凋亡[10]。本研究结果显示,CCl4处理组小鼠肝组织中JNK分子显著激活,而TUDCA预处理组未检测到JNK通路的激活(图4C)。总之以上结果提示,TUDCA预处理可以有效抑制由CCl4所致的IRE1信号通路的激活。
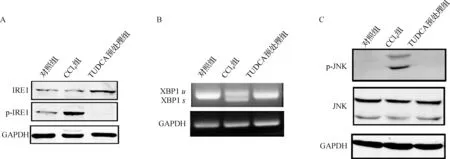
图4 TUDCA预处理对CCl4所致IRE1信号通路的影响 A. 各组小鼠肝组织中非磷酸化及磷酸化IRE1的表达;B. 各组小鼠肝组织中IRE1核酸内切酶对XBP1剪切的结果;C. 各组小鼠肝组织中JNK分子的激活程度
3 讨 论
药物或有毒物质在经过肝脏代谢的过程中会对肝细胞产生直接或者间接的损伤,诱发肝细胞发生氧化应激或凋亡,最终导致肝细胞脂质过氧化、脂肪变性以及坏死。CCl4是最常用的复制急性肝损伤动物模型的一种化合物,其引起肝损伤的病理过程与临床所见多种原因所致急、慢性肝损伤过程类似[11]。已有研究发现:TUDCA可以通过减轻内质网应激从而抑制呼吸道合胞病毒及禽流感病毒的复制[6-7];TUDCA通过抑制内质网应激,改善糖尿病小鼠胰腺细胞分泌血糖的功能[5]。本研究探究TUDCA预处理对急性肝损伤的保护作用,实验结果显示,TUDCA预处理组小鼠在接受CCl4注射后肝功能受损轻微,各项指标均接近对照组小鼠,提示TUDCA预处理对急性肝损伤有良好的保护作用。Bip的表达升高是内质网应激发生的标志[12],TUDCA预处理显著抑制CCl4所致Bip的表达升高。IRE1是内质网应激发生时激活的通路之一,TUDCA预处理显著抑制了CCl4所致IRE1信号通路的激活。这些结果提示TUDCA预处理有效抑制了CCl4所引起的内质网应激,这一机制可能是TUDCA改善CCl4所致的小鼠急性肝损伤程度的原因之一。
代谢产生的活性氧自由基对肝组织中细胞膜的损伤是CCl4所致肝损伤的主要机制[13]。研究提示,TUDCA可以增强细胞的抗氧化机能[14]。本研究显示,与CCl4组相比,TUDCA预处理组小鼠血清中的SOD活性显著上升,脂质过氧化产物MDA含量接近对照组,提示TUDCA预处理有助于增强细胞对自由基的清除能力,最终减轻CCl4所致的小鼠肝组织中细胞氧化损伤的程度。
氧化应激与内质网应激之间亦存在着密切的联系[15]。在病理情况下诱发的氧化应激可以刺激内质网应激发生[16],内质网应激发生后亦可以刺激氧化应激的发生[15]。因此可以推测内质网应激与氧化应激之间存在相互促进的正反馈关系。目前大多数对TUDCA的研究均聚焦其在内质网应激方面的功能,作为一个具有显著抑制内质网应激的化合物,其减轻氧化应激程度的机制尚未完全阐明。本研究结果提示,TUDCA预处理不但显著抑制了CCl4所致的内质网应激,而且对CCl4所致的氧化应激性程度亦有显著的减轻作用。依据本研究结果我们推测,CCl4在肝脏代谢产生各类自由基并损伤肝细胞的过程中激活了内质网应激,内质网应激发生后进一步增加各类自由基的产生,加剧肝组织中细胞脂质过氧化损伤,TUDCA通过抑制内质网应激的发生,抑制由内质网应激对氧化应激信号的激活这一恶性循环,最终对肝细胞发挥保护作用。
