miRNA-30e靶向5-LOX对大鼠脑缺血再灌注损伤的影响
2020-03-08毛士明曹金强汪万国郑灿
毛士明,曹金强,汪万国,郑灿
(枝江市人民医院 神经内科,湖北 枝江 443200)
再灌注损伤是缺血性脑卒中治疗过程中的一个难题,深入探讨缺血再灌注(ischemia-reperfusion,IR)损伤的机制对其治疗有重要意义。微小RNA(microRNA,miRNA)是一类长度19~22个核苷酸的非编码RNA,可以与信使RNA的3′端非翻译区结合,介导转录后基因调控[1]。miRNA广泛表达于人体各个组织和器官,在细胞增殖和分化、细胞周期、表观遗传学和免疫监控中起到重要作用[1]。miR-30e与机体免疫炎症损伤密切相关[2],可通过调控凋亡基因Bcl-2影响脑缺血后神经细胞损伤[3]。有研究发现,miR-30e可以通过改善自噬对心脏IR损伤有一定保护作用[4]。miR-30e在脑IR损伤中的作用和机制既往鲜有报道。5-脂氧合酶(5-lipoxygenase,5-LOX)是白三烯生物合成的关键酶,与中枢神经系统炎症性疾病有关[5]。5-LOX过表达可促进促炎细胞因子的产生,导致脑IR损伤后神经元损伤[6]。本研究采用生物信息学和双荧光素酶报告基因技术分析miR-30e与5-LOX的靶向作用关系,通过大鼠实验探讨miR-30e在脑IR损伤中的作用机制。
1 材料与方法
1.1 材料
1.1.1 试剂与仪器 miR-30e 激动剂(miR-30e agomir)、miR-30e 激动剂对照试剂、miR-30e 拮抗剂(miR-30e antagomir)、miR-30e 拮抗剂对照试剂、miR-30e模拟物、miR-30e抑制剂和5-LOX siRNA均购于上海吉玛制药技术有限公司;2,3,5-氯化三苯基四氮唑购于上海碧云天生物技术有限公司;TRIzol试剂、反转录试剂盒和2倍SYBR Green PCR Mastermix试剂盒均购于美国Sigma公司;BCA蛋白提取试剂盒和SDS-PAGE凝胶快速制备试剂盒均购于北京百奥莱博科技有限公司;5-LOX抗体和羊抗兔抗体购于美国Sigma公司;酶联免疫吸附实验试剂盒购于武汉博士德生物有限公司;二甲基亚砜、噻唑兰(MTT)检测试剂盒购于美国Sigma公司。主要仪器有脑立体定位仪(型号51700,美国Stoelting公司)、全自动发光仪(型号ACCESS2,美国贝克曼库尔特公司)、酶标仪(型号SAF-680T,上海旦鼎国际贸易有限公司)、流式细胞仪(型号FACSCalibur,美国BD公司)。
1.1.2 细胞 PC12细胞购于上海复祥生物科技有限公司,用含有10%胎牛血清的 RPMI 1640 培养基,置于 37 ℃、5%CO2培养箱中培养。当细胞融合度达90%时,倒掉培养液,用0.125%胰蛋白酶消化细胞后1 000 r·min-1离心10 min,用细胞培养液悬浮细胞,接种于培养基中继续培养。
1.1.3 实验动物 成年雄性SD大鼠70只,体重250~300 g,购于北京维通利华实验动物公司,合格证号SCXK(京)2012-003。将大鼠在温度为(21±1)℃、湿度为(50±5)%、明暗周期为12 h/12 h的环境中饲养,允许自由摄食和饮水。
1.2 大鼠脑IR损伤模型的建立
参照文献[7]方法建立大脑中动脉闭塞再灌注模型。用100 g·L-1水合氯醛溶液(3 ml·kg-1)腹腔注射麻醉后分离颈总动脉分叉、颈外动脉、颈内动脉,结扎颈外动脉和颈总动脉近心端,随后用动脉夹夹闭颈总动脉远心端。在颈总动脉分叉上2 mm处开一小口,将尼龙线栓缓慢插入颈总动脉,调整头端方向,感觉有突破感时说明进入颅内。继续推进20 mm,感到有阻力时停止。将颈内动脉远心端的预留线系紧,剪去线头。术毕逐层缝合皮肤。缺血2 h后拔出线栓,若大鼠出现明显的局灶神经功能缺损例如一侧倾倒,说明造模成功。本研究大鼠均造模成功。
1.3 大鼠分组及干预
将大鼠随机分为7组各10只:(1) 假手术组,仅做颈部切口,无IR损伤;(2) 模型组,建立脑IR损伤模型;(3) 载体组,建立IR损伤模型,用焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)处理水干预;(4) miR-30e激动剂组,建立IR损伤模型,用miR-30e激动剂干预;(5) 激动剂对照组,建立IR损伤模型,用激动剂对照试剂干预;(6) miR-30e拮抗剂组,建立IR损伤模型,用miR-30e拮抗剂干预;(7) 拮抗剂对照组,建立IR损伤模型,用拮抗剂对照试剂干预。3~7组大鼠均进行侧脑室注射(前囟后1 mm,向右旁1.4 mm,硬脑膜下4.0 mm[8]),将miR-30e激动剂、激动剂对照试剂、miR-30e拮抗剂、拮抗剂对照试剂溶于DEPC处理水中,稀释至100 μmol·L-1,注射体积为10 μl。干预24 h后进行神经功能评分:无明显神经功能缺损为0分,提尾巴时动物左前肢屈曲不能伸直为1分,行走时向左侧转圈、静息时可维持平衡为2分,行走时向偏瘫侧倾倒为3分,无可见活动为4分[9]。评估结束后处死大鼠。
1.4 大鼠脑梗死体积检测
处死大鼠后迅速取脑,用切片机切成5个冠状切片,厚度约2 mm。用2%的2,3,5-氯化三苯基四氮唑染色30 min,然后浸泡于4%多聚甲醛过夜。梗死组织为白色,正常脑组织为红色。梗死体积(%)=缺血区重量/总重量。
1.5 实时定量-聚合酶链反应(RT-PCR)
用TRIzol试剂和反转录试剂盒提取大鼠皮质梗死周围区组织中的总RNA,随后反转录为cDNA。使用2倍SYBR Green PCR Mastermix试剂盒检测miR-30e与5-LOX mRNA的相对表达量。PCR反应条件为:95 ℃ 20 s、95 ℃ 10 s、60 ℃、20 s,共40个循环。用2-ΔΔCq法计算基因相对表达量。
1.6 蛋白质印迹实验
用RAPI裂解液提取大鼠皮质梗死周围区组织中总蛋白,用BCA试剂盒检测蛋白浓度,10%SDS-PAGE分离蛋白,用半干转移法将蛋白转至PVDF膜。5%脱脂奶粉封闭2 h,加入抗5-LOX(1∶1 000)4 ℃过夜孵育,第2天除去一抗,用TBST缓冲液洗涤3次后加入二抗(羊抗兔,1∶500),封闭1 h。以β-肌动蛋白作为内参,用ECL发光仪对蛋白成像,Image J软件分析灰度值。
1.7 酶联免疫吸附试验
操作步骤严格按照试剂盒说明书进行,酶标仪在450 nm波长下检测半胱氨酸白三烯(cysteinylleukotrienes,CysLT)和白三烯B4(leukotriene B4,LTB4)的OD值,绘制标准曲线后计算浓度。
1.8 双荧光素酶报告实验
应用Targetscan和MiRDB软件预测miR-30e和5-LOX的结合位点。构建野生型(psiCHECKTM-2-5-LOX-wt)和突变型(psiCHECKTM-2-5-LOX-mut)报告载体,转染至293T细胞中,再用miR-30e 模拟物或抑制剂进行干预。实验分为以下7组:(1) 仅将空载体组转染至293T细胞中,设为psiCHECKTM-2组;(2) 将 阴性对照序列转染入含有野生型空载体的293T细胞中,设为5-LOX-Wt+NC组;(3) 野生型报告载体转入293T细胞中,用miR-30e 模拟物干预,设为5-LOX-Wt+mimic组;(4) 野生型报告载体转入293T细胞中,用miR-30e 抑制剂干预,设为5-LOX-Wt+inhibitor组;(5) 将阴性对照序列转染入含有突变型空载体的293T细胞中,设为5-LOX-Mut+NC组;(6) 将突变型报告载体转入293T细胞中,用miR-30e 模拟物干预,设为5-LOX-Mut+mimic组;(7) 将突变型报告载体转入293T细胞中,用miR-30e抑制剂干预,设为5-LOX-Mut+inhibitor组。psiCHECKTM-2载体能同时表达肾素荧光素酶和萤火虫荧光素酶。miR-30e与5-LOX-Wt载体的结合作用可降低肾素荧光素酶,而非萤火虫荧光素酶的表达。细胞转染24 h后收集细胞,用PromegaE1910双萤光素酶报告基因检测系统测定萤火虫和肾素荧光素酶的活性。
1.9 细胞缺氧复氧损伤模型建立及干预
转染mimic或inhibitor后,建立缺氧-葡萄糖剥夺和复氧(oxygen glucose deprivation and reoxygenation,OGDR)损伤模型。将PC12细胞在缺氧(1%O2、94%N2和5%CO2)室中培养12 h,随后在正常条件下培养4 h[10]。根据处理条件不同将细胞分为以下几组:(1) 常 氧组,细胞在正常氧气条件下培养;(2) OGDR组,建立OGDR损伤模型,但不进行干预;(3) mim-miR-NC组,建立OGDR损伤模型,用miR-30e模拟物对照试剂干预;(4) mim-miR-30e组,建立OGDR损伤模型,用30 μmol·L-1miR-30e mimic干预;(5) mim-miR-30e+si-5-LOX组,建立OGDR损伤模型,用30 μmol·L-1miR-30e mimic和2 μmol·L-1si-5-LOX干预;(6) inh-miR-NC组,建立OGDR损伤模型,用miR-30e抑制剂对照试剂进行干预;(7) inh-miR-30e组,建立OGDR损伤模型,用100 nmol·L-1miR-30e inhibitor干预;(8) inh-miR-30e+si-5-LOX组,建立OGDR损伤模型,用100 μmol·L-1miR-30e inhibitor和2 μmol·L-1si-5-LOX干预。
1.10 细胞活力检测
用MTT法检测细胞活力,PC12细胞接种于96孔板,当细胞融合度达80%时进行如1.9中的细胞干预。随后每孔加入20 μl的MTT液,37 ℃条件下孵育4 h,去除原培养基,在每孔中加入二甲基亚砜(150 μl),用酶标仪检测细胞活力。
1.11 流式细胞检测实验
将细胞接种于96孔板,当细胞融合度达80%时进行如1.9中的细胞干预。加入磷酸盐缓冲液,调整细胞浓度至1×105个·ml-1。 混合后取1 ml细胞悬液,100 r·min-1离心10 min后弃上清,加入碘化丙啶和膜联蛋白Ⅴ-FITC各5 μl,充分混合,室温避光孵育10 min。用流式细胞仪检测细胞凋亡情况。
1.12 统计学处理
采用SPSS 19.0进行统计学分析,多组间比较用单因素方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 miR-30e激动剂或拮抗剂对IR损伤大鼠神经功能和脑梗死的影响
假手术组大鼠无神经功能障碍及脑梗死;其余6组神经功能评分明梗死体积的比较差异有统计学意义(分别F=65.321和F=52.109,均P<0.001);与激动剂对照组比较,miR-30e激动组神经功能评分明显较低、梗死体积明显较小(均P<0.05);与拮抗剂对照组比较,miR-30e拮抗剂组神经功能评分明显较高、梗死体积明显较大(均P<0.05)。见图1。
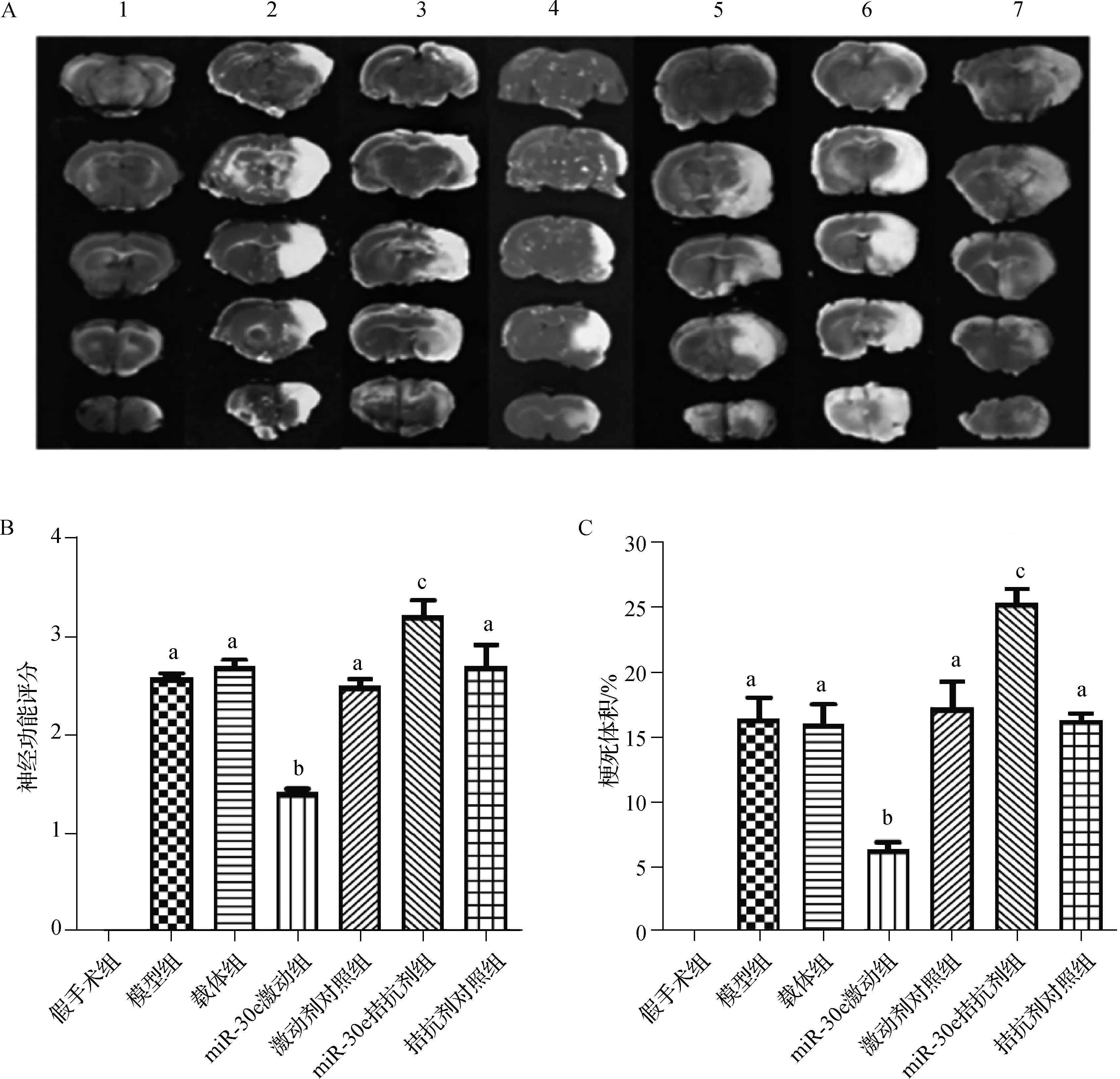
a 与假手术组比较,P<0.05;b 与激动剂对照组比较,P<0.05;c 与拮抗剂对照组比较,P<0.05
2.2 miR-30e激动剂或拮抗剂对IR损伤大鼠5-LOX的影响
7组miR-30e相对表达量和 5-LOX蛋白表达量的比较差异均有统计学意义(分别F=44.240和F=29.002,均P<0.001);与假手术组比较,模型组大鼠皮质梗死周围区组织miR-30e和5-LOX表达水平明显升高(均P<0.05);与激动剂对照组比较,miR-30e激动组miR-30e和5-LOX表达水平明显下降(均P<0.05);与拮抗剂对照组比较,miR-30e拮抗剂组miR-30e和5-LOX表达水平明显升高(均P<0.05)。见图2。

a 与假手术组比较,P<0.05;b 与激动剂对照组比较,P<0.05;c 与拮抗剂对照组比较,P<0.05
2.3 miR-30e激动剂或拮抗剂对IR损伤大鼠炎症因子的影响
7组CysLT和LTB4 表达水平的比较差异均有统计学意义(分别F=23.931和F=30.002,均P<0.001);与假手术组比较,模型组大鼠皮质梗死周围区组织CysLT和LTB4表达水平明显升高(均P<0.05);与激动剂对照组比较,miR-30e激动组CysLT和LTB4表达水平明显下降(均P<0.05);与拮抗剂对照组比较,miR-30e拮抗剂组CysLT和LTB4表达水平明显升高(均P<0.05)。见图3。
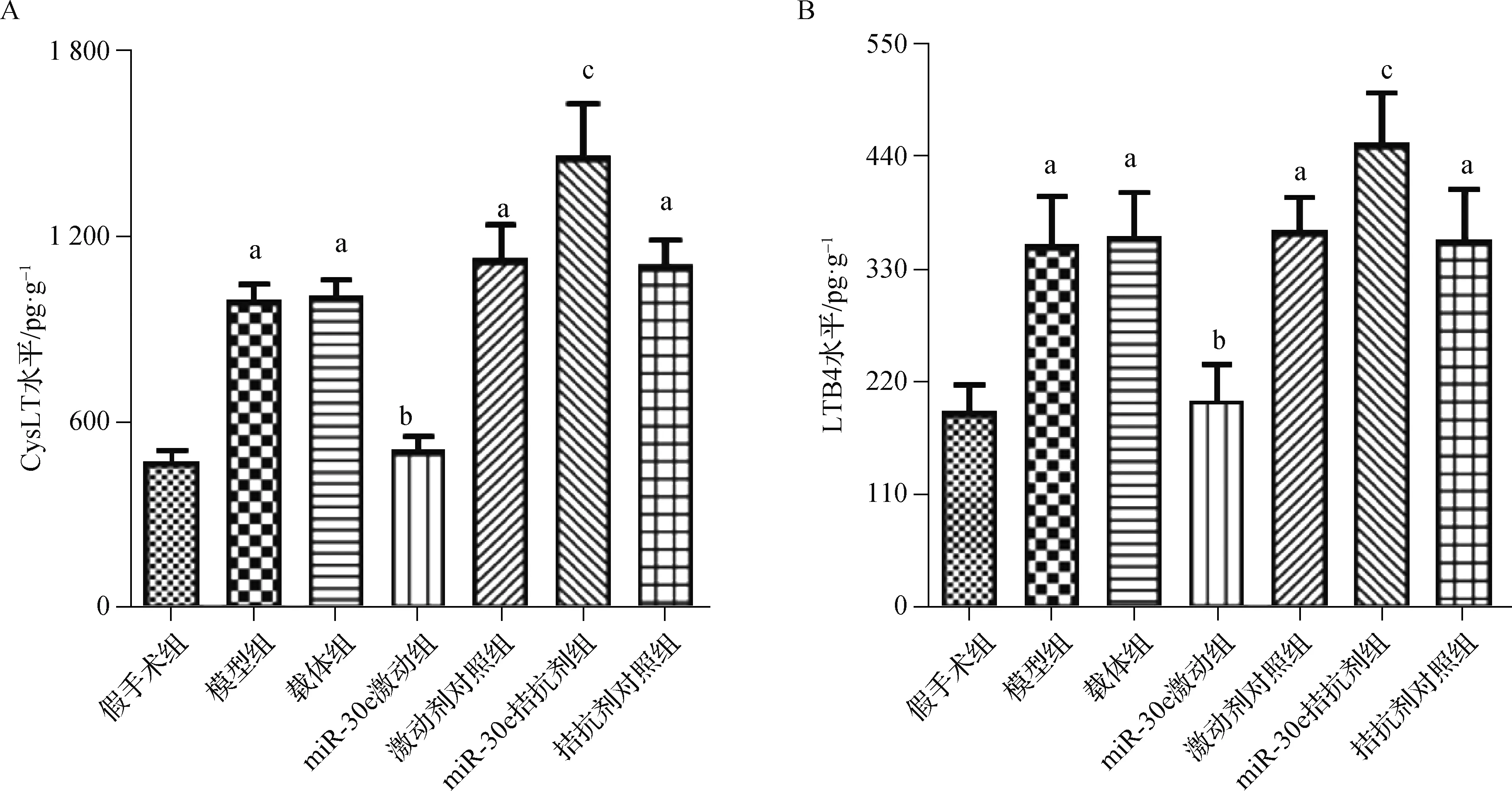
a 与假手术组比较,P<0.05;b 与激动剂对照组比较,P<0.05;c 与拮抗剂对照组比较,P<0.05
2.4 双荧光素酶报告实验验证miR-30e对5-LOX的靶向作用关系
用TargetScan在线工具预测到5-LOX是miR-30e的候选靶基因。7组肾素/萤火虫荧光素酶活性比值的比较差异有统计学意义(F=11.234,P=0.001)。与5-LOX-Wt+NC组比较,5-LOX-Wt+mimic组的肾素/萤火虫荧光素酶活性比值明显降低(P<0.05),5-LOX-Wt+inhibitor组明显升高(P<0.05)。当miR-30e结合位点发生突变时,5-LOX-Mut+mimic组和5-LOX-Mut+inhibitor组的肾素/萤火虫荧光素酶活性比值均保持在较高水平,见图4。以上结果说明,5-LOX是miR-30e的靶基因。
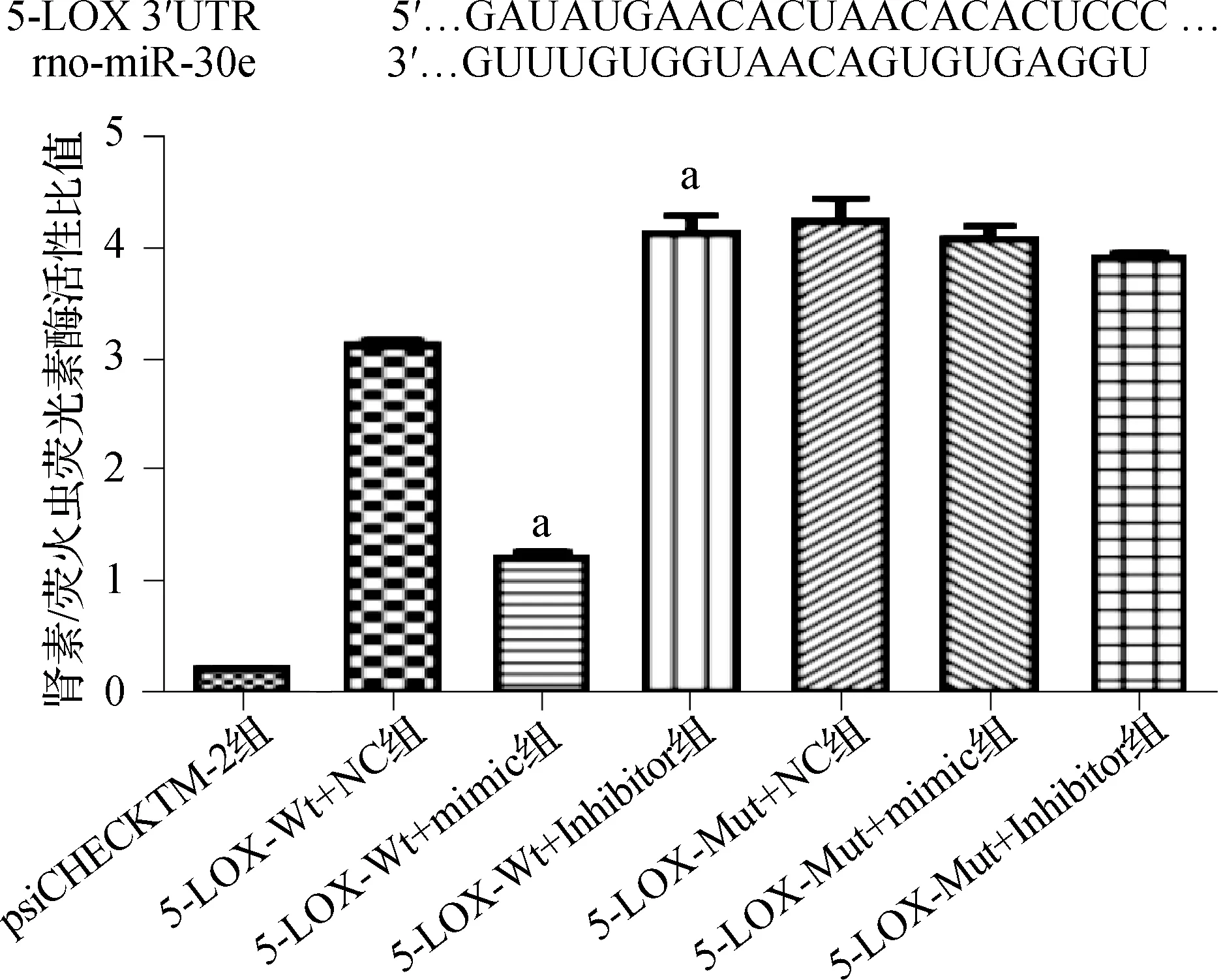
a 与5-LOX-Wt+NC组比较,P<0.05
2.5 miR-30e 模拟物或抑制剂对OGDR损伤细胞5-LOX的影响
6组miR-30e相对表达量和5-LOX蛋白表达水平比较差异均有统计学意义(分别F=11.134和F=9.201,均P<0.01);与常氧组比较,OGDR组miR-30e和5-LOX表达水平明显升高(均P<0.05);与mim-miR-NC组比较,mim-miR-30e组miR-30e和5-LOX表达水平明显降低(均P<0.05);与inh-miR-NC组比较,inh-miR-30e组miR-30e和5-LOX表达水平明显升高(均P<0.05)。见图5。

a 与常氧组比较,P<0.05;b 与mim-miR-NC组比较,P<0.05;c 与inh-miR-NC组比较,P<0.05
2.6 miR-30e模拟物或抑制剂对OGDR损伤细胞的活力和凋亡的影响
8组细胞增殖活力和细胞凋亡率的比较差异均有统计学意义(分别F=10.012和F=15.003,均P<0.001);与常氧组比较,OGDR组细胞活力明显下降,而凋亡明显增加(均P<0.05);与mim-miR-NC组比较,mim-miR-30e组和mim-miR-30e+si-5-LOX组细胞活力明显升高,而凋亡明显减少(均P<0.05);与inh-miR-NC组比较,inh-miR-30e组细胞活力明显下降,而凋亡明显增加,inh-miR-30e+si-5-LOX组细胞活力明显升高,而凋亡明显减少(均P<0.05)。见图6。
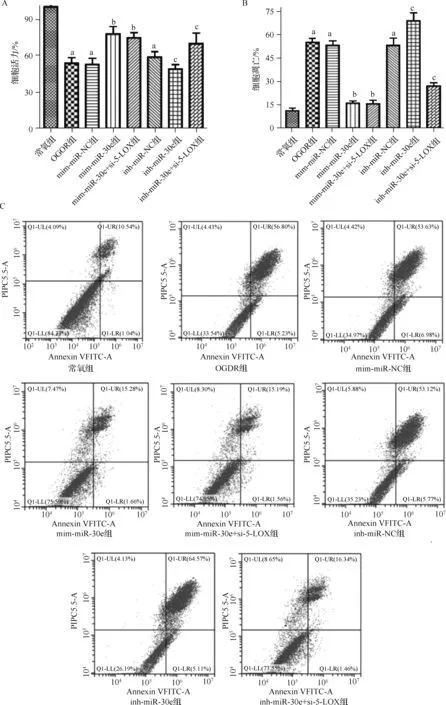
a 与常氧组比较,P<0.05;b 与mim-miR-NC组比较,P<0.05;c 与inh-miR-NC组比较,P<0.05
3 讨 论
越来越多的研究证实,miRNA在IR损伤中发挥重要作用[11]。miR-30e是miR-30家族的重要成员之一,与细胞增殖、分化、凋亡、自噬和细胞周期等有关,可参与癌症[12]、糖尿病[13]和心脏病[14]等疾病的发生和发展。本研究发现,miR-30e在大鼠脑IR损伤后皮质梗死周围区中显著升高,并且可能与神经炎症有关。神经炎症时脑IR损伤后常见的病理变化与神经功能缺损密切相关[15]。
miR-30e在炎症损伤中的作用机制尚未明确,可能通过NLRP3 炎症小体[2]、Janus激酶/信号转导与转录激活子信号通路[16]和Notch信号通路[17]等发挥作用。本研究采用生物信息学和双荧光素酶报告基因实验证实5-LOX是miR-30e的靶基因。5-LOX是白三烯生物合成的关键酶,与中枢神经系统炎症性疾病有关[5]。本研究中,脑IR损伤后5-LOX、CysLT和LTB4表达水平明显升高,miR-30e 激动剂明显降低了其表达,而miR-30e 拮抗剂又可以上调其表达,说明miR-30e在脑IR损伤中起到抗炎作用。本研究结果显示,miR-30e 激动剂可减轻脑IR损伤诱发的神经损伤,并缩小梗死面积,而miR-30e 拮抗剂可加重神经损伤,说明miR-30e有神经保护作用,本研究体外研究也予以证实。体外研究显示,miR-30e可以促进神经细胞活性并抑制细胞凋亡。
为了进一步证实miR-30e与5-LOX的关系,我们用siRNA下调PC12细胞中5-LOX的表达。研究发现,siRNA可以缓解miR-30e抑制剂对细胞的损伤,而miR-30e模拟物可以抵消这种作用。miR-30e抑制剂可以抵消miR-30e对5-LOX的抑制作用,加重细胞损伤。然而当用miR-30e 模拟物处理细胞时,虽然5-LOX表达明显下调,但是5-LOX-siRNA并不能降低5-LOX表达,说明5-LOX-siRNA并不能缓解miR-30e模拟物导致的PC12细胞损伤。以上结果说明,5-LOX是miR-30e下游的重要分子。
综上所述,miR-30e对大鼠脑IR损伤和OGDR细胞损伤具有神经保护作用,这种作用可能通过5-LOX进行介导。miR-30e可能是治疗脑IR损伤的潜在靶点。
