PLL-Ferumoxytol标记小鼠胰岛β细胞系MIN6的生物活性研究
2020-03-08SilvanySimoneSanchesTAVARES张淼祝晓阳顾宁
Silvany Simone Sanches TAVARES,张淼,祝晓阳,顾宁
(东南大学 生物科学与医学工程学院,生物电子学国家重点实验室,江苏省生物材料与器件重点实验室,江苏 南京 210009)
糖尿病是严重危害人类健康的慢性疾病。与传统治疗方法相比,胰岛移植技术可以更好地模拟生理性的胰岛素分泌,为患者提供了一种风险较小且疗效更好的替代疗法[1-2]。目前由于缺乏有效、无创伤的胰岛移植物监测技术,移植物移植入体内后难以在活体状态下评价细胞的分布、增殖和迁移等,也导致了胰岛移植效率及疗效不理想等问题[3],制约了胰岛细胞用于移植治疗糖尿病的临床应用。磁共振成像(magnetic resonance imaging,MRI)因其高空间分辨率、多方位成像而成为理想的移植细胞活体示踪手段。超顺磁性氧化铁纳米颗粒(superparamagnetic iron oxide nanoparticles,SPIONs) 是目前移植细胞示踪较为理想的标记物,尤其在干细胞移植领域的应用表现突出[4]。其优势为粒径小,弛豫率高,生物相容性和生物可降解性好,并且进入体内后可被细胞代谢。通过对细胞进行磁标记,国内外学者已经成功地进行了脑和心脏等部位磁标记干细胞的体外成像及活体示踪[5]。近期对微囊化胰岛β细胞移植的MRI示踪也成为新的研究热点[6]。另外研究发现,将SPIONs与正电荷转染剂多聚赖氨酸(poly-L-lysine,PLL)结合,使纳米粒子更容易穿越带负电荷的细胞膜进入细胞内,可以提高标记率且使MR显像更为敏感,并已证明其对细胞无毒性[7]。本课题组在生物医用磁性纳米材料的研究与应用方面已有多年的深厚积累,自制的超顺磁性氧化铁纳米粒子Ferumoxytol作为补铁剂与磁共振造影剂,其生物安全性超越其他研究所使用的磁性纳米颗粒[8],并且Ferumoxytol也是目前唯一获批可在临床上单独应用的SPIONs。本研究以Ferumoxytol作为对照,研究PLL修饰的Ferumoxytol体外标记小鼠胰岛β细胞系MIN6的可行性,对细胞的标记效率以及对细胞活力、增殖、胰岛素合成与分泌功能等的影响。
1 材料与方法
1.1 细胞培养
MIN6细胞由南京医科大学江苏省人类功能基因组学重点实验室提供,细胞用含20%牛血清(Gibco,南美)的DMEM高糖培养基(Sigma),于37 ℃、5%CO2环境下常规培养,待到70%~80%融合后以1∶2方式传代。
1.2 体外标记MIN6细胞
将MIN6细胞接种到培养板上,将制备的Ferumoxytol或PLL-Ferumoxytol分别以200、500和800 μg·ml-1的浓度加入培养基与细胞共孵育,分别培养24、48、72 h;同时设置正常培养组为对照。
1.3 细胞增殖和细胞活性检测
使用细胞增殖检测试剂盒(cell counting kit-8,CCK-8)进行细胞增殖分析。将MIN6细胞接种到96孔板中,生长24 h后替换成含200、500和800 μg·ml-1的Ferumoxytol或PLL-Ferumoxytol的新鲜培养基,分别孵育24、48、72 h后,将培养板用磷酸缓冲盐溶液(PBS)洗涤,添加10 μl CCK-8溶液后培养3 h,然后使用酶标仪测定450 nm处的吸光度。为了进一步分析细胞活性,进行LIVE/DEAD染色,待细胞融合达到70%~80%后,将其接种到24孔板中(每孔0.05×106个细胞),在24 h的培养时间内向培养基中加入不同浓度的纳米颗粒,用PBS洗涤细胞,并按照LIVE/DEAD试剂盒指示进行染色操作。
1.4 肌动蛋白纤维及细胞核染色
当融合达到70%~80%后,将细胞接种到96孔板中(每孔1.25×104个细胞),与含有不同浓度Ferumoxytol和PLL-Ferumoxytol的新鲜培养基共孵育24 h。吸弃PBS,加入3.7%甲醛固定30 min。PBS冲洗3次后,加FITC-鬼笔环肽(Alexa Fluor 488)孵育30 min,吸弃后用PBS洗3次。其中 Hoechst 33342被用作核染色的复染色。
1.5 Perl的普鲁士蓝染色法
将细胞接种到24孔板中(每孔5×104个细胞),与纳米颗粒(PLL-Ferumoxytol或Ferumoxytol)共培养24 h。24 h后去除培养基,PBS洗涤,并用4%甲醛固定。使用普鲁士蓝染色液进行染色测定以确定IONP的存在,最后观察细胞并使用显微镜(TS100/TS100-F,Nikon Co. Ltd.,日本) 进行成像。
1.6 透射电镜(TEM)观察
使用TEM观察MIN6细胞内部氧化铁纳米颗粒的存在。 MIN6细胞分别与Ferumoxytol和PLL-Ferumoxytol在200、500和800 μg·ml-1浓度下共培养24 h。PBS洗3次后,使用2.5%的戊二醛溶液在4 ℃环境下固定过夜。重复脱水后,将样品与环氧乙烷和环氧树脂共培养过夜,并用新鲜的环氧树脂渗透3次。用超薄切片机切片,通过醋酸铀水溶液和柠檬酸铅溶液进行双染色,用FEI Tecnai F30显微镜观察细胞并对其成像。
1.7 葡萄糖刺激下的胰岛素分泌试验(GSIS)
将细胞与不同浓度的Ferumoxytol和PLL-Feru-moxytol分别共孵育24、48、72 h后,接种到48孔板中(每孔1.25×104个细胞)。将细胞置于含2 mmol·L-1葡萄糖的Krebs-Ringer碳酸氢盐缓冲液(KRBH:125 mmol·L-1NaCl、1.2 mmol·L-1MgSO4、1.2 mmol·L-1CaCl2、22 mmol·L-1NaHCO3、10 mmol·L-1HEPES、1.19 mmol·L-1KH2PO4)溶液中1 h,然后换成含20 mmol·L-1葡萄糖的KRBH 溶液中反应1 h。分别收取上清液,用ELISA试剂盒测定其中胰岛素浓度,以检测细胞的胰岛素分泌功能。
1.8 统计学处理
所有数据均以均数±标准差表示,应用GraphPad Prism 8软件进行分析,两组间比较采用双因素方差分析,多组间比较采用Dunnett-t检验法。P<0.05 认为差异具有统计学意义。
2 结 果
2.1 MIN6细胞形态评估
使用相差显微镜评估纳米颗粒存在情况下的细胞形态变化。结果(图1)显示,与Ferumoxytol或PLL-Ferumoxytol共培养的细胞形态无明显变化。为了更好地了解纳米颗粒对MIN6细胞形态的影响,我们单独测试了不同浓度PLL的细胞毒性,发现较高浓度(19 μg·ml-1)的PLL对细胞具有明显毒性。

图1 MIN6细胞形貌表征 对照组、800 μg·ml-1 Ferumoxytol和PLL-Ferumoxytol标记MIN6细胞24 h后的细胞形态
2.2 细胞增殖和细胞活力检测结果
将细胞暴露于不同浓度(200、500和800 μg·ml-1)的Ferumoxytol中,通过CCK-8法和LIVE/DEAD细胞染色测定法检测细胞增殖和细胞活力。CCK-8检测结果显示,与对照细胞相比,与Ferumoxytol、PLL-Ferumoxytol共孵育24、48、72 h后,对细胞增殖没有显著影响(图2)。并且LIVE/DEAD染色结果(图3)显示,对照组与实验组(Ferumoxytol和PLL-Ferumoxytol组)细胞均保持了较高的活性,而纯PLL(浓度分别为2、11、19 μg·ml-1)则会抑制细胞增殖和生存。因此,我们认为本研究中使用的Ferumoxytol和PLL-Ferumoxytol具有良好的生物相容性。

图2 MIN6细胞增殖检测 CCK-8法检测与纳米粒子共孵育24、48、72 h后对MIN6细胞增殖的影响。n=9,细胞与200 μg·ml-1 PLL-Ferumoxytol共孵育24 h后,细胞增殖率高于对照组(a P<0.05)
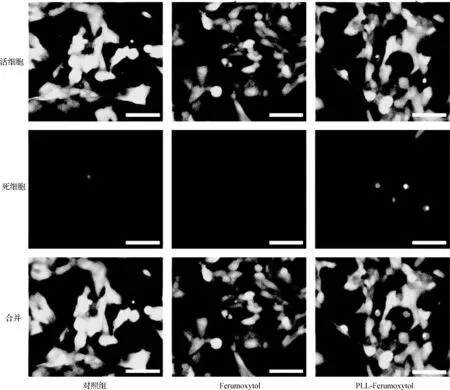
图3 MIN6细胞活性表征 与Ferumoxytol、PLL-Ferumoxytol(800 μg·ml-1)共培养24 h后的细胞活性分析,染绿色为活细胞,染红色为死细胞(标尺:50 μm)
2.3 F-肌动蛋白丝和细胞核染色
与对照组相比,纳米颗粒处理的细胞进行鬼笔环肽染色后,未显示出其F-肌动蛋白细胞骨架特性具有显著差异。因此我们认为,纳米颗粒可以保护并帮助维持MIN6细胞的结构。用Hoechst 33342染色法观察纳米颗粒处理后细胞的核形态变化和核浓缩,结果(图4)显示,核呈圆形,无核浓缩,表明没有凋亡细胞。
2.4 细胞摄取和普鲁士蓝染色
将MIN6细胞与Ferumoxytol和PLL-Ferumoxytol(浓度分别为200、500、800 μg·ml-1)共孵育24 h,对细胞进行普鲁士蓝染色(图5A)检验细胞的铁摄取。结果显示,与PLL-Ferumoxytol共培养的细胞被染成蓝色,而与Ferumoxytol共培养的细胞则没有表现出对铁纳米粒子的摄取,说明仅与Ferumoxytol共孵育24 h不足以标记细胞。此外,TEM观察结果证实,MIN6细胞内部存在氧化铁纳米颗粒。 在不同的细胞结构中都能发现纳米颗粒,主要在溶酶体中观察到较多纳米颗粒,其余能够观察到纳米颗粒附着在细胞膜上或被困在细胞之间(图5B、C、D)。
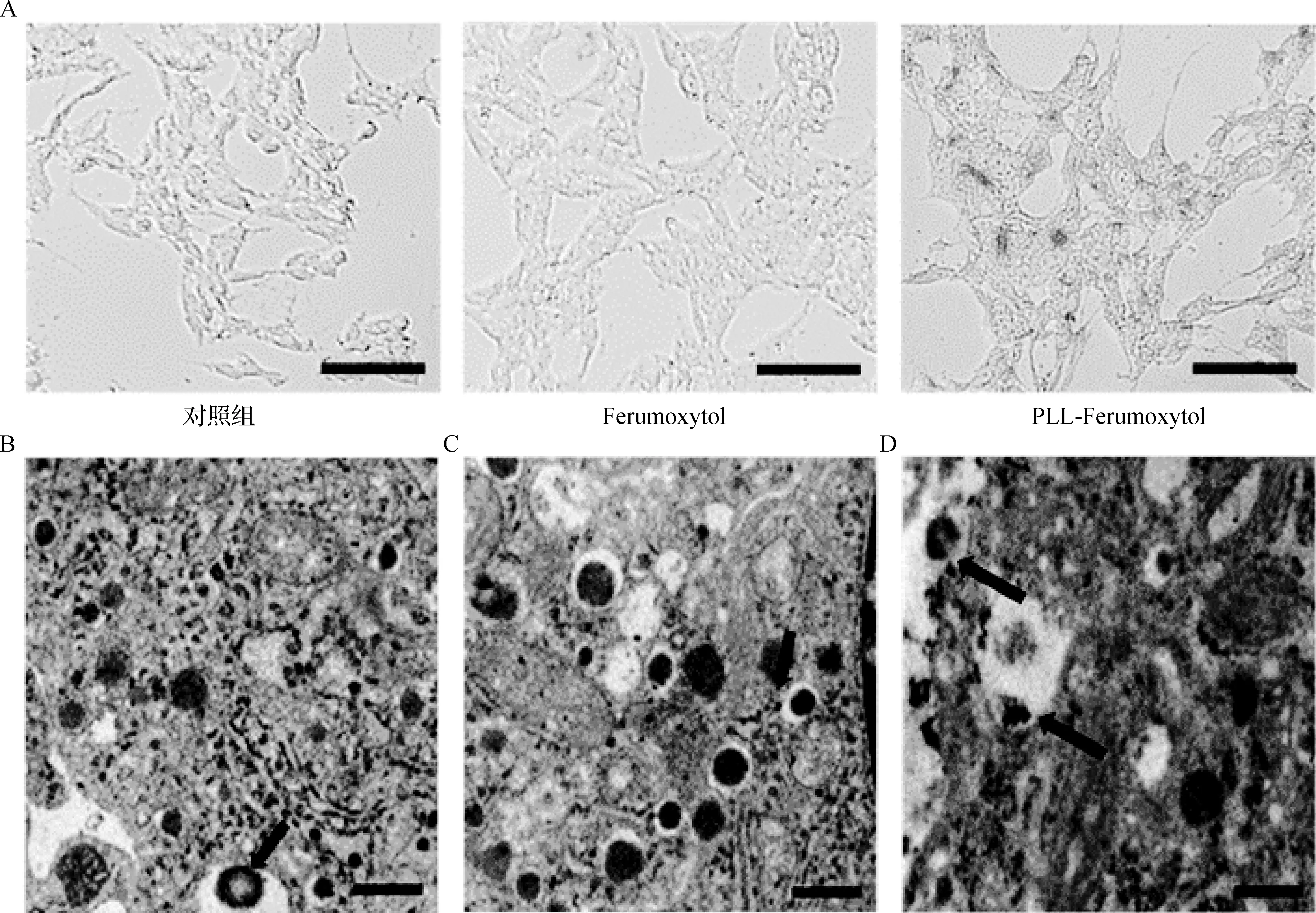
图5 普鲁士蓝染色及TEM表征 将MIN6细胞分别与Ferumoxytol和PLL-Ferumoxytol(800 μg·ml-1)在24孔中共培养24 h,然后用Perl的普鲁士蓝染色法进行染色 (标尺:50 μm),孵育24 h后,MIN6细胞的TEM图像(A);箭头指向含有纳米颗粒的溶酶体(B)、胰岛素囊泡(C)及附着在细胞膜和溶酶体上的纳米颗粒(D)(标尺:0.5 μm)
2.5 GSIS结果分析
分别培养24、48、72 h后,通过在低糖基础条件(2 mmol·L-1)和高糖刺激条件(20 mmol·L-1)下培养样品,研究响应葡萄糖刺激的MIN6细胞胰岛素分泌。结果表明,在刺激性高浓度葡萄糖条件下,与200 μg·ml-1PLL-Ferumoxytol共培养的细胞释放的胰岛素量显著增加(P<0.05,图6A)。并且涂覆PLL和未涂覆PLL的纳米颗粒处理的细胞之间胰岛素合成量没有显著差异(图6B)。上述结果表明,与纳米颗粒共培养后,MIN6细胞仍然对葡萄糖具有响应性。
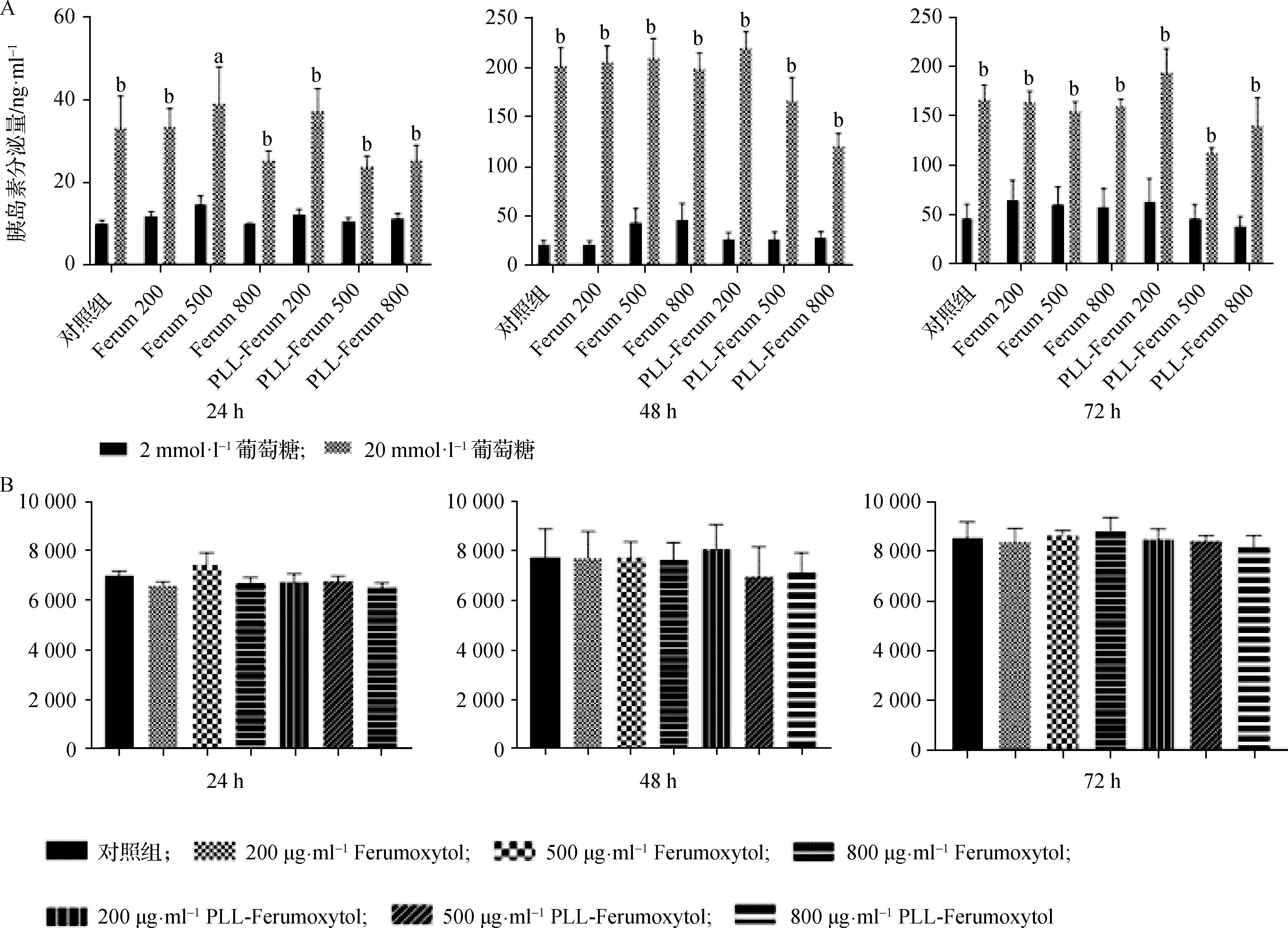
图6 GSIS及合成量检测 分别与200、500、800 μg·ml-1 Ferumoxytol和PLL-Ferumoxytol共孵育24、48、72 h 后,对MIN6细胞进行GSIS和胰岛素抽提实验,低糖及高糖处理组胰岛素分泌量(A)及胰岛素合成量(B)比较(n=9),高糖(20 mmol·L-1)处理组胰岛素分泌量高于低糖(2 mmol·L-1)处理组(a P<0.05;b P<0.01)
3 讨 论
目前,糖尿病的传统治疗方案主要为终身注射胰岛素以及服用口服降糖药物,但是由于血糖水平难以控制,胰岛素剂量或者药物使用不当,不能完全达到理想的治疗效果[9]。胰岛移植技术为患者提供了一种风险较小且疗效更好的替代疗法。对移植物进行有效、无创的活体示踪是胰岛移植成功的保障。在胰岛中,胰岛β细胞是已知的产生胰岛素的唯一内分泌细胞,胰岛β细胞功能障碍甚至被认为是糖尿病发生的根本原因[10]。因此,本研究中我们将MIN6细胞与Ferumoxytol纳米颗粒共培养,然后评估纳米颗粒与细胞之间的相互作用,并对细胞增殖和细胞活性进行检测。研究发现,应用PLL作为转染剂介导并增强了PLL-Ferumoxytol对MIN6细胞的标记效率。实验结果表明,PLL-Ferumoxytol具有良好的生物相容性。通常,纳米颗粒在不同类型细胞中的内化具有时间依赖性,并且达到最大饱和点时摄取会趋于平稳,进行纳米颗粒摄取后细胞的活力预计也会随着时间而降低[11]。已有研究说明SPIO标记对人骨髓间充质干细胞(BMSC)的功能作用,并表明带有或不带有TA的SPIO标记不会显著影响充质干细胞(MSC)的分化或活性[12]。
肌动蛋白的细胞骨架是一种动态结构,会根据响应信号的变化而被重塑。在胰岛β细胞中,F-肌动蛋白排列为质膜下的致密网络结构,当葡萄糖刺激胰岛素分泌后,其迅速解聚[13]。细胞骨架结构中的F-肌动蛋白丝是调节和维持细胞形态完整性的必要因素,因此,任何结构上的破坏都可能导致细胞骨架蛋白表达的改变。基因芯片分析显示,人类原代成纤维细胞暴露于氧化铁纳米颗粒48 h后,可以上调与肌动蛋白重塑相关基因的表达[14]。此外,氧化铁纳米颗粒也被报道可以促进细胞信号相关基因(包括整联蛋白亚基、酪氨酸激酶和蛋白激酶C家族成员)的表达增加,表明氧化铁纳米颗粒也可以影响信号转导途径[15]。与对照组相比,将氧化铁纳米颗粒处理的细胞F-肌动蛋白丝染色后,其F-肌动蛋白细胞骨架没有显着差异。但是,PLL会对细胞相互作用有关的基因下调产生某些影响,从而影响细胞的运动,因此必须对显著增加的细胞外基质蛋白进行定量以确定其基质的重组。
用不同浓度的纳米颗粒处理细胞后,细胞对PLL-Ferumoxytol内吞表明纳米颗粒可能与分泌胰岛素的囊泡有一些相互作用。典型的普鲁士蓝染色能够证明铁在β细胞以及其他类型细胞中的堆积,铁的吸收主要与几种类型细胞的内吞作用有关。最近有文献报道,商业化的Resovist(羧基葡聚糖包被的SPION)处理胰岛细胞可以作为MRI造影剂。纳米粒子标记对MIN6细胞的胰岛素合成与分泌功能无显著影响,证明了其良好的生物安全性[16]。铁的超负荷可能影响胰岛素的分泌,葡萄糖转运蛋白4(GLUT4)的表达水平对促进葡萄糖扩散很重要[13]。摄取铁氧化物纳米颗粒的主要机制是内吞作用,而胰岛素则通过胞吐作用分泌[17],因此可以猜测胰岛素分泌也可能会受纳米颗粒的代谢与胰岛素囊泡之间的相互作用影响,这需要进一步进行研究。
SPIONs作为较为理想的细胞磁标记物,在对移植物的移植后活体示踪领域具有广阔的应用前景。本研究中将PLL与Ferumoxytol结合,制备的PLL-Ferumoxytol具有良好的生物相容性及生物安全性,对于MIN6细胞的形貌、活性、增殖和胰岛素合成与分泌功能没有显著影响,并且相较单纯的Ferumoxytol具有更高的细胞标记率。
