涎腺肿瘤、牙源性肿瘤中WT-1的表达
2020-03-05吴倩文曹渝珊吕新全
吴倩文,祝 昊,曹渝珊,吕新全
头颈部肿瘤中涎腺肿瘤及牙源性肿瘤占比较大[1],肿瘤性肌上皮细胞在多种涎腺肿瘤中增生活跃,导致涎腺肿瘤的复杂多样性[1-2]。牙源性肿瘤可分为3类:上皮来源、间充质/外胚层间充质来源和混合型[1,3]。涎腺肿瘤与牙源性肿瘤种类繁多,形态类似,临床病理诊断及鉴别诊断较为困难,因此寻找特异性免疫组化指标具有重要价值。WT-1首次以抑癌基因从胎儿肾母细胞瘤中分离,是一种与细胞凋亡相关的抑制基因[4-5]。近年相关研究显示WT-1具有癌基因的作用[6],恶性肿瘤中缺氧诱导因子或原癌基因均可激活WT-1的转录,引发细胞凋亡受阻[7]。本文采用免疫组化SP法检测WT-1在涎腺肿瘤和牙源性肿瘤中的表达,探讨WT-1在两者中的相关性及临床意义。
1 材料与方法
1.1 材料收集2011~2016年郑州大学第一附属医院确诊的涎腺肿瘤141例及牙源性肿瘤84例;所有标本均由两名经验丰富的病理医师分别阅片后共同诊断,其中包括多形性腺瘤(pleomorphic adenoma, PA)28例、基底细胞腺瘤(basal cell adenoma,BCA)29例、癌在多形性腺瘤中(carcinoma ex pleomorphic adenoma, CXPA)26例、腺样囊性癌(adenoid cystic carcinoma, ACC)30例、腺泡细胞癌(acinic cell carcinoma, Aci CC)28例、成釉细胞瘤(ameloblastoma, AME)30例、牙源性腺样瘤(adenomatoid odontogenic tumor, AOT)13例,牙源性角化囊肿(odontogenic keratocyst, OKC)30例,成釉细胞癌(ameloblastic carcinoma, AC)11例(表1)。

表1 涎腺肿瘤及牙源性肿瘤的临床病理资料
PA.多形性腺瘤;BCA.基底细胞腺瘤;CXPA.癌在多形性腺瘤中;ACC.腺样囊性癌;Aci CC.腺泡细胞癌;AME.成釉细胞瘤;OKC.牙源性角化囊肿;AOT.牙源性腺样瘤;AC.成釉细胞癌
1.2 方法所有标本均经10%中性福尔马林固定,石蜡包埋,3μm 厚连续切片,行HE及免疫组化SP法染色。
1.3 结果判定以已知阳性切片作为阳性对照,用PBS缓冲液代替一抗作为阴性对照。WT-1以胞质呈棕黄色颗粒为阳性细胞。镜下观察切片内无阳性细胞或阳性细胞数<10%为阴性(-),阳性细胞数>10%为阳性(+)。
1.4 统计学分析采用SPSS 23.0软件进行统计学分析,分析比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 正常涎腺组织中WT-1的表达正常涎腺组织中,导管细胞的WT-1呈弥漫胞质阳性(图1),少许腺泡细胞及肌上皮细胞中WT-1可呈阳性(图2)。
2.2 涎腺肿瘤及牙源性肿瘤中WT-1表达的相关性涎腺肿瘤中WT-1呈胞质阳性;牙源性肿瘤中WT-1偶可阳性。WT-1在涎腺肿瘤PA、BCA、CXPA、ACC、Aci CC中阳性率分别为92.86%(26/28)、75.86%(22/29)、69.23%(18/26)、53.33%(16/30)、46.43%(13/28)(图3~7)。在牙源性肿瘤AME、AOT、OKC、AC中阳性率分别为13.33%(4/30)、7.69%(1/13)、0(0/30)、0(0/11)。WT-1在上述肿瘤中的表达差异有统计学意义(P<0.001)。WT-1在涎腺肿瘤和牙源性肿瘤中的表达:涎腺肿瘤中的阳性率为67.37%(95/141),牙源性肿瘤中的阳性率为5.95%(5/84),WT-1在涎腺肿瘤中的阳性率明显高于牙源性肿瘤,差异有统计学意义(P<0.001,表2)。另外,本实验发现WT-1可在肿瘤组织的血管内皮细胞中表达(图8)。
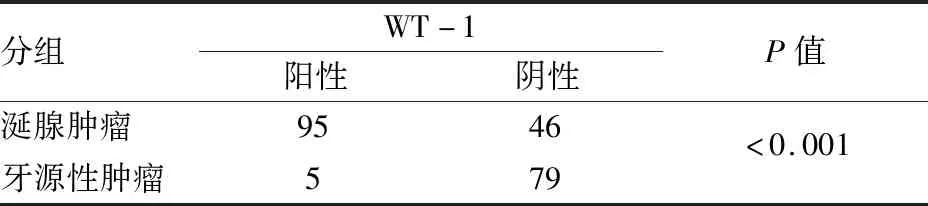
表2 涎腺肿瘤及牙源性肿瘤中WT-1表达的相关性
3 讨论
涎腺中有上皮细胞-间充质转化(epithelial-mesenchymal transdifferentiation,EMT)[5,8],WT-1参与间充质-上皮细胞转化(mesenchymal-epithelial transdifferentiation, MET)和EMT的过程,显示上皮-肌上皮细胞分化,可能与肿瘤的发生、发展相关[9-10]。肌上皮细胞分化的多样性是涎腺肿瘤分类及鉴别的重点,寻找相关肌上皮细胞标志物十分关键。文献报道,翻译后磷酸化的过程会导致WT-1蛋白在肿瘤细胞质与细胞核中移动,使WT-1在肿瘤中呈细胞质弥漫颗粒状阳性[5,8-9,11]。
PA属于良性肿瘤,具有多样的肌上皮细胞分化。Langman等[5]提出WT-1是PA中有效的肿瘤性肌上皮细胞标志物[10-11]。另外,WT-1阳性细胞可能经历MET与EMT的过程[5,9-11]。WT-1被认为是MET的诱导因子,可能参与涎腺肿瘤的分化及形成[8]。WT-1影响EMT的过程与其在肿瘤性肌上皮细胞中的表达并不排斥,因为经历EMT的肿瘤细胞会失去细胞间凝聚和肌纤维的细胞质积聚,这可能是形成肿瘤性肌上皮细胞的因素之一[5,9,11]。CXPA是来自PA的恶性上皮性肿瘤,良恶性成分的比例变化大[1],本实验WT-1阳性病例中,癌变部分多为肌上皮癌或上皮-肌上皮癌,有大量肿瘤性肌上皮细胞。文献报道,β-catenin基因的突变与PA的生成及癌变有密切关系[12],活化的β-catenin基因可促使细胞进入早期EMT过程[9],WT-1、β-catenin基因、EMT三者之间存在紧密联系[2,9],β-catenin基因在许多癌组织中被激活,具有致癌作用[12]。BCA中存在基底样肌上皮细胞和少量导管细胞[1],并具有β-catenin的免疫表达及基因突变[13],肿瘤性肌上皮细胞的分化及β-catenin基因的异常表达可以解释WT-1的表达。ACC是由导管上皮及肌上皮细胞构成的肿瘤,不同个体中,两种细胞比例不同,多由形态较为一致的肿瘤性肌上皮细胞构成。β-catenin基因在部分ACC中呈弱表达[1,11]。涎腺肿瘤中,WT-1的表达与β-catenin基因的活化可能有部分重叠[9]。β-catenin在Aci CC中存在异常表达[12],且Aci CC偶尔可见肌上皮分化[1]。β-catenin基因的活化或部分分化的肌上皮细胞可能是导致WT-1在该肿瘤中稍低表达的原因,在诊断中具有一定参考性[11]。
图1WT-1在正常涎腺组织的导管细胞中呈细胞质阳性,SP法图2WT-1在正常涎腺组织的少许腺泡细胞及肌上皮细胞中呈阳性,SP法图3WT-1在PA中呈阳性,SP法图4WT-1在BCA中呈阳性,SP法图5WT-1在CXPA中呈阳性,该例癌变类型为肌上皮癌,SP法图6WT-1在ACC筛状结构的肿瘤细胞中呈阳性,SP法图7WT-1在Aci CC中呈阳性,SP法图8WT-1在肿瘤组织内血管内皮细胞中呈阳性,SP法
牙源性肿瘤来源于成牙器官或其残余上皮、外胚间充质和(或)间充质成分[1,3],不具有肿瘤性肌上皮的分化,也不参与MET与EMT过程,WT-1在牙源性肿瘤中偶有表达,可能是外界因素所致。
另外,WT-1在肿瘤血管内皮细胞中表达[6,11,14]。文献报道[6,10,15]WT-1可以调节一组促进血管增生的基因表达,如血管内皮生长因子、血栓素A2、血管生成素等,提示WT-1可能是肿瘤血管生成的关键调节因素。
综上所述,WT-1在涎腺正常组织中主要表达于导管细胞,肌上皮细胞较少表达。WT-1在涎腺肿瘤中多表达于肿瘤性肌上皮细胞,导管细胞中少见表达,在牙源性肿瘤中不表达或偶表达。WT-1有望成为鉴别涎腺肿瘤与牙源性肿瘤的免疫组化标志物。
