γ-分泌酶抑制剂阻断LPA诱导的胃癌细胞SGC-7901侵袭迁移
2020-03-05任志恒张晨丽史淑霞徐金宇王斌生
任志恒,张晨丽,张 晓,史淑霞,徐金宇,张 煦,胡 燕,王斌生
胃癌是消化道常见的恶性肿瘤[1-2],治疗以手术和放、化疗为主,但对已发生远处转移的胃癌患者疗效不佳[3]。因此,寻找新的胃癌靶向药物成为亟待解决的问题。溶血磷脂酸(lysophosphatidic acid, LPA)属于小分子甘油磷脂,可调控肝细胞癌、卵巢癌等多种恶性肿瘤的侵袭迁移[4-5]。LPA受体分为6个亚型:LPA1~6[6],其中LPA2研究较为广泛,与多种恶性肿瘤的病理学分期、分级及患者的不良预后相关[7-9]。Notch信号通路在多种肿瘤的发生、发展中起重要作用,该通路由Nocth1~4受体组成,与其配体结合后经γ-分泌酶酶切,释放其胞外域及胞内域ICN,并与CSL蛋白结合使之活化,进一步激活下游靶基因(如Hes-1)的转录[10]。γ-分泌酶抑制剂可阻断Notch通路的活化,文献报道[11-12]γ-分泌酶抑制剂联合其他天然化合物,对治疗HER-2阳性乳腺癌患者具有良好的前景。本文着重探讨γ-分泌酶抑制剂是否能阻断LPA诱导的胃癌细胞SGC-7901侵袭迁移,为胃癌临床治疗提供新的理论依据。
1 材料与方法
1.1 细胞培养人胃癌细胞株SGC-7901由本实验室长期保存。细胞培养于含1%的青霉素/链霉素混合液(Sigma)和10%的胎牛血清(BI)的RPMI 1640培养基(Hyclon)中,置于37 ℃、5% CO2的培养箱中培养。每2~3天使用胰蛋白酶-EDTA(0.25%)(Hyclon)消化并传代。
1.2 主要试剂及材料MTS试剂盒(Promega),Transwell小室(Corning),Matrigel胶(BD),一抗稀释液、DAPI、FITC标记的鬼笔环肽(Solarbio),人源LPA2(EDG4)抗体(Abcam),Notch1、Hes-1、E-cadherin、vimentin抗体(CST),β-actin抗体(Thermo),二抗(Santa Cruz),LPA(Sigma),MK-0752(Selleck)。
1.3 Western blot 检测取对数生长期的SGC-7901细胞,接种于6孔板中,待细胞生长至70%~80%融合度时,实验组细胞使用5 μmol/L MK-0752预处理24 h,然后在刺激组细胞中加入15 μmol/L LPA刺激细胞24 h,处理样品,加入1×SDS蛋白上样缓冲液进行SDS-PAGE,并转移至NC膜,用5%脱脂奶粉封闭2 h,以LPA2(1 ∶1 000)、Notch1(1 ∶1 000)、Hes-1(1 ∶1 000)、E-cadherin(1 ∶1 000)、vimentin(1 ∶1 000)、F-actin(1 ∶1 000)和β-actin(1 ∶5 000)一抗4 ℃孵育过夜,二抗(1 ∶5 000)孵育2 h,最后用ECL化学发光工作液曝光、拍照。
1.4 Transwell侵袭迁移实验
1.4.1Transwell迁移实验 实验组细胞使用MK-0752预处理24 h后,将孔径为0.8 μm的Transwell小室置入24孔板中,收集各组细胞,用PBS洗涤并用无血清培养基重悬细胞,将细胞浓度调整每孔为2×105个细胞,然后在小室上腔加入200 μL的细胞悬液,小室下腔加入700 μL的含15 μmol/L LPA或完全培养基,培养箱培养24 h后取出小室,经4%多聚甲醛固定,0.1%结晶紫染色,在显微镜下计数细胞。
1.4.2Transwell侵袭实验 实验组细胞使用MK-0752预处理24 h后,稀释Matrigel基质胶(Matrigel基质胶 ∶预冷的无血清培养基=1 ∶8),并充分混匀。在Transwell小室上腔中加入100 μL以覆盖整个碳酸酯膜。后续操作同迁移实验。
1.5 细胞活力检测使用MTS测定5 μmol/L MK-0752、15 μmol/L LPA是否对细胞活力造成影响。实验前将MTS Cell Titer96 AQueous One Solution Reagent 37 ℃水浴10 min,直接加入96孔板,37 ℃、5% CO2环境中孵育2.5 h,然后酶标仪读取490 nm处的吸光度值(OD值),记录结果,用以下公式计算细胞活力:细胞活力(%)=(A实验-A空白)/(A对照-A空白)×100%。
1.6 间接免疫荧光共聚焦检测实验组细胞预先用5 μmol/L MK-0752预处理,待其生长至70%~80%融合度后,以每孔2×104个细胞接种于Nunc玻璃小皿中,加入15 μmol/L LPA或完全培养基,24 h后收样,PBS洗涤细胞,经4%多聚甲醛固定,使用FITC标记的鬼笔环肽染细胞骨架,4 ℃避光过夜;使用DAPI染细胞核,最后使用激光共聚焦显微镜观察,并拍照保存图片。
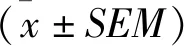
2 结果
2.1 MK-0752对LPA诱导LPA2、Notch1、Hes-1表达的影响实验组细胞预先使用5 μmol/L MK-0752处理24 h;在刺激组中加入15 μmol/L LPA培养 24 h,Western blot结果显示:在使用MK-0752预处理的细胞中,LPA2、Notch1、Hes-1的表达比空白对照组低,且预处理组在使用LPA刺激后目的分子表达比空白刺激组低。MTS实验检测在5 μmol/L MK-0752和15 μmol/L LPA作用下的细胞活力,结果表明:所用药物浓度并未对细胞活力造成影响,因此选择该浓度为后续实验中的药物浓度(图1)。
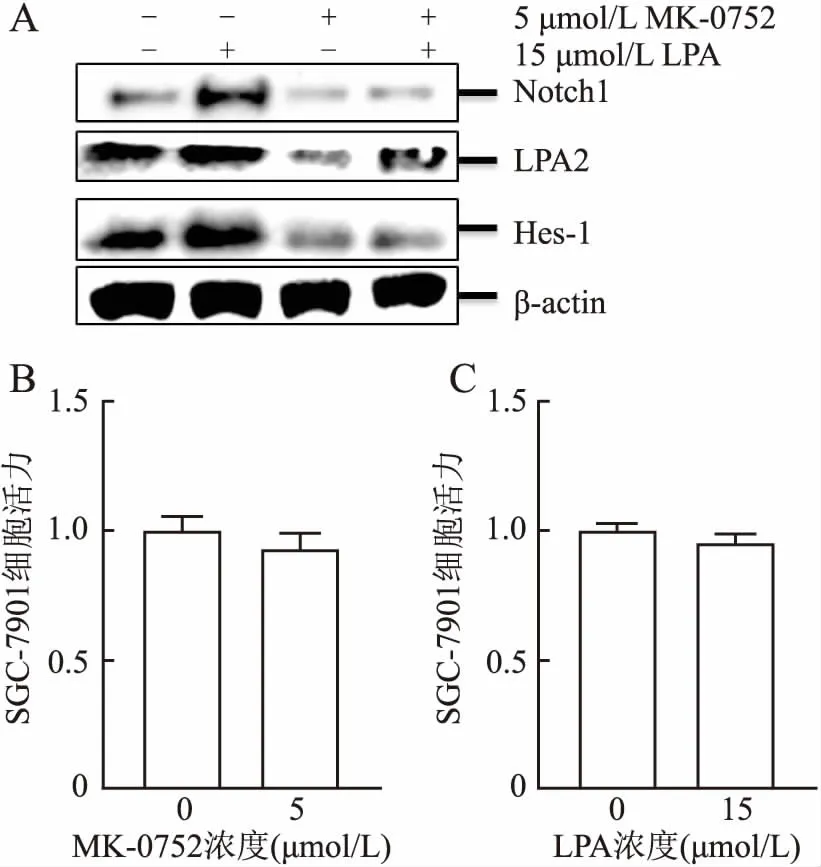
图1 A.Western blot检测四组细胞中LPA2、Notch1、Hes-1的表达;B.MTS检测MK-0752浓度对细胞活力的影响;C.MTS检测LPA浓度对细胞活力的影响
2.2 MK-0752对LPA诱导SGC-7901细胞侵袭迁移的影响Transwell侵袭迁移实验表明:使用MK-0752预处理的SGC-7901细胞中穿膜细胞数比空白对照组低(P<0.01);在下室加入15 μmol/L的LPA后,空白刺激组的穿膜细胞数比实验组增多(P<0.01)。实验结果显示:MK-0752可抑制由LPA诱导的胃癌细胞SGC-7901侵袭迁移(图2)。

图2 A.Transwell迁移实验检测四组细胞的迁移能力;B.Transwell侵袭实验检测四组细胞的侵袭能力;P均<0.01,LPA(-):空白对照组;LPA(+):空白刺激组;MK-0752(-):实验组;MK-0752(+):实验刺激组
2.3 MK-0752对LPA诱导SGC-7901细胞EMT的影响采用Western blot检测MK-0752预处理细胞后,使用LPA刺激细胞中E-cadherin、vimentin的表达。实验组细胞中E-cadherin表达比处理后刺激组明显增多;vimentin的表达趋势则与之相反。以上结果提示:MK-0752是通过抑制由LPA诱导的SGC-7901细胞发生EMT过程,进而抑制细胞发生侵袭迁移(图3)。

图3 Western blot检测四组细胞中E-cadherin、vimentin的表达
2.4 MK-0752对LPA诱导SGC-7901细胞形态学的影响采用间接免疫荧光共聚焦观察四组细胞的细胞骨架:空白刺激组的细胞细胞形态由椭圆形变为不规则形,细胞表面丝状物增多(细胞骨架蛋白增多),细胞周围凸起增多(伪足形成);实验组细胞中加入LPA后,细胞形态未见明显改变。结果显示:MK-0752可抑制由LPA引起的SGC-7901细胞形态学改变,阻止细胞形成伪足,进而抑制细胞运动(图4)。
3 讨论
胃癌是常见的消化道肿瘤,因缺乏早期诊断及侵袭迁移能力较强,其预后较差[13]。因此,寻求胃癌治疗的新思路一直备受专家、学者们的关注。
LPA和LPA2结合后可在人体的正常生理及病理中发挥不同作用,正常时两者结合后,通过G蛋白偶联信号通路可促进细胞有丝分裂、加速伤口愈合[14];异常时两者结合可加速乳腺癌、肝癌、卵巢癌细胞侵袭迁移,且在卵巢恶性上皮性肿瘤中,LPA2的高表达与患者组织学分级、临床分期、淋巴结转移及腹水形成量呈正相关;LPA可刺激胃癌细胞增殖并使其恶性程度增高。我们前期研究发现LPA2可促进胃腺癌细胞SGC-7901的抗凋亡、促侵袭和迁移能力[15],且在SGC-7901细胞中有两种跨膜蛋白LPA2和Notch1的协同作用,在LPA的刺激下该作用被放大,以增强胃癌细胞恶性程度[16]。

图4A.间接免疫荧光共聚焦观察空白组、实验组细胞的形态学变化;B.间接免疫荧光共聚焦观察空白刺激组、实验刺激组细胞的形态学变化
Notch1作为Notch通路中的关键分子,与非小细胞肺癌、直肠癌患者的病理学分期及预后密切相关[17-18]。Notch1高表达可增强肾透明细胞癌、结肠细胞的侵袭迁移能力[19-20]。本实验使用Notch通路阻断剂—— γ-分泌酶抑制剂,首次发现MK-0752可抑制由LPA诱导的胃癌细胞SGC-7901中LPA2和Notch信号通路相关分子的表达。
肿瘤从原位癌发展呈浸润癌需要EMT过程,这是恶性肿瘤细胞发生侵袭迁移的前提。在此过程中,癌细胞失去上皮标志物E-cadherin的表达,使细胞连接松散易于运动,而间叶标志物vimentin表达增加,有利于细胞维持形态及运动[21]。本实验结果表明:在LPA刺激下胃癌细胞SGC-7901中E-cadherin表达降低,vimentin表达增加;该作用可在使用MK-0752处理的细胞中逆转,提示γ-分泌酶抑制剂可阻断由LPA诱导的SGC-7901细胞EMT过程。
EMT过程中伴细胞形态学改变,细胞由原来的规则形态变为利于其运动迁移的不规则形态,在此过程中细胞骨架蛋白发生重构,细胞伪足形成[22-23]。本组发现,在LPA刺激下SGC-7901细胞形态明显发生改变,但在MK-0752处理的细胞中未见明显改变;提示γ-分泌酶抑制剂可以抑制由LPA诱导的SGC-7901细胞形态学改变。
近年γ-分泌酶抑制剂在恶性肿瘤治疗的研究中较为广泛,可通过阻断Notch通路抑制人卵巢癌细胞SKOV3增殖并促进其凋亡;卢余莉等[24-25]研究发现,在肿瘤的药物治疗中γ-分泌酶抑制剂与其他传统化疗药物有明显不同。本组结果提示γ-分泌酶抑制可抑制由致瘤因子LPA引起的胃癌细胞恶性生物学行为,将Notch信号通路与LPA、LPA2轴联系在一起。
综上所述,本实验仅从体外细胞学实验中初步探讨γ-分泌酶抑制剂对胃癌细胞的抑制作用,可作为分析胃癌新治疗方法的实验与理论提供基础;其具体作用机制还需进行动物学实验及相关分子生物学实验分析,以期为胃癌耐药患者提供更好的药物治疗方案。
