虎杖苷改善氧化应激介导的肺泡上皮细胞线粒体损伤的机制
2020-03-02曹媛媛李桂成邓加雄李云峰段智
曹媛媛,李桂成,邓加雄,李云峰,段智
(湖南省郴州市第一人民医院重症医学科,郴州 423000)
急性肺损伤(acute lung injury,ALI)是脓毒症的常见并发症,但因其缺乏有效的治疗手段,在临床上具有较高的病死率。研究证实,肺泡上皮线粒体损伤是ALI的重要发病机制,因此维护线粒体稳定可以显著改善ALI[1]。线粒体自噬是指细胞通过选择性自噬清除受损或功能紊乱的线粒体以维持正常线粒体质量或功能[2,3]的现象,该作用已在心血管、神经系统等方面的疾病中被证实[4-6],但在肺泡上皮细胞损伤中的作用研究较为鲜见。在本研究中我们通过H2O2的氧化应激作用介导肺泡上皮损伤细胞模型,探讨虎杖苷是否通过上调线粒体自噬减轻肺泡上皮线粒体损伤,从而阐述线粒体自噬在ALI发病中的重要作用,为临床治疗ALI寻找可能靶点。
1 材料与方法
1.1 主要试剂
荧光素-荧光素酶试剂盒购于美国Promega公司;膜电位JC-1探针及钙黄绿素-氯化钴购自美国Sigma公司;DCFH-DA活性氧(reactive oxygen species,ROS)荧光探针购自上海碧云天公司;细胞计数试剂盒 (cell count kit-8,CCK-8)购自上海Dojindo公司;线粒体膜蛋白[线粒体外膜转位酶(translocase of outer mitochondrial membrane 20,TOM20)和线粒体内膜转位酶(translocase of inner mitochondrial membrane 23,TIM23)],及线粒体生成调节因子[线粒体转录因子(mitochondrial transcription factor A,mTFA)和过氧化物酶体增殖物激活受体γ共激活因子1α(peroxisome proliferator-activated receptor-gamma coactivator-1α, PGC-1α)]单克隆抗体、3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)及辣根过氧化物酶标记的二抗购自武汉ABclonal公司;mt-Keima-COX8慢病毒滴度液购于南京PPL公司;A549细胞购自广州赛库生物公司。
1.2 分组及处理
将A549细胞分为4组(n=6):对照组细胞仅接受0.1%浓度的DMSO处理60 min;模型组细胞同等浓度DMSO预处理30 min后予以H2O2250 μmol/L刺激30 min[7];治疗组细胞接受虎杖苷50 μmol/L[3]预处理30 min后予以H2O2250 μmol/L刺激30 min;抑制剂组细胞接受线粒体自噬抑制剂mdivi-1 10 μmol/L[3]及虎杖苷50 μmol/L预处理30 min后予以H2O2250 μmol/L刺激30 min。
1.3 线粒体自噬水平检测
(1)通过Western blotting检测TOM20(1∶2 000)、TIM23(1∶2 000)、mTFA(1∶1 000)、PGC-1α(1∶1 000)表达水平。细胞充分裂解,凝胶电泳后转膜,免疫化学发光法曝光并进行灰度值分析。以目的蛋白与内参GAPDH的灰度值比值表示目的蛋白的相对表达量。(2)参照既往研究[3],采用Keima法检测线粒体自噬,按照说明书操作将mt-Keima-COX8慢病毒滴度液与细胞共同孵育48 h,并以Puromycin药物筛选后稳定传代。4组细胞经不同处理后,置于共聚焦显微镜下观察。绿色荧光代表未发生自噬的线粒体,红色荧光代表发生自噬的线粒体,以红色/绿色荧光面积作为线粒体自噬水平。
1.4 线粒体膜电位测定
4组细胞经不同处理后经PBS洗后重悬,与JC-1(工作浓度为5 μmol/L)在37℃孵育15 min 后共聚焦显微镜下观察并记录数据。以红色/绿色荧光的比值来衡量线粒体去极化的程度,并以对照组进行标准化。比值越高表明线粒体去极化降低,线粒体膜电位(mitochondrial membrane potential,MMP)增加,反之则去极化增加,MMP下降。
1.5 ROS检测
采用DCFH-DA ROS荧光探针检测细胞ROS水平。4组细胞经不同处理后与5 μmol/L浓度的DCFH-DA工作液在37℃下共孵育10 min,酶标仪检测荧光强度,并以对照组进行标准化,同时在荧光显微镜下观察细胞荧光。
1.6 细胞ATP含量测定
采用荧光素-荧光素酶法检测线粒体ATP水平。将细胞悬液加入96孔白板,每孔100 μl(约2×104个细胞)。于室温下加入等体积CellTiter-Glo检测试剂,混匀细胞,并孵育10 min,用酶标仪检测各组A值,并以对照组进行标准化。
1.7 细胞活性检测
在96孔板中接种200 ul的细胞悬液,根据实验分组经过不同条件处理后弃上清,加入10 μl CCK-8溶液及培养液,继续孵育2 h,酶标仪上检测A值,并以对照组进行标准化。
1.8 统计学处理
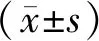
2 结 果
2.1 4组细胞线粒体自噬水平比较
与对照组比较,模型组细胞TOM20及TIM23表达显著下降,提示发生线粒体自噬;与模型组比较,治疗组TOM20及TIM23表达显著下降,提示线粒体自噬增强;与治疗组比较,抑制剂组TOM20及TIM23表达显著增加,提示mdivi-1抑制了虎杖苷上调的线粒体自噬,差异均有统计学意义(P<0.01)。为排除线粒体生成下降对线粒体自噬的影响,我们检测了用以反映线粒体生成的mTFA及PGC-1α。结果显示,4组细胞mTFA及PGC-1α水平比较差异无统计学意义(P>0.05)。通过Keima法进一步检测并验证线粒体自噬水平,结果显示,与对照组比较,模型组细胞红色/绿色荧光面积比值显著增加,提示发生线粒体自噬;与模型组比较,治疗组细胞红色/绿色荧光面积比值显著增加,提示线粒体自噬增强;与治疗组比较,抑制剂组细胞红色/绿色荧光面积比值显著减小,提示线粒体自噬被抑制(图1,表1)。
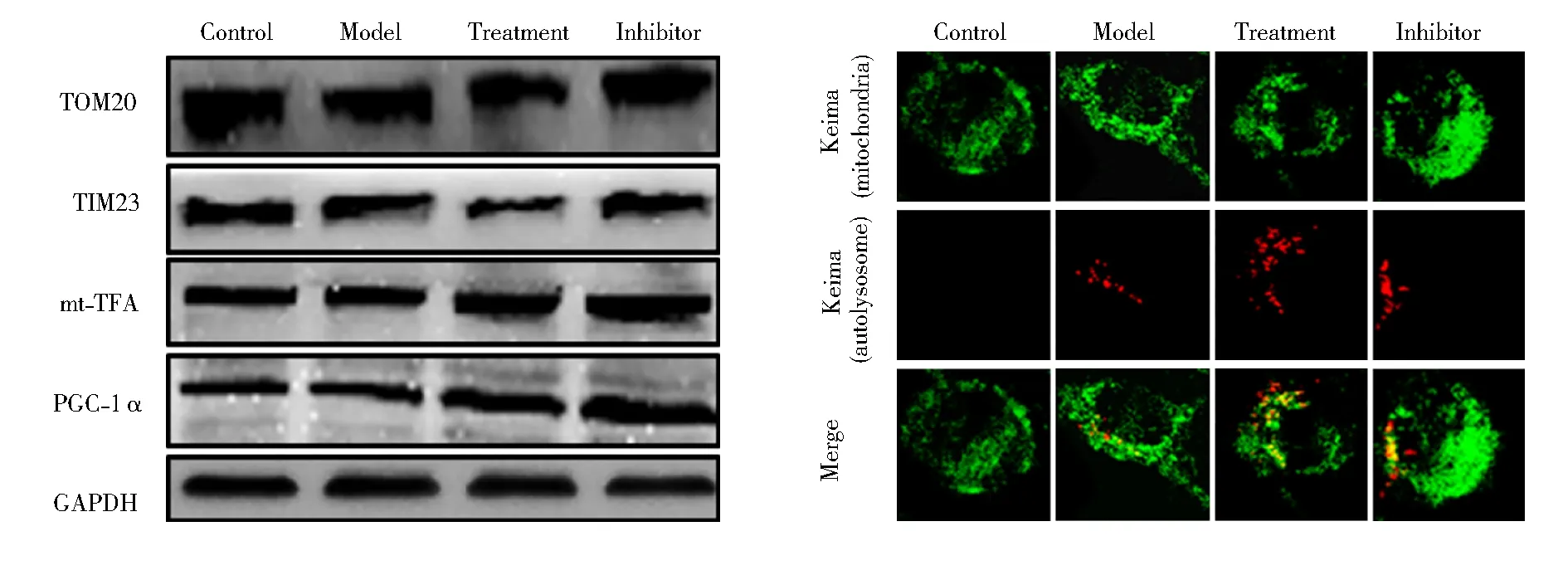
图1 4组细胞线粒体自噬结果
表1 4 组细胞线粒体自噬相关蛋白比较
TOM20: translocase of outer mitochondrial membrane 20; TIM23: translocase of inner mitochondrial membrane 23; mt-TFA: mitochondrial transcription factor A; PGC-1α: peroxisome proliferator-activated receptor-gamma coactivator-1α; GAPDH: glyceraldehyde-3-phosphate dehydrogenase. Compared with control group,*P<0.05; compared with model group,#P<0.05; compared with treatment group,△P<0.05.
2.2 4组细胞MMP比较
对照组、模型组、治疗组与抑制剂组MMP分别为(100.0±5.9)%、(54.2±4.8)%、(70.8±3.6)%和(56.0±6.1)%。与对照组比较,模型组细胞MMP显著下降,治疗组MMP较模型组显著增加,而抑制剂组MMP较治疗组显著下降,差异有统计学意义(P<0.01;图2)。
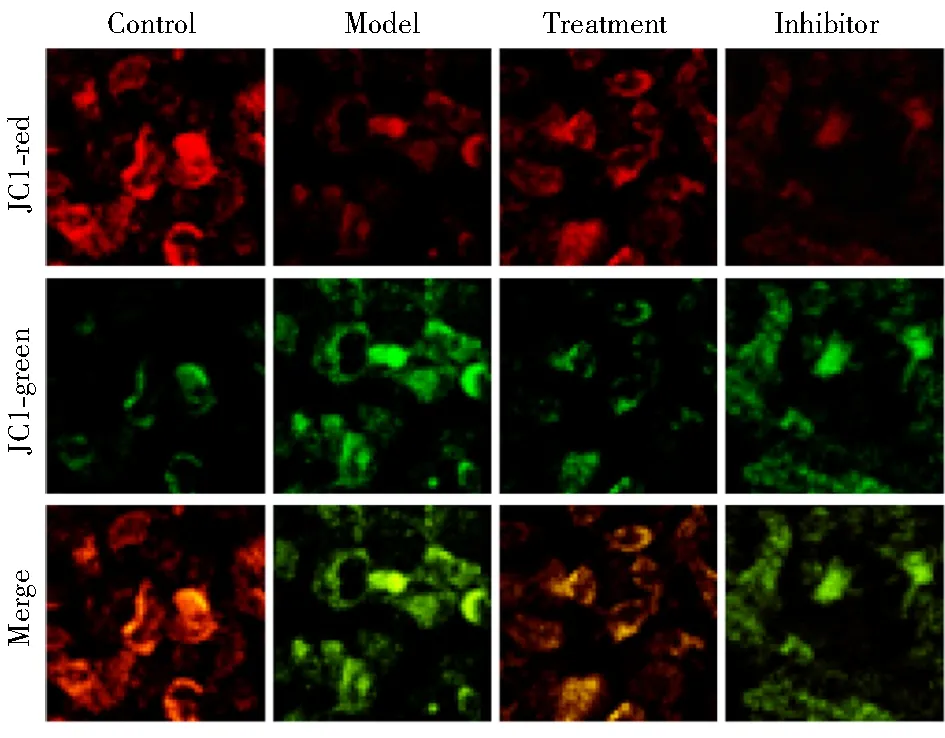
图2 JC-1法检测4组细胞MMP结果
MMP: mitochondrial membrane potential; JC-1: 5,5′,6,6′-Tetrachloro-1,1′,3,3′-tetraethyl-imidacarbocyanine iodide.
2.3 4组细胞ROS水平比较
对组组、模型组、治疗组与抑制剂组细胞ROS水平分别为(100.0±5.2)%、(213.0±20.1)%、(173.0±15.9)%和(201.5±17.5)%。与对照组比较,模型组细胞ROS水平显著上升;与模型组比较,治疗组ROS水平显著下降;与治疗组比较,抑制剂组细胞ROS水平显著上升,差异有统计学意义(P<0.01;图3)。
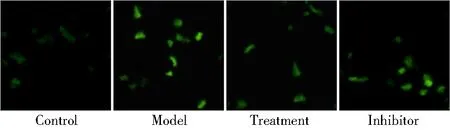
图3 DCFH-DA检测细胞ROS水平结果
2.4 4组细胞ATP和活性水平比较
对照组、模型组、治疗组及抑制剂组ATP分别为(100.0±4.3)%、(70.8±6.3)%、(82.7±4.2)%和(71.3±5.2)%;细胞活性依次是(100.0±3.8)%、(73.2±4.4)%、(82.7±6.3)%和(74.1±4.8)%。与对照组比较,模型组细胞活性、ATP水平显著下降;与模型组比较,治疗组细胞活性、ATP水平显著增加;与治疗组比较,抑制剂组细胞活性、ATP水平显著下降,差异有统计学意义(P<0.01)。
3 讨 论
线粒体是普遍存在于真核生物的细胞器,有细胞的“动力工厂”之称[8],在氧化应激、细胞信息传递、代谢调节及内源性凋亡途径的启动调节中发挥重要作用[1]。研究证实,肺泡上皮细胞线粒体损伤是ALI的重要发病机制,线粒体可以通过调节细胞凋亡及炎症反应参与ALI[1,3]。因此,维持线粒体功能正常是可能治疗ALI的方法之一[9,10]。线粒体自噬指细胞线粒体发生去极化损伤,损伤线粒体被特异性包裹进自噬体中,并与溶酶体融合,从而完成损伤线粒体的降解,维持细胞内环境的稳定[3]。研究表明上调线粒体自噬可以减轻百草枯介导的肺泡上皮细胞凋亡[11]。而抑制丝裂原活化蛋白激酶3表达可以减轻ALI,这可能与其上调线粒体自噬有关[12]。我们以往证实,虎杖苷可以通过抑制细胞凋亡及炎症反应减轻脂多糖介导的ALI,但机制尚未明确[2]。基于以上研究,本研究假设并探讨了虎杖苷是通过上调线粒体自噬减轻氧化应激介导的肺泡上皮细胞线粒体损伤。
本研究发现,虎杖苷可以显著抑制氧化应激介导的细胞ROS水平上升及细胞活力下降。另外,TOM20及TIM23是线粒体膜蛋白,只存在于线粒体中,当线粒体自噬增强时,其细胞内表达水平下降[3]。为检测虎杖苷对线粒体自噬的影响,我们检测了线粒体质量蛋白TOM20及TIM23,结果显示虎杖苷可以下调TOM20及TIM23表达,即增强了线粒体自噬水平。进一步研究发现,被广泛应用为线粒体自噬抑制剂的mdivi-1[3]可以显著抑制虎杖苷诱导的自噬保护作用。这些结果表明虎杖苷可能通过上调线粒体自噬水平发挥保护作用。mTFA是线粒体转录因子,在线粒体DNA的复制和线粒体生成中发挥关键的调节作用;PGC-1α是共激活转录因子成员,可调控线粒体生成相关基因的转录和表达,促进线粒体生成;在以往研究中通过检测mTFA及PGC-1α表达可以反映线粒体生成[3]。在本研究中我们发现虎杖苷不会引起mTFA及PGC-1α表达的变化,因而排除了因线粒体生成下降造成TOM20及TIM23表达下降的可能。另外我们还通过Keima法检测线粒体自噬变化。Keima蛋白定位于线粒体基质,当线粒体自噬体与酸性溶酶体融合后Keima蛋白的荧光信号由绿色转为红色,因此通过荧光信号的转换可定量反映线粒体自噬的水平。结果显示虎杖苷可以增强氧化应激介导的线粒体自噬,而mdivi-1可以抑制虎杖苷对线粒体自噬的增强作用。
线粒体自噬通过清除损伤的线粒体维持线粒体正常功能,我们进一步检测了虎杖苷对线粒体功能的影响。线粒体功能不全通常是由于线粒体通透转变孔开放引起[13]。正常线粒体处于电压内负外正的极化状态,这种跨膜电位是线粒体合成ATP必备的电压驱动力。我们结果显示虎杖苷显著抑制了氧化应激介导的MMP下降,而这种保护作用可以被mdivi-1显著抑制。另外,线粒体是ATP生成的主要细胞器,我们还检测了细胞ATP水平以反映线粒体功能的变化。结果显示虎杖苷可以显著抑制氧化应激介导的ATP水平下降,同样,这种保护作用被mdivi-1抑制。
总之,我们的研究认为虎杖苷可能通过上调线粒体自噬水平以减轻氧化应激介导的线粒体损伤,而抑制线粒体自噬可以显著降低虎杖苷的保护作用。
