氨基化纳米银的制备及抗菌性研究
2020-02-27蔺春蕾李文卓吕雅坤杨启振
蔺春蕾, 李文卓, 吕雅坤, 杨启振, 梅 林
(中原工学院材料与化工学院, 郑州 450007)
人类对抗生素的过分依赖和滥用,加剧了细菌耐药性的演化,人们受细菌致病的感染率和死亡率逐步升高[1-2]. 近年来,纳米银(AgNPs)作为一种具有较高抗菌活性且不易使细菌产生耐药性的新型抗菌剂,已逐渐被广泛使用[3-5]. 然而,由于AgNPs易团聚和易被氧化,导致其抗菌性能降低. 另外,AgNPs的抗菌行为依赖其较高的浓度,但是浓度过高会对生物体造成伤害[6-9]. 因此,对AgNPs进行表面修饰成为提高其抗菌活性的一个有效途径[10-12]. 阳离子聚合物功能化的AgNPs可通过静电吸引作用结合于表面带负电的细菌表面,从而抑制细菌生长[13-14]. 但阳离子聚合物本身具有的毒性限制了其在生物医学领域的进一步应用. 为了提高AgNPs的生物相容性,ALARCON等[15]利用光化学反应制备了胶原蛋白稳定的AgNPs,但所得纳米粒子的抗菌性有所下降.
在材料分子结构中适当引入氨基可提高其抗菌性和生物相容性[16]. 通过原位修饰法,在含有氨基的有机小分子存在条件下,还原硝酸银溶液可制备氨基化AgNPs. 氨基的加入可提高纳米粒子表面的正电荷数量,以期通过静电吸引作用结合于细菌表面,进而引起细菌细胞膜渗透性的提高. 而且,有机小分子结合在AgNPs表面可防止其发生聚沉,并保持其本来的抗菌活性. 然而,这种表面直接修饰含氨基小分子的AgNPs作为抗菌材料抑制细菌生长的研究未见报道.
本文合成了氨基化纳米银(AgNPs-NH2),将其作为新型抗菌纳米材料,研究其抗菌性能. 为了达到较高的抗菌活性,优化了纳米粒子的制备条件. 通过傅里叶变换-红外光谱(FT-IR)、X射线衍射(XRD)分析、表面电荷分析和透射电子显微镜(TEM)观察对制备的纳米粒子进行表征. 利用细菌生长抑制实验、抑菌圈和抗菌动力学实验研究其抗菌活性.
1 实验部分
1.1 试剂和仪器
主要试剂:硝酸银(AgNO3,99.995%,质量分数,全文同)购自上海阿拉丁生化科技股份有限公司;乙二胺(99.0%)和硼氢化钠(98%)购自国药集团化学试剂有限公司;氯化钾(AR)、氢氧化钠(AR)、磷酸二氢钾(AR)和磷酸氢二钠(AR)购自天津市科密欧化学试剂有限公司. 溶液均用超纯水配置.
主要仪器:紫外-可见分光光度计(UV-2700,日本岛津)、傅里叶变换-红外光谱仪(FT-IR,Nicolet iS50,美国赛默飞)、透射电子显微镜(TEM,FEI,Tecnai G2 Spirit TWIN,美国赛默飞)、X射线衍射仪(XRD,D/max-2500,日本理学)、激光粒度仪(Mastersizer 2000,英国马尔文)、分析天平(ML-T,瑞士梅特勒-托利多)、洁净工作台(SW-CJ-2F,苏州安泰空气技术有限公司)、立式高压蒸汽灭菌器(LDZX-50KBS,上海申安医疗器械厂)、恒温培养振荡器(ZWY-103B,上海智城分析仪器制造有限公司)、生化培养箱(LRH-250,上海一恒科学仪器有限公司).
1.2 AgNPs-NH2溶胶的制备及优化
在冰浴中充分搅拌条件下,向盛有49 mL超纯水的烧杯中加入500 μL AgNO3溶液(1.0%)和500 μL乙二胺,之后快速加入300 μL 300 mmol/L的NaBH4溶液并搅拌3 min,溶液颜色变成棕黄色,透析(Mw=8~14 kDa,上海源叶生物科技有限公司)12 h备用. 采用单因素优化实验设计,每个因素选择5个水平,优化NaBH4和乙二胺的体积对抗菌性能的影响.
1.3 细菌生长抑制实验
金黄色葡萄球菌和大肠杆菌在LB培养基中培养12 h,然后稀释到肉眼不能观测到菌液浑浊的程度,继续培养到快速生长期(利用紫外-可见分光光度计在波长600 nm处测试其吸光度OD600=0.1),并与2倍稀释的AgNPs-NH2溶胶等体积混合,在37 ℃下培养8 h,测其OD600. 实验重复3次.
1.4 抑菌圈实验
分别将金黄色葡萄球菌和大肠杆菌在LB培养基中培养12 h,取50 μL菌液加入LB琼脂培养基中搅拌均匀. 待冷却后,将直径为1.0 cm浸润了相同质量抗菌材料的圆形吸水纸小心放到琼脂板中央,在37 ℃下培养6 h.
1.5 抗菌动力学实验
金黄色葡萄球菌和大肠杆菌在LB培养基中培养12 h,然后稀释到肉眼不能观测到菌液浑浊的程度,继续培养至快速生长期(OD600= 0.1),与最小抑菌质量浓度(MIC)、2 MIC和4 MIC的AgNPs-NH2溶胶等体积混合,在37 ℃下培养,并在0、1、2、3、4、5、6、8、10、12、24 h时检测其OD600值. 用生理盐水代替抗菌材料作为阳性对照,实验重复3次.
2 结果与讨论
2.1 AgNPs-NH2溶胶的最优制备条件
为了提高抗菌活性,探究NaBH4和乙二胺的浓度对AgNPs抗菌性能的影响. 在0.6~3.0 mmol/L的范围内,考察NaBH4的浓度对AgNPs-NH2抗菌活性的影响(图1). NaBH4的浓度越大,制备的纳米粒子的颜色越浅(图1A)、吸光度越大(图1B)且对大肠杆菌和金黄色葡萄球菌的抗菌活性越高(图1C). 然而,当c(NaBH4)=1.8 mmol/L时,抗菌活性最高. 当c(NaBH4)>1.8 mmol/L时,抗菌活性反而降低. 因此,NaBH4的最佳浓度选择1.8 mmol/L.
为了进一步提高抗菌活性,在乙二胺体积分数0.2%~1.8%的范围内,考察乙二胺的体积分数对AgNPs-NH2抗菌活性的影响(图2). 乙二胺的体积分数越大,制备的纳米粒子颜色越深(图2A)且吸光度越低(图2B). 当乙二胺的体积分数为1.0%时,制备的纳米粒子对大肠杆菌和金黄色葡萄球菌的抗菌活性最高(图2C). 因此,实验选择1.0%为乙二胺的最佳体积分数.

图1 不同NaBH4浓度制备的AgNPs-NH2溶胶照片、紫外-可见光谱和最小抑菌质量浓度Figure 1 The photograph of AgNPs-NH2 solutions prepared with different NaBH4 concentrations,the UV-Vis spectra,and the minum inhibitory concentrations
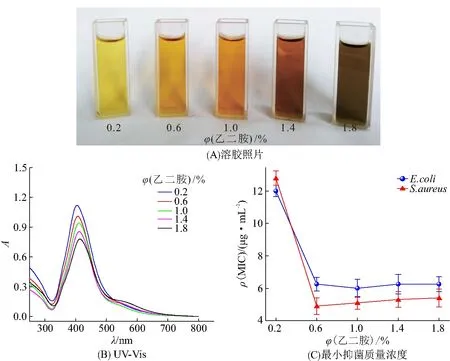
图2 不同乙二胺体积分数制备的AgNPs-NH2溶胶照片、紫外-可见光谱和最小抑菌质量浓度Figure 2 The photograph of AgNPs-NH2 solutions prepared with different volume fraction of ethylenediamine,the UV-Vis spectra,and the minum inhibitory concentrations
2.2 AgNPs-NH2的表征
紫外-可见光谱、红外光谱和溶胶照片用来证实AgNPs-NH2的生成. 从紫外-可见光谱(图3A)可以看出,AgNPs-NH2的吸收强度明显高于AgNPs,说明乙二胺结合在纳米粒子表面有利于氨基的形成. 由图3B可知,与AgNPs相比,AgNPs-NH2在波数1 643 cm-1处存在-NH2的弯曲振动峰;在波数为3 357、 3 267 cm-1处存在-NH2的伸缩振动峰;在波数为2 924、2 856 cm-1处存在-CH2的伸缩振动峰. 分析表明:乙二胺已原位修饰在AgNPs表面. XRD用来研究AgNPs-NH2的晶体结构(图3C),衍射峰出现在37.94°、44.14°、64.28°、77.26°、81.34°,分别与金属银的面心立方晶体结构的晶面(111)、(200)、(220)、(311)和(222)相对应,说明制备的AgNPs具有立方面心晶型[17]. AgNPs和AgNPs-NH2溶胶的颜色分别为淡黄色和棕黄色(图3D),证明乙二胺结合在AgNPs 表面引起了颜色变化. 从AgNPs-NH2的TEM图可以看出,纳米粒子呈球形且分布均匀(图3E). 表面电荷分析(图3F)显示,AgNPs的Zeta电位ζ=-23.5 mV,而AgNPs-NH2的ζ=4.22 mV. AgNPs表面带负电荷,与表面同样带负电荷的细菌相斥,抗菌依赖高浓度;而AgNPs-NH2带正电荷,容易与细菌结合,从而充分发挥了AgNPs-NH2的抗菌作用[18].
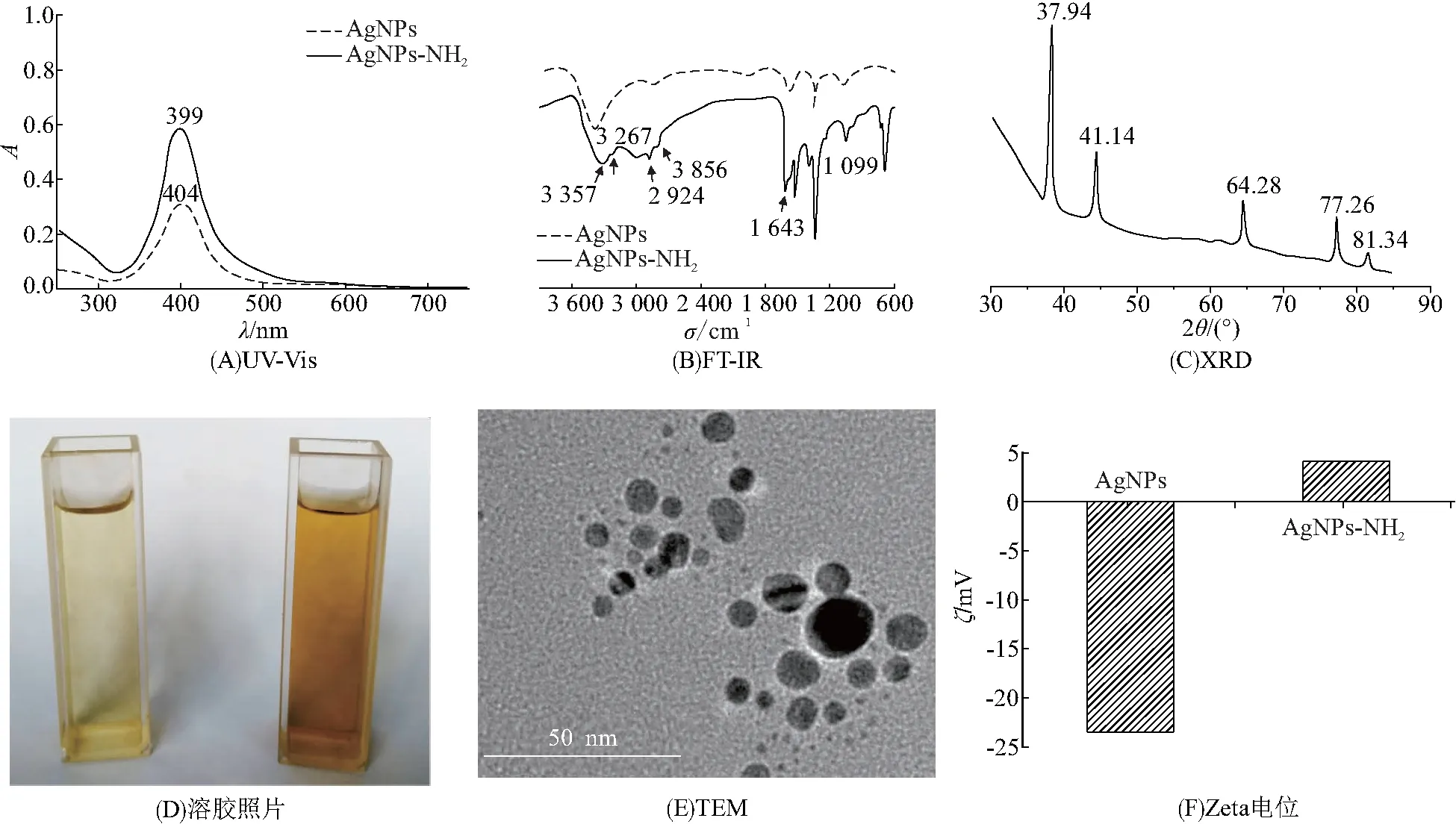
图3 AgNPs-NH2的表征
Figure 3 The characterization of AgNPs-NH2
2.3 抗菌性研究
细菌生长抑制实验用来评价AgNPs-NH2的抗菌活性(图4),当纳米粒子的质量浓度大于1.56 μg/mL时,可有效抑制大肠杆菌和金黄色葡萄球菌的生长. 纳米粒子表面的正电荷可显著增强材料与细菌细胞膜的静电吸引作用,进而有效抑制细菌生长.
抑菌圈实验用来证实AgNPs表面氨基化后可增强其抗菌活性(图5),AgNPs-NH2的抑菌圈直径明显大于AgNPs的,说明在相同质量浓度下AgNPs-NH2比AgNPs具有更强的抗菌活性. AgNPs-NH2因表面带正电荷更容易与细菌结合,因此它对革兰氏阴性菌和阳性菌具有更强的抗菌性.
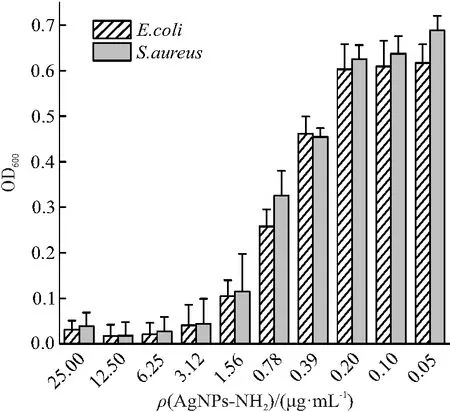
图4 AgNPs-NH2对大肠杆菌和金黄色葡萄球菌生长的抑制Figure 4 The growth inhibition of E.coli and S.aureus in the presence of AgNPs-NH2

图5 不同纳米材料对大肠杆菌和金黄色葡萄菌的抑菌圈Figure 5 The inhibitory circles of different nanomaterials on E.coli and S.aureus
当AgNPs-NH2质量浓度分别为6.24、3.12、1.56 μg/mL时,检测不同时间段AgNPs-NH2对大肠杆菌和金黄色葡萄球菌的生长抑制情况(图6). 不同质量浓度的AgNPs-NH2在12 h内对大肠杆菌均显示出良好的抑菌性;而对于金黄色葡萄球菌,6.24、3.12 μg/mL的AgNPs-NH2在12 h内抑菌性良好,当AgNPs-NH2的质量浓度为1.56 μg/mL时,在8 h内抑菌性良好. 这可能是由于金黄色葡萄球菌属于革兰氏阳性菌,细胞壁上的肽聚糖层比较紧密,影响纳米粒子穿过细胞壁进入细胞体内[19]. AgNPs-NH2也是一种抗菌剂,与药物类似具有一定时间的药效,当AgNPs中Ag+峰值释放过后,抗菌性会有所降低.

图6 AgNPs-NH2的抗菌动力学实验Figure 6 The antibacterial kinetic experiment on AgNPs-NH2
3 结论
通过原位修饰法成功制备了氨基化纳米银,并将其作为新型抗菌纳米材料进行研究. 这种纳米粒子表面带正电荷,可通过静电吸引作用结合细胞膜带负电荷的细菌,有效抑制革兰氏阴性菌和阳性菌的生长. 该抗菌材料在多重细菌感染疾病治疗中具有潜在的医学应用价值.
