菌株Pseudomonas.BTs降解转化3种苯并三唑类化合物
2020-02-27石洲旗刘有胜蔡稳稳杨愿愿应光国
石洲旗, 刘有胜, 蔡稳稳, 熊 倩, 杨愿愿, 应光国
(1. 中国科学院广州地球化学研究所∥有机地球化学国家重点实验室, 广州 510640; 2. 华南师范大学环境学院∥广东省化学品污染与环境安全重点实验室∥环境理论化学教育部重点实验室, 广州 510006; 3. 中国科学院大学, 北京 100049)
苯并三唑类化合物(Benzotriazoles,BTs)是一类产量与消耗量巨大的亲水性杂环化合物,由于其出色的防腐蚀性能,BTs作为抗腐蚀添加剂已被广泛应用于工业生产和日常生活中,包括机场防冻液、制动液、厨房洗碗剂等[1-2],常见的BTs包括苯并三唑(BTri)、5-甲基-苯并三唑(5-TTri)、5-甲基-苯并三唑的混合物(TTri)、5,6-二甲基-苯并三唑(XTri)和5-氯-苯并三唑(CBT),其中仅BTri在美国的年产量就高达850 t[3],大量BTs的排放可对受纳环境造成潜在威胁. 已有报道[4-6]表明:BTs在低暴露浓度下具有一系列亚致死效应,包括对鱼的肝毒性、神经毒性、内分泌干扰效应,在体外实验中,甚至发现120 ng/L的BTri就能够诱导子宫内膜癌细胞的侵袭和迁移[7]. 然而,目前城市污水硬厂处理工艺仅针对常规污染物,无法有效去除BTs(去除效率<80%),已导致大量残留BTs进入受纳水环境,从而可能进一步通过饮用水等途径进入人体[8-10]. 目前在西欧、北美以及中国珠三角等水域都被检测出了数百至上万ng/L的BTs[11-14],对BTs的去除效率亟需提高. 微生物降解具有能耗低、二次污染少、反应条件温和等优点,目前关于BTs微生物转化的研究大多集中于活性污泥等复杂体系上[15-17],关于单株细菌转化BTs的报道极少,而对单株BTs降解菌的研究有助于理解BTs的微生物转化机理,其实验结果也更具可靠性与重复性. 此外,不同碳源能够显著影响微生物去除污染物的效率[18],不同碳源种类对BTs去除效果的影响值得探究.
本文分析了一株单菌对三种典型BTs(BTri、5-TTri、CBT)的降解转化能力,并对该株细菌进行了16S rDNA鉴定以及生理生化表征. 测试了该株菌利用11种物质作为生长基质共代谢BTri、5-TTri和CBT的降解效果,利用超高效液相色谱与四极杆飞行时间高分辨率质谱联用技术(UHPLC-Q-ToF)鉴定了BTri、5-TTri和CBT被该株菌转化的产物.
1 实验部分
1.1 仪器与材料
1.1.1 主要仪器 高压蒸汽灭菌锅(MLS-3781L,日本松下)、恒温空气振荡摇床(ZQZY-80 CGS,上海知楚仪器)、超净工作台(BSC-1300ⅡB2,上海博讯)、普通热循环仪(T100,美国伯乐)、超高液相色谱(1260Ⅱ,美国安捷伦)、超高液相色谱联用四级杆飞行时间高分辨率质谱(1290Ⅱ-6545,美国安捷伦). 色谱柱为反相色谱柱(Eclipse XDB-C18,美国安捷伦).
1.1.2 主要试剂 葡萄糖、氯化钠、结晶硫酸镁、无水氯化钙、磷酸二氢钾、麦芽糖、乙酸钠购于天津大茂化学试剂厂;磷酸氢二钾购于天津永大化学试剂有限公司;甲酸、谷氨酸钠、腐殖酸购于阿拉丁试剂(上海)有限公司;富里酸购于上海麦克林生化科技有限公司;蛋白胨、酵母提取物购于英国Oxoid公司;水解酪蛋白胨(MH)肉汤购于广东环凯微生物科技有限公司;引物27F和1492R购于深圳华大基因股份有限公司;PCR buffer、Taq、dNTP热聚合酶购于大连TaKaRa公司.
1.1.3 实验菌株 菌株来源于前期实验中通过从基本未受BTs污染的自然水-沉积物体系中,以BTs为碳源,不断传代驯化,再经过平板划线的方式分离保存的一株菌. 该菌株置于30%灭菌LB甘油肉汤中(30 mL甘油+70 mL纯水+2.1 g LB培养基粉末,混匀后121 ℃蒸汽灭菌20 min,在-80 ℃超低温保存. 需要复苏该菌株时,将菌种从-80 ℃超低温冰箱中取出,于冰箱4 ℃下放置5 h解冻,然后将菌株接种于灭菌MH肉汤培养基进行扩增[19].
1.2 实验方法
1.2.1 BTs降解菌的降解效率实验 对于3种BTs化合物(BTri、5-TTri、CBT),每种化合物均设置实验组(向体系中接种菌株,BTs母液的溶剂为甲醇)和对照组(向体系中接种菌株,BTs母液溶剂为纯水). 实验组和对照组均设置3个平行实验. 微生物转化实验在容积为50 mL的三角瓶中进行,每个三角瓶中的微生物转化体系含有40 mL无机盐液体培养基(每1 L成分:9.6 g K2HPO4·3H2O,3.0 g KH2PO4,0.5 g NaCl,1.0 g NH4Cl,0.25 g MgSO4·7H2O,0.014 g CaCl2,1 mL微量金属溶液,1 mL维生素)[20]以及最终质量浓度为1 mg/L的BTs. 摇床培养条件:转速180 r/min,温度30 ℃. 按1.1.3步骤复苏解冻-80 ℃保存的菌株,加入到100 mL灭菌的MH肉汤中,在摇床中转速为180 r/min、温度为30 ℃条件下经过一定时间(约12 h至对数生长后期OD600达到1.0)后停止培养. 取4 mL菌液,在转速10 000 r/min下离心5 min,弃上清液,采用0.9%(质量分数,全文同)的生理盐水混匀洗涤. 再次在转速10 000 r/min下离心5 min,弃上清液,以1∶10的体积比将细菌接种至微生物转化体系中,并以此作为零时刻,每隔2 d采集1 mL菌液,在转速12 000 r/min下离心5 min,用无菌注射器取上清液,经水相滤膜过滤,转移至棕色进样小瓶内4 ℃下保存,待上机检测. 运用高效液相色谱(HPLC)监测BTs质量浓度的变化:色谱柱为反相色谱柱,柱温箱温度为40 ℃,进样体积为100 μL,流动相为甲醇(A)、0.1%(体积分数,全文同)甲酸溶液(B),流速为0.7 mL/min. 洗脱程序为等度洗脱:60%A+40%B,洗脱时间为4.5 min,检测器为二极管阵列检测器(DAD),检测波长为255 nm.
1.2.2 降解菌生理生化表征和鉴定 包括3个实验:(1)提取16S rDNA并对其进行测序并与数据库比对;(2)在摇床中30 ℃、180 r/min的培养条件下,绘制该菌株在MH肉汤中的生长曲线;(3)用简易试剂盒对该菌进行包括硝酸盐还原、淀粉水解、明胶水解在内的一系列生理生化实验,并进行革兰氏染色,观察细菌菌落形态. 实验(1)采用热水浴法提取该菌株DNA:取1 mL在MH肉汤中培养至对数生长期的菌液,在转速10 000 r/min下离心5 min,弃上清液,加入600 μL 0.9%的生理盐水重复该步骤以清洗培养基残留物,然后用500 μL TE缓冲液混匀菌体,放置于85 ℃热水中水浴10 min,然后迅速冰浴10 min,细菌外壁因冷热交错而破裂并释放DNA至TE缓冲液中,紧接着在转速10 000 r/min下离心2 min,使得密度较大的菌体外壁蛋白等沉淀,上清液为目标DNA模板. 为了富集菌株的16S rDNA,采用聚合酶链式反应(PCR)技术对细菌的16S rDNA片段进行扩增,引物为通用的27F(5’AGAGT TTGAT CMTGG CTCAG3’)和1492R(5’GGTTA CCTTG TTACG ACTT3’). 为减少非特异性扩增,采用降落式PCR. 反应参数:94 ℃下预变性5 min,94 ℃下变性1 min,63 ℃下退火1 min,72 ℃下延伸3 min. 随后每一个循环降低退火温度0.5 ℃,直至温度降为53 ℃. 之后以53 ℃为退火温度,其它条件不变,进行10次循环,最后72 ℃下延伸7 min. PCR体系为25 μL,包括:模板DNA 2 μL、灭菌去离子水17.3 μL、Taq聚合酶0.2 μL、上下游引物各0.5 μL、dNTP 2 μL、缓冲液2.5 μL. PCR效果采用1%琼脂糖凝胶电泳检测,若提取质量较好,则在点样孔下方有较为明亮且清晰的单一条带. 通过PCR扩增得到的细菌16S rDNA送至测序公司进行测序,返回得到的序列网站数据(https:∥www.ezbiocloud.net/)比对,采用物种聚类软件MEGA7,以neighbor-joining的聚类方式绘制系统发育树,bootstrap次数设为1 000次,bootstrap值若在70以上,说明聚类结果显著性较高,该株菌的系统发育树具有较高的可信度.
1.2.3 外加碳源对降解菌共代谢BTs的影响 选取腐殖酸(HA)、富里酸(FA)、淀粉、麦芽糖、葡萄糖、乙酸钠、谷氨酸钠、乙醇、苯酚、蛋白胨、酵母提取物等11种外加碳源,投加至含有1 mg/L BTs的降解体系中,选取100 mg/L和1 000 mg/L为2种外加碳源的终质量浓度,与BTs形成100∶1和1 000∶1的投加质量比. 按照步骤1.2.1培养并向降解体系中接种菌株,在0、1、3、5 d取样,并按照1.2.1的液相上机方法检测BTs在降解体系中的质量浓度变化,分析不同外加碳源对降解菌共代谢BTs效率的差异和规律.
1.2.4 降解转化产物鉴定 根据产物预测转化结果(http:∥eawag-bbd.ethz.ch/),在Agilent Mass Hunter PCDL Manager软件中建立3种BTs化合物的可能产物数据库. 按照1.2.1中细菌的培养方式,将生长至对数后期的细菌以25%的体积比接种至含有5 mg/L BTs的无机盐培养基中,在0、1、2、3、5 d按照1.2.1的步骤取样,并转移至棕色进样小瓶内保存,等待上机. 使用超高效液相色谱与四极杆飞行时间高分辨率质谱联用技术(UHPLC-Q-ToF)鉴定BTri、5-TTri和CBT的微生物转化产物,色谱柱为反相色谱柱. 上机参数:进样量10 μL,流速0.3 mL/min,柱温40 ℃. 正模式与负模式均采用甲醇作为流动相A,0.1%甲酸溶液为流动相B. 洗脱方式采用梯度洗脱程序:0~2 min, 5% A;2~5 min,30%A;5~10 min,A从30%逐步提高至40%;10~14 min,A相从40%逐步提高至70%;14~19 min,A相从70%逐步提高至90%;19~24 min,90%A;预留8 min使A相体积分数恢复5 min. 干燥气温度为320 ℃,流速为8 L/min,鞘气温度为350 ℃,流速为11 L/min,毛细管电压在正模式下为4 000 V、负模式下为3 500 V. 为了得到转化产物的二级质谱图,需要明确其质荷比(m/z)与保留时间(RT),因此,首先在正负模式下采用全扫描(Scan)模式得到转化产物的质荷比与保留时间,在目标二级质谱(targeted MS/MS)模式中得到产物的二级碎片信息. Scan模式的质荷比扫描范围50~300,扫描速率为3 spectra/s,在targeted MS/MS模式下,一级质谱以及二级质谱的质荷比扫描范围均为50~300,扫描速率均为3 spectra/s,碰撞电压固定为10、20、40 V. 使用仪器配套软件Profinder、PCDL Manager、Agilent Workflow、Molecular Structure Correlator等分析鉴定转化产物.
2 结果与讨论
2.1 降解菌对BTs的降解性能
在对照组中,当BTs为体系中的唯一碳源时,3种BTs化合物的质量浓度几乎无变化(图1),说明该菌株无法利用唯一碳源BTs,并且由于BTs亲水性较高,且此次试验中菌体的质量浓度较小(接种比为10%),可以预见BTs在菌体上的吸附性小. 实验结果也证实了这一预测,亲水性较高的BTri和5-TTri在实验周期内质量浓度没有发生变化,而亲水性相对较小的CBT在实验周期内质量浓度仅下降了12%. 在实验组中,该株菌在其它碳源(甲醇)存在时对3种BTs具有不同的转化能力,在16 d的试验结束时,CBT能够完全转化,而BTri的转化率仅36.6%,5-TTri的转化率仅20%. 根据实验组与对照组的结果可得结论:该株菌无法利用BTs作为唯一碳源,但可以利用甲醇为生长基质,诱导产生特异性较低的酶以共代谢的方式转化BTs,其中关键酶以及相关生化途径需要进一步鉴定. 此外,针对在本次试验中BTri和5-TTri的转化不完全的现象,在BTri转化停止且质量浓度完全稳定后,向转化体系中再次添加1 000 mg/L 的甲醇,发现BTri可被继续转化,从19 d至24 d内其质量浓度再次下降了20%左右. 这可能是当生长基质(甲醇)消耗殆尽后,BTri或5-TTri转化产物的累积能够对负责转化BTs的关键酶产生抑制作用,因此BTs的转化过程趋于停滞. 当再次添加甲醇后,细菌获得生长代谢所需的物质能量,通过重新合成关键酶或者具有分解毒性中间产物能力的酶来解除抑制作用,从而重启BTs的转化.
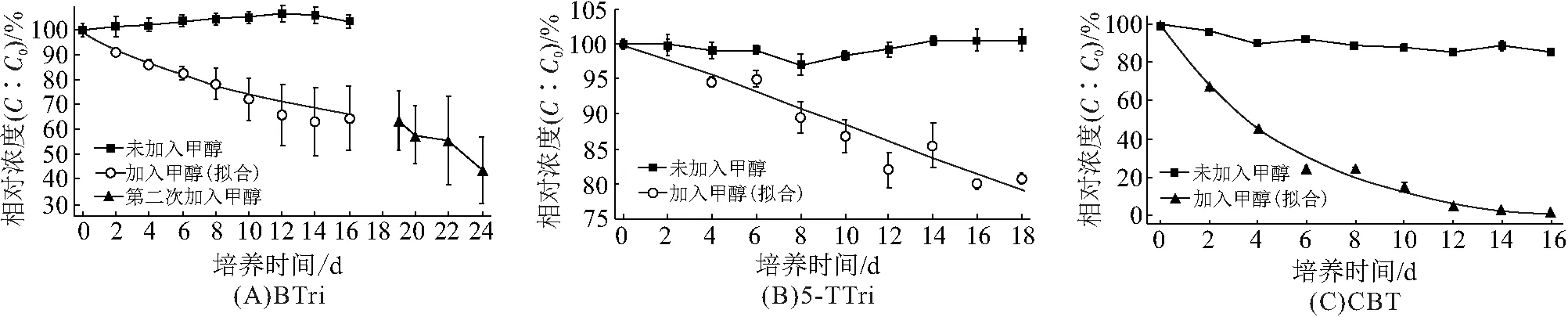
图1 BTri、5-TTri及CBT在Pseudomonas.BTs作用下的生物降解曲线Figure 1 The biodegradation curves of BTri, 5-TTri and CBT with Pseudomonas.BTs注:拟合方程:(A)Y=53.34e-x/18.71+3.43e-x/0.017+43.26,R2=0.98, p<0.01, t1/2=38.69 d;(B)Y=-425.03ex/739.58-425.03ex/732.93+950.13,R2=0.95, p<0.01, t1/2=42.15 d;(C)Y=-53.91e-x/5.31+425.03e-x/5.31-7.11,R2=0.99, p<0.01, t1/2=3.37 d.
2.2 降解菌的特性
该株菌呈革兰氏阴性,16S rDNA的比对结果显示:该株菌与Pseudomonas.taiwanensisBCRC 17751亲缘关系最近,同源性高达99%以上,故将其命名为Pseudomonas.BTs(图2). 该菌株在纯培养条件下,在MH琼脂培养基上的菌落呈圆形,中部略微凸起,边缘较为圆滑无明显锯齿状,菌落较湿润,有粘性,菌落颜色浅黄偏白,正反颜色一致. 此外,生理生化试验结果:(1)硝酸盐还原反应阴性,过氧化氢酶试验阳性,明胶水解试验阳性;(2)淀粉水解试验阳性,西蒙氏柠檬酸盐实验阳性,V-P试验阴性,葡萄糖试验阴性,甘露醇试验阴性,溶菌酶肉汤试验阳性,动力学培养基试验阳性. 生长曲线显示Pseudomonas.BTs在4 h左右进入对数生长期,14 h左右进入平台期,整体生长速率较快(图3). 有文献[21]报道以BTri为碳源对细菌菌群不断驯化,BTs去除效率得到显著提高,且菌群中初始比例较小的Pseudomonas(假单胞菌属)成为优势菌种,这说明具有转化多种有机物能力的假单胞菌同样能够转化BTs,这与本文的研究结果一致.

图2 Pseudomonas.BTs的系统发育树Figure 2 The phylogenetic tree of Pseudomonas.BTs

图3 Pseudomonas.BTs的生长曲线Figure 3 The growth curve of Pseudomonas.BTs
2.3 外加碳源对BTs共代谢的影响
在碳源质量浓度(100 mg/L)为BTs(1 mg/L)100倍(投加质量比100∶1)的情况下,由于外加碳源质量浓度较低,外加碳源在被Pseudomonas.BTs快速消耗之后,Pseudomonas.BTs失去了生长代谢所需的物质与能量来源,对BTs共代谢过程的持续时间也较短,在1 d左右便几乎停止(图4). 而当外加碳源的质量浓度提升为1 000 mg/L时,Pseudomonas.BTs对BTri、5-TTri以及CBT的转化程度均显著提高,持续时间也延长至3 d左右,这说明投加质量比为1 000∶1时更有利于Pseudomonas.BTs对BTs的共代谢. 由于BTs作为难降解物质,在共代谢转化BTs的过程中细菌不仅不能够获取能量,相反共代谢需要消耗一部分能量,因此,更高浓度的生长基质(外加碳源)能够为细菌提供更多共代谢所需物质的合成原料以及能量. 值得注意的是,当生长基质相对于非生长基质的质量浓度比过高时,可能会使非生长基质结合关键酶位点的概率降低[18],从而影响共代谢效果,但从本实验结果来看,1 000∶1的投加质量比尚不足以对Pseudomonas.BTs共代谢BTs造成抑制作用.
在11种外加碳源中,乙醇、葡萄糖、蛋白胨、谷氨酸钠、乙酸钠显示出对BTs共代谢较好的促进作用,尤其是乙醇,在质量浓度为1 000 mg/L时,在1 d内便能使CBT完全转化,同时在3 d内46%的BTri以及34%的5-TTri被转化. 由2.1的结果表明:添加甲醇同样能够启动BTs的转化,我们认为Pseudomonas.BTs的特异性较低,能够同时转化醇类物质与BTs. 以葡萄糖、蛋白胨、谷氨酸钠作为常用的微生物生长基质,同样能够显著促进BTs的共代谢. 而富里酸(Fulvic Acid,FA)分子中具有大量醌类官能团,有研究表明醌类化合物具有较强的氧化还原活性[22],在微生物的电子传递链中发挥重要作用,能够促进难降解物质的微生物转化. 在本次实验中,当FA存在时,3种BTs化合物得到了一定程度的转化. 当以苯酚、淀粉、麦芽糖作为生长基质时,Pseudomonas.BTs对3种BTs化合物的共代谢几乎不发生,其中利用1.2.1所设定的色谱条件,能够同时检测BTs与苯酚的质量浓度,并且发现苯酚在实验周期内质量浓度未发生变化,因此Pseudomonas.BTs无法利用苯酚. 在本次实验中,葡萄糖对BTs的共代谢有显著提升作用,然而淀粉和麦芽糖无法触发Pseudomonas.BTs对BTs的共代谢,我们推测Pseudomonas.BTs不具有水解并利用淀粉和麦芽糖的能力. 在3种BTs化合物中,CBT 相比BTri和5-TTri具有更好的生物转化性,这可能是CBT对Pseudomonas.BTs中负责转化BTs的酶具有较低的空间位阻效应[21].

图4 11种碳源添加条件下Pseudomonas.BTs对BTri、5-TTri及CBT的共代谢
Figure 4 The co-metabolism of BTri, 5-TTri and CBT withPseudomonas.BTs in the presence of 11 external carbon sources
2.4 转化产物的鉴定
3种BTs化合物在Pseudomonas.BTs转化作用下的中间产物推测结构如图5所示,20种产物分别按TP1~TP20编号. BTri、5-TTri和CBT分别鉴定出7种、8种和5种中间产物,可以看出3种BTs化合物具有相似的转化途径,可以归纳为两大类:一类是母体化合物的同分异构化;一类是在母体化合物各种官能团加成.
对于第一类产物(TP1、TP2、TP3、TP8、TP9、TP10、TP16、TP17),3种BTs化合物三唑环上的氮原子与苯环上的碳原子进行了位置交换,形成具有各种原子排列形式的同分异构体,这是首次报道细菌对BTs进行同分异构转化,并且在其它化合物的微生物转化文献中也未曾发现类似的转化途径,其背后的机理值得深入研究. 对于第二类产物,在三唑环上的甲基加成产物(TP6、TP15、TP19)已在数篇文献中报道[17,23-24],此次研究还发现了其它多种官能团途径:例如酯类加成(TP4、TP5、TP11、TP13、TP14、TP18、TP20)、甲氧基化(TP12)、羟基化(TP7、TP14)等. 对于结构较为复杂的产物(例如TP7、TP12、TP14)可能是在多种转化酶的作用下经历了多步反应形成的,这也导致了本次实验中产物的多样性. 值得注意:同以往的报道类似[17,20,23-25],在本研究中未检测出苯环断裂的产物,并且鉴定的产物也未显示出继续转化为其它产物的迹象. 由于BTs化合物的碳原子集中在苯环上,没有苯环断裂的产物从一定程度说明了BTs难以作为碳源被微生物利用,因此难以单独被转化,转化过程的启动需要添加额外的易被微生物利用的碳源. 在自然界以及污水处理厂的水体中,除了BTs外,还共同存在多种化合物,我们推测微生物共代谢可能是BTs在自然界以及污水处理厂主要的消减途径,并且转化产物的毒性需要评估. 此外,3种BTs化合物的转化途径较为相似,因此菌株Pseudomonas.BTs参与3种BTs转化的酶的种类可能相同. BTs在Pseudomonas.BTs作用下转化生成的产物信息见表1.
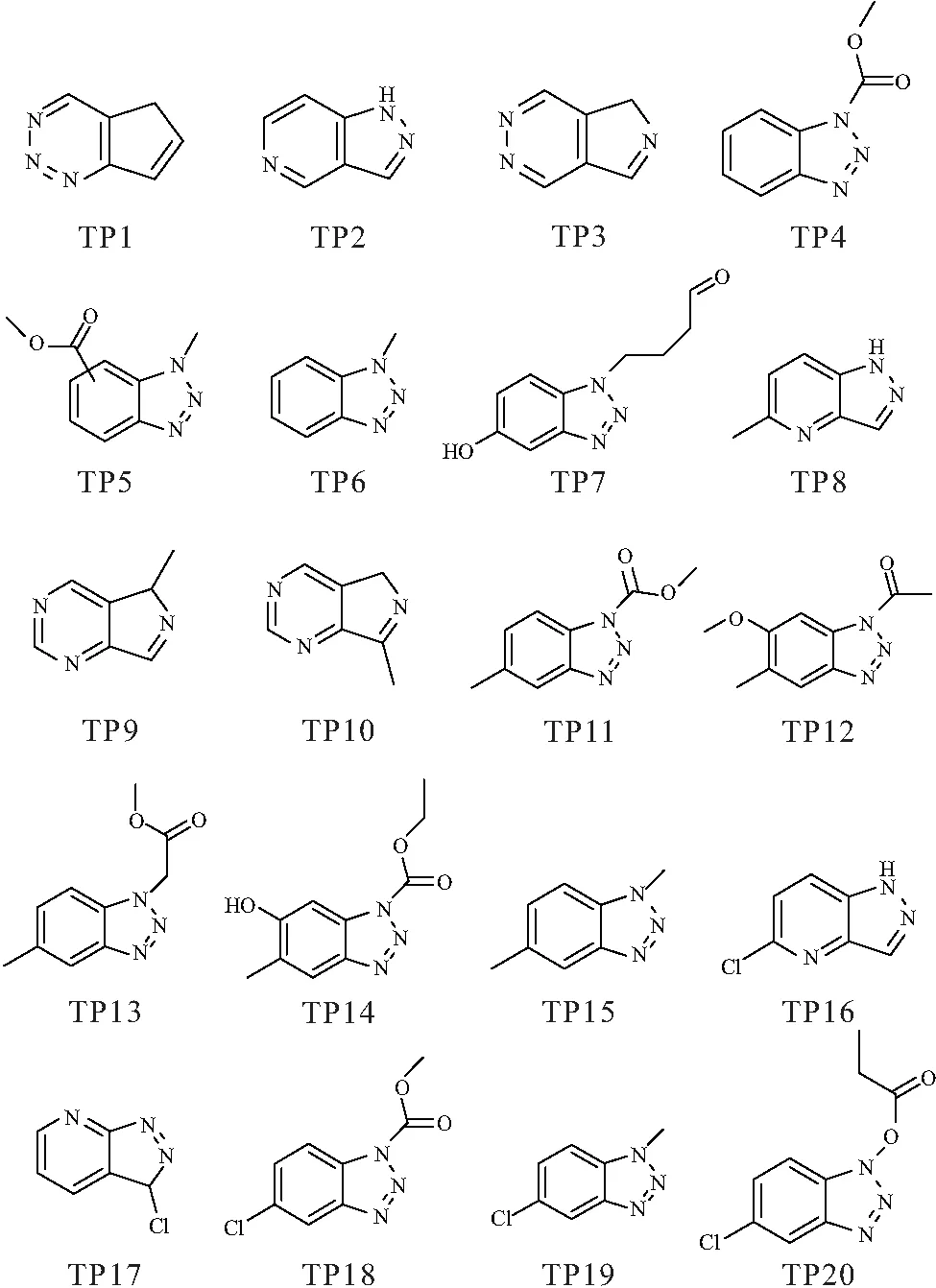
图5 转化产物的结构式Figure 5 The structural formula of the products

表1 BTs在Pseudomonas.BTs作用下的转化产物信息Table 1 The information of transformation products of BTs with Pseudomonas.BTs
3 结论
菌株Pseudomonas.BTs能够以共代谢的方式对BTri、5-TTri及CBT进行不同程度的降解,其中对CBT的降解效率较高.Pseudomonas.BTs与菌株Pseudomonas.taiwanensisBCRC 17751最具有亲缘关系. 葡萄糖、甲醇、蛋白胨、乙酸钠等外碳源在投加质量比为1 000∶1时能够有效促进Pseudomonas.BTs共代谢BTs. 该菌株对3种BTs化合物具有相似的转化途径,同分异构以及官能团加成构成了Pseudomonas.BTs转化BTs的主要方式,未检测到苯环断裂反应,共代谢可能是自然界中微生物转化BTs的主要方式,本文为探索BTs的微生物转化机理提供了参考,对优化BTs的去除具有一定指导意义. 在本研究中首次发现了BTs异构化,需要对其机制进行更深入的研究. 同时在今后的研究也应积极采用同位素标记法、基因组学等新兴技术,开拓有关BTs降解菌种类鉴定以及降解基因定位的研究.
