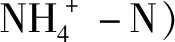人工湿地系统对生活污水中类固醇激素的去除效果
2020-02-27何璐茜应光国
何璐茜, 陈 军, 应光国
(华南师范大学环境学院∥广东省化学品污染与环境安全重点实验室∥教育部理论化学重点实验室, 广州 510006)


1 材料与方法
1.1 试剂、实验材料及仪器设备
28种目标化合物和6种内标物质的名称、缩写、CAS号及分子式如表1所示. 试剂:二氯甲烷、甲醇、乙腈、乙酸乙酯和正已烷均为色谱纯,购于德国Merk公司和德国CNW公司;甲酸购于美国Tedia公司;乙酸铵购于美国Sigma-Aldrich 公司;超纯水采用Milli-Q超纯水器(Millipore公司,美国)制取.
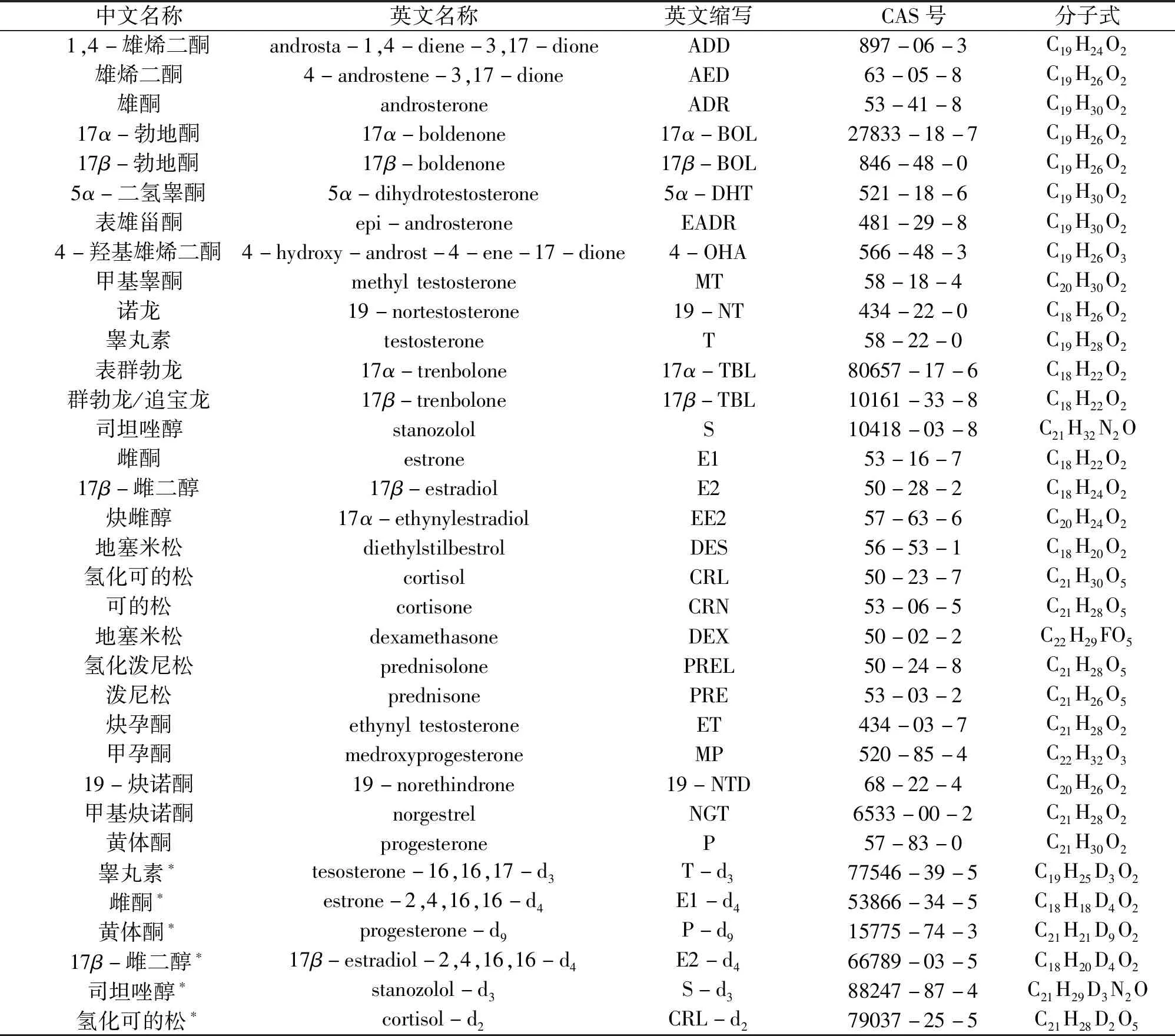
表1 28种目标化合物及6种内标物质Table 1 The 28 target compounds and 6 internal standard substances
注:*为内标物质.
实验材料:HLB固相小柱(6 mL, 500 mg)购于美国Waters公司;玻璃纤维滤膜(GF/F,孔径0.7 μm)购于英国Whatman公司;尼龙滤膜(13 mm×0.22 μm)购于上海安谱公司. 玻璃器皿使用前先经洗洁精洗涤,再用自来水冲洗、超纯水水冲洗,经干燥箱烘干后置于马弗炉(400 ℃)中焙烧4 h.
仪器设备:场发射扫描电子显微镜(FE-SEM, ULTRA55, Germany ZEISS)、傅里叶变换-红外光谱仪(FT-IR, TENSOR II,英国Bruker)、真空冷冻干燥机(Osterode am Harz,德国CHRIST)、涡旋混合器(XW-80 A,上海精科仪器厂)、离心机(Ananti 30,美国Bechman)、氮吹仪(MTN-2800D,天津奥特赛恩斯仪器有限公司)、旋转蒸发仪(Rotavapor R-3,瑞典Buchi)、16孔固相萃取装置(Visip repTMDL,美国Alltech)、超高效液相色谱串联G6460 A三重四级杆质谱(UHPLC-MS/MS)(1200系列,美国Agilent). 所有标准样和相应的内标样均溶于甲醇配成100 mg/L的单标储备液,所有储备液均保存于容积为125 mL的窄口棕色试剂瓶中,混合标准样和混合内标样分别溶于甲醇中配成质量浓度为1 mg/L的储备液,保存于容积为20 mL的棕色试剂瓶中. 工作液则在实验前由储备液以小于10倍梯度逐渐稀释而得. 所有储备液均置于冰柜中-20 ℃下保存备用.
1.2 中式人工湿地系统的建立
采用中试实验基地的12个中试人工湿地单元进行基质种类和水力负荷的优化实验. 将每个水平潜流式湿地单元的长、宽、高分别设定为0.8、0.6、0.8 m,基质填埋高度设定为 0.65 m,污水控制高度设定为0.6 m. 本实验不考虑植物种类对污染物去除效果的影响,在各单元内种植2行3列(共6颗)的风车草. 人工湿地系统所选用的填充基质分别为:牡蛎壳、沸石、麦饭石和陶粒;每种基质的质量分别为:牡蛎壳7.5×104g;沸石5.5×105g;麦饭石4.0×105g;陶粒3.0×105g. 水力负荷设定为:10、20和30 cm/d;24 h不间断进水,通过流量计进行湿地系统水力负荷的控制(图1). 污水来源于约330人的小区内下水道的生活废水;污水在进入湿地系统单元之前需要进入容积约4.3 m3的稳定池中进行沉淀操作. 该湿地系统通过定时监测水质参数,确定其稳定运行一年后,开始进行样品的采集.
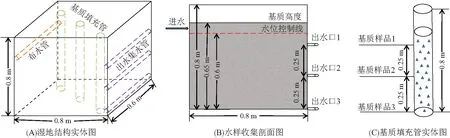
图1 中试人工湿地系统的设计Figure 1 The design of mesocosm-scale constructed wetlands
1.3 样品的采集
12个中试人工湿地单元按照统一命名方式:CW-基质名首字母-HLR(水力负荷),分别进行命名,并用W0、W1、S1等进行编号. 例如:湿地进水(W0)、CW-O-10(W1和S1)等,具体信息如表2所示. 采集13个采样总时间为72 h的混合水样,即每个湿地单元每隔8 h采集1次,连续3 d共采集9次相同体积的水样并混合. 各单元分别设置3个出水口(图1). 从底部出水口收集的水样用于常规污染指标和激素去除率的分析.
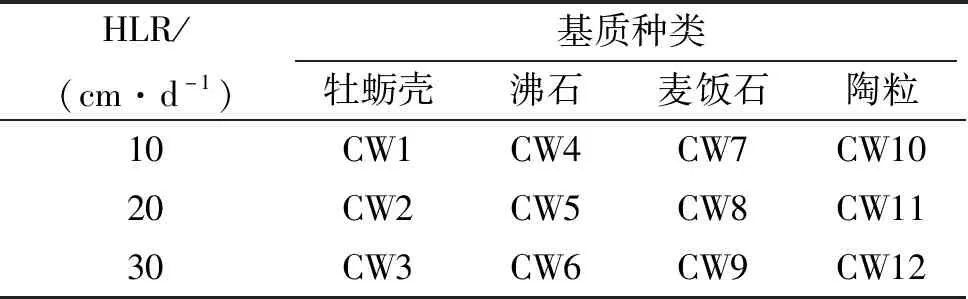
表2 12个中试人工湿地系统的采样点布设Table 2 The sampling locations of 12 mesocosm-scale constructed wetlands
常规污染指标分析所用水样装入洁净的矿泉水瓶,保存在冰柜(-20 ℃)中等待分析;激素去除分析所用水样装入3支1 L容积的棕色瓶装,每个棕色瓶中加入50 mL甲醇(抑制微生物活性)以及适量硫酸(调节水样的pH至3左右,1 L水样加入约0.4 mL 4 mol/L的硫酸).
在水样采集完成后进行基质样品的采集. 从每根基质采样管的每个采样点取等体积的水样,将采自9个采样点的基质样本混合作为混合基质样本,保存于容积为500 mL的组织培养瓶中,加入适量的叠氮化钠(NaN3)来抑制微生物的活性. 所有样品均在4 ℃冷藏下运输和存储,并在24 h内提取物质. 基质样品经过冷冻干燥后提取激素,然后进行均一化过筛(孔径250 μm),最后在-20 ℃、黑暗环境中保存直至激素提取完毕.
1.4 前处理及分析方法
1.4.1 水样的提取方法 使用容积为1 L的棕色瓶采集水样,每个样品点取3个平行水样,分别标记-1、-2、-3,经70 μm孔径的GF/F滤膜滤去颗粒物. 将负载颗粒物的滤膜剪碎,装入到容积为30 mL的离心管中,往离心试管中加入10 mL甲醇,涡旋30 s,放入超声清洗器中超声10 min,以3 000 r/min的转速下离心5 min后取上层清液倒入对应的1 L水样中;第二次提取滤膜的溶剂为5 mL甲醇与5 mL甲酸(0.1%,体积分数),重复以上超声、离心和转移上清液等操作步骤. 在每个水样中加入约0.5 g Na4EDTA以及激素混合内标(T-d3、E1-d4、P-d9、E2-d4、S-d4、Crl-d2)100 μL并将溶液混合均匀. 加载水样采用HLB柱(500 mg 6 mL),加载前用10 mL甲醇和10 mL水活化柱子;水样以5~10 mL/min的速度流过HLB小柱;加载完水样,每个棕色瓶均用25 mL的 5%甲醇水混合溶液润洗2次;在润洗后向每个柱子中加入10 mL 超纯水洗去残留的Na4EDTA. 将HLB小柱抽干30~60 min,随后向HLB小柱中依次加入5 mL甲醇、4 mL乙酸乙酯和3 mL 二氯甲烷进行洗脱;使用氮气将洗脱液中的有机溶剂缓慢吹干,使用1 mL的Merk甲醇定容,经孔径为0.22 μm的有机相滤膜过滤后保存于 2 mL进样小瓶中,置于冰箱内-20 ℃下保存,待测.
1.4.2 基质样品的提取方法 采用真空冷冻干燥机冻干后取2 g基质样品于容积30 mL的离心试管中,加入100 μL激素混合内标液,置于冷库中4 ℃下静置一晚. 次日往离心管中加入10 mL甲醇,涡旋20 s,超声15 min,以3 000 r/min转速离心10 min,取上清液至容积为300 mL的平底烧瓶中,重复提取3次;加超纯水稀释,定容为300 mL,并加入30 μL 4 mmol H2SO4,将pH调至3.0. 采用200 mg HLB柱吸附,加载前用10 mL甲醇和10 mL超纯水活化,以5~10 mL/min的流速加载稀释后的提取液. 随后采用25 mL甲醇水溶液(5%,体积分数)润洗平底烧瓶2次. 将HLB小柱抽干30~60 min,再向HLB小柱中加入4 mL乙酸乙酯(CNW),进行洗脱,共洗脱3次;使用氮气将洗脱液中的有机溶剂缓慢吹干,使用1 mL的Merk甲醇定容,经孔径为0.22 μm的有机相滤膜过滤后保存于容积为2 mL的进样小瓶中,置于冰箱内-20 ℃下保存,待测.
1.5 仪器分析方法
所有目标化合物均采用超高效液相色谱-串联质谱(UHPLC-MS-MS)进行分析,其中超高效液相色谱(UHPLC)测试采用Agilent 1200型仪器,MS-MS采用Agilent 6460A型仪器,采用电喷雾离子源(ESI)、多重反应模式(MRM),色谱柱为Agilent Zorbax SB-C18(3.0 mm×100 mm,1.8 μm),柱前端连接1个在线过滤器(2.1 mm,0.2 mm),去除流动相和样品中的细小颗粒物.
质谱条件:在ESI离子源、正模式条件下,采用甲醇与甲酸+乙酸铵混合液 (5 mmol乙酸铵+0.05%甲酸)作为流动相,流速为0.3 mL/min,进样量为10 μL,柱温为40 ℃,雾化器压力为344 kPa,毛细管电压和喷嘴电压分别为3 500 V和0 V,干燥气温度和流速分别为350 ℃和8 L/min ,鞘气温度和流速分别为350 ℃和12 L/min. ESI+模式下母离子为[M+H]+.
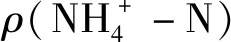
1.6 基质的扫描电镜表征与红外光谱分析
利用场发射扫描电子显微镜对所有基质样品进行形貌表征. 采用傅里叶变换-红外光谱仪对4种湿地基质运行前后的表面基团进行分析,样品采用KBr压片法制备,分辨率为4 cm-1,采用64次累积扫描,波数范围为500~4 000 cm-1.
1.7 数据处理
基础数据通过Excel 2010进行分析和计算,包括目标污染物的平均值和标准差. 激素通量的计算可以反映出不同运行条件下人工湿地单元对激素的去除能力. 通过每日进入湿地系统中的激素总通量减去出水中剩余的激素总通量,可以得到该湿地系统单元每天去除的激素总量. 水相中激素总量可以根据激素质量浓度与湿地单元流量之积得到,即:
Mi=ρiQ,
其中,Mi指污染物i在水相中的总通量(g/d或μg/d);ρi指污染物i在水相中的质量浓度(mg/L或ng/L);Q指每天流过人工湿地单元水量(m3/d). 人工湿地系统对污染物的去除通量等于进水中污染物质通量与减去出水中的污染物质通量.
质量平衡核算可以衡量不同运行条件下人工湿地单元对激素的去除能力. 假设在采样前各单元都处于稳定运行的状态. 通过质量平衡核算可以判断各污染指标的排放量,从而计算出各污染指标进出湿地单元的流量:
M′i=ρiQt,
M″i=wiM,
其中,M′i和M″i分别指污染物i在水相和固相(颗粒、基质)中的通量(g或μg);ρi和wi分别指污染物i在水相中的质量浓度(mg/L或ng/L)和固相中的质量分数(mg/g或ng/g);Q指每天流过人工湿地系统的水流量(m3/d);M指人工湿地系统中基质的总质量(kg);t是指湿地系统稳定运行的总时间(d).
2 结果与讨论
2.1 人工湿地系统基质的特征
由SEM图(图2)可以直观看出备选的4种基质的形貌. 蛎壳和麦饭石均为层状结构,其中牡蛎壳为团聚体;沸石和陶粒均为孔状结构,其中沸石为微孔结构(孔径<2 nm),而陶粒为大孔结构(孔径>50 nm)[22]. 结果表明:沸石和陶粒的比表面积均比牡蛎壳和麦饭石的大.

图2 4种基质的SEM图Figure 2 The SEM images of the four substrates
不同运行条件下湿地基质的FT-IR谱(图3)可表征不同填料的表面基团以及探索填料空隙Si—O键的对称和反对称伸缩振动峰位于波数为700~1 500 cm-1的区域;Si—O四面体的二级结构振动峰位于400~700 cm-1;羟基振动峰位于3 500 cm-1,且羟基是填料化学反应的关键基团. 由于牡蛎壳的主要成分为CaCO3,所以C—O振动峰位于1 417 cm-1,而其他3种填料都存在Si—O键的强振动峰. 另外,由于Si(Al)—OH的贡献,沸石和麦饭石的红外光谱曲线在波数3 500 cm-1左右也出现了振动峰.
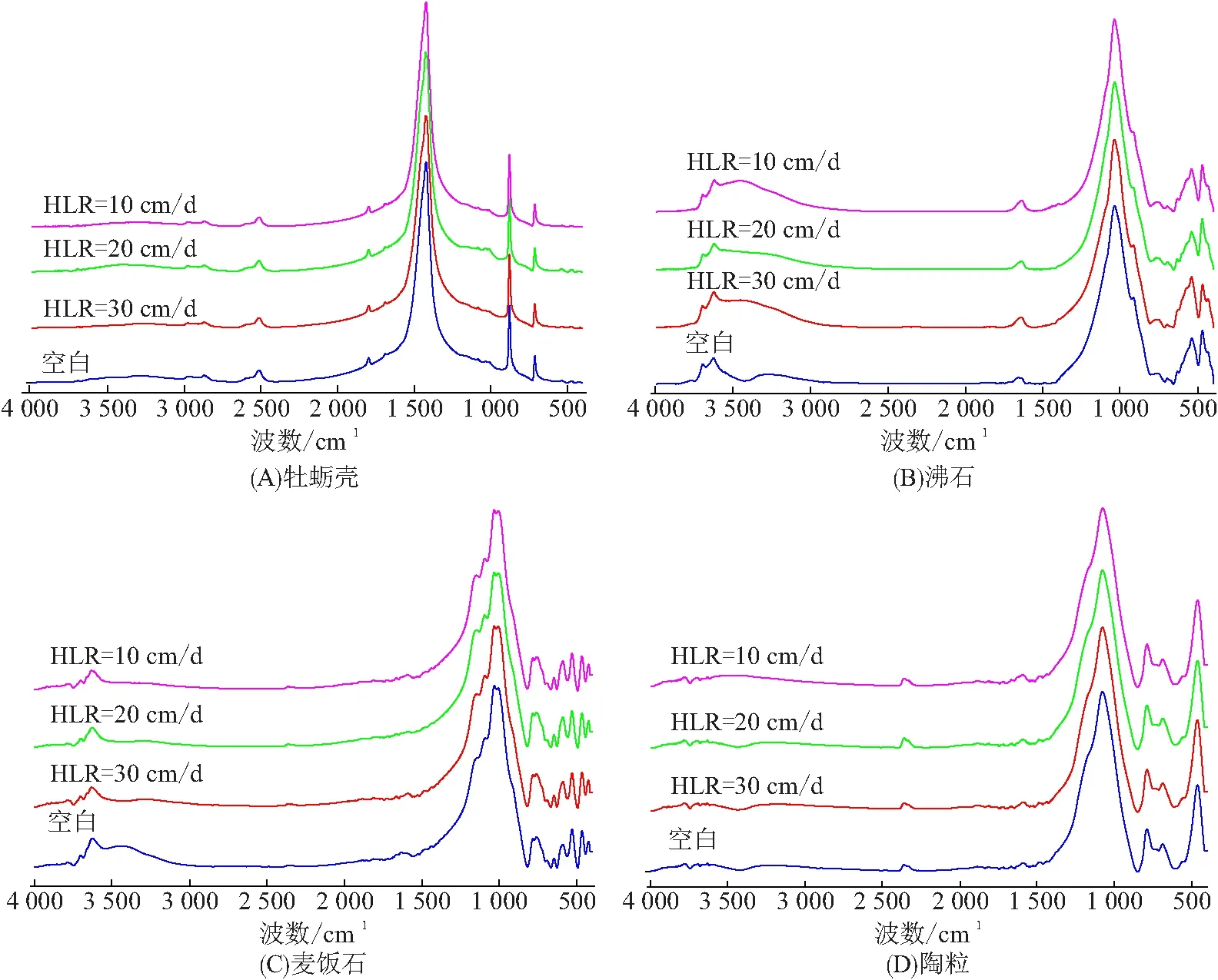
图3 4种基质的傅里叶-变换红外光谱Figure 3 The FT-IR spectra of four substrates
2.2 人工湿地系统的运行情况

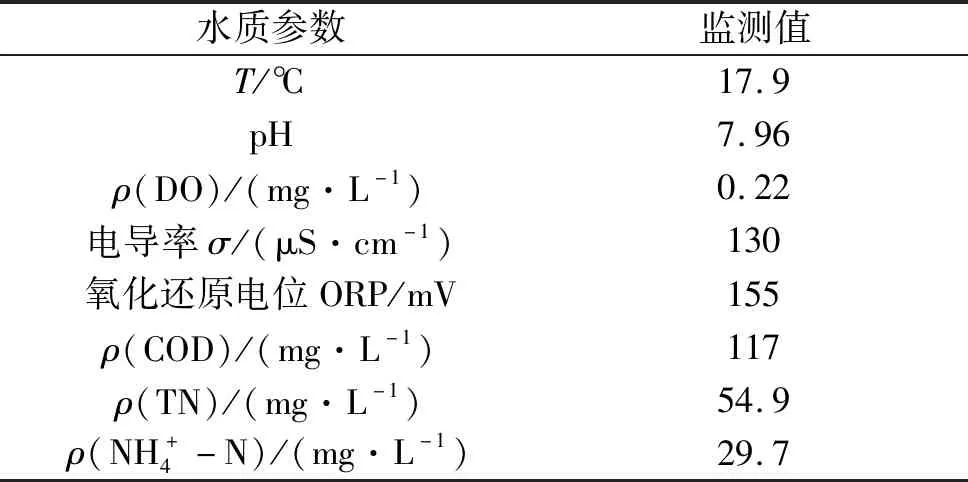
表3 人工湿地系统进水的水质参数Table 3 The water quality parameters in influent of constructed wetland system
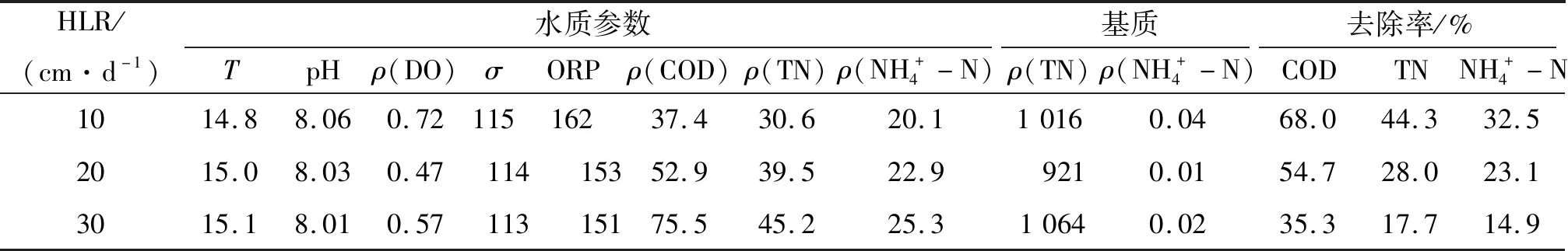
表4 中试人工湿地系统出水的水质参数及常规污染指标的去除率(牡蛎壳)Table 4 The wastewater quality parameters of effluents in themesocosm-scale constructed wetlands and the removal rate of conventional wastewater pollutants
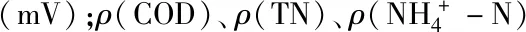
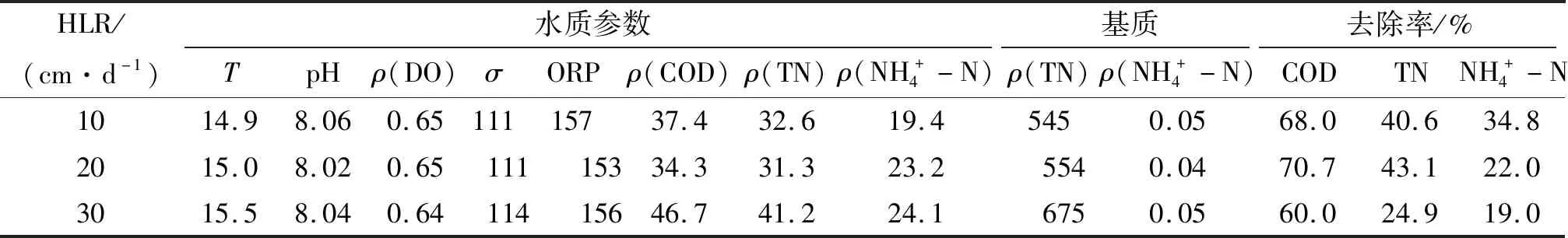
表5 中试人工湿地系统出水的水质参数及常规污染指标及去除率(沸石)Table 5 The wastewater quality parameters of effluents in themesocosm-scale constructed wetlands and the removal rate of conventional wastewater pollutants
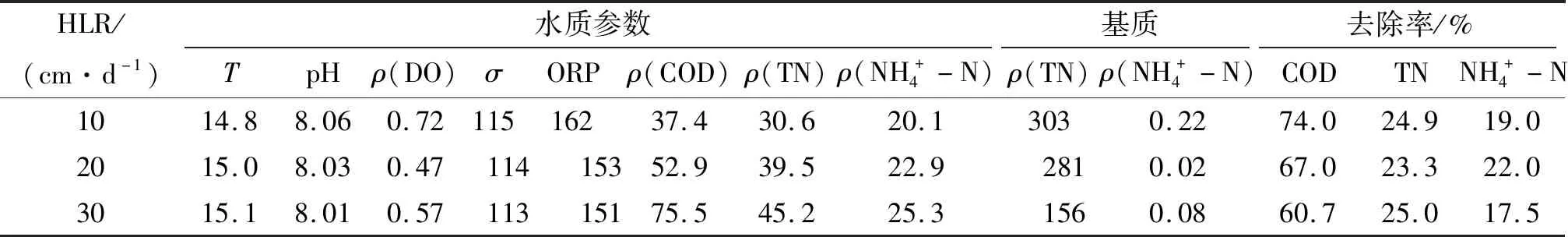
表6 中试人工湿地系统出水的水质参数及常规污染指标的去除率(麦饭石)Table 6 The wastewater quality parameters of effluents in themesocosm-scale constructed wetlands and the removal rate of conventional wastewater pollutants
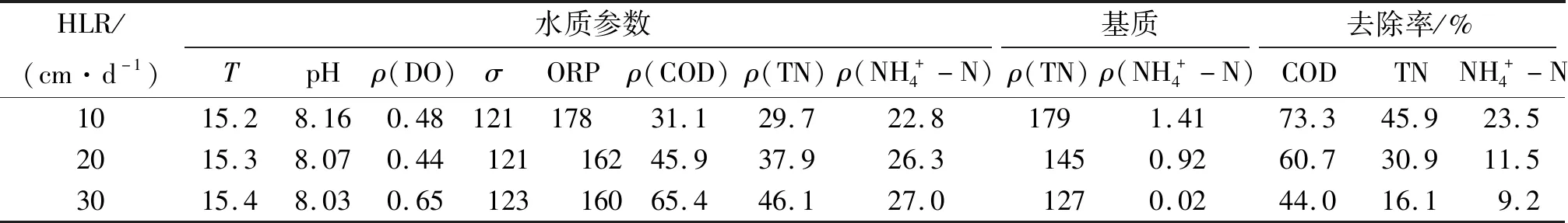
表7 中试人工湿地系统出水的水质参数及常规污染指标的去除率(陶粒)Table 7 The wastewater quality parameters of effluents in themesocosm-scale constructed wetlands and the removal rate of conventional wastewater pollutants
2.3 激素的质量浓度与去除率
在进水中共检出9种激素物质(图4),分别为雄烯二酮、17α-勃地酮、17β-勃地酮、1,4-雄烯二酮、雄酮、羟孕酮、甲孕酮、黄体酮及睾丸素(6.32~1 113 ng/L).
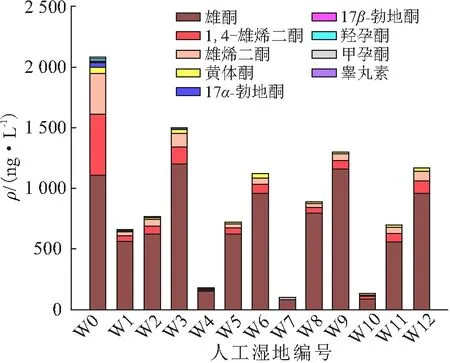
图4 人工湿地系统进水中激素的质量浓度Figure 4 The concentrations of steroids in the influent of the constructed wetlands
在进水中,雄酮的质量浓度最高(1 113 ng/L);其次为1,4-雄烯二酮和雄烯二酮,质量浓度分别为498.00、335.00 ng/L;黄体酮、17α-勃地酮、羟孕酮、17β-勃地酮、甲孕酮、睾丸素的质量浓度较低,分别为50.40、43.50、15.50、10.50、7.61、6.32 ng/L.
在基质样品中只检出1,4-雄烯二酮和雄烯二酮2种激素(0.16~1.88 ng/g)(表8). 在4种基质以及3种水力负荷条件下,中试人工湿地单元对激素的去除率差别较大:(1)对低质量浓度的羟孕酮、甲孕酮、睾丸素的去除率均达到了100%;(2)1,4-雄烯二酮和雄烯二酮的去除率相差不大(67.8%~98.8%);(3)质量浓度最高的雄酮其去除率波动较大(-1.0%~92.1%),而黄体酮的去除率在32.5%~88.3%范围;(4)对于17α-勃地酮,在以牡蛎壳为基质时其去除率在72.3%~89.7%范围,而以沸石、麦饭石、陶粒为基质时其去除率均达到了100%;(5)对于17β-勃地酮,只有在水力负荷为10 cm/d且基质为沸石、麦饭石、陶粒的情况下,其去除率达到100%,而在其他基质情况下其去除率均在43.8%~80.1%范围.
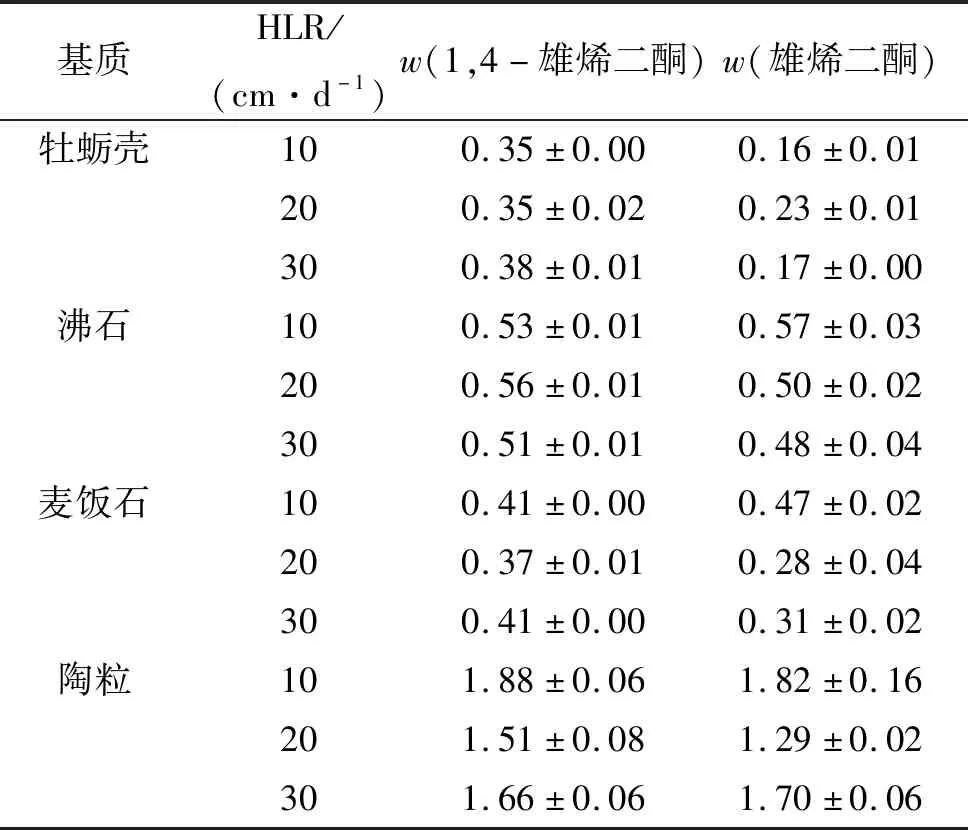
表8 不同基质系统中2种激素的检出质量分数Table 8 The mass fractions of the two detected steroids in systems with different substrates ng/g
中试湿地单元对总激素的去除率在27.7%~94.9%之间(图5),其去除规律为:在相同基质条件下,中试人工湿地单元对总激素的去除率随着水力负荷的增加而减小;水力负荷越小湿地单元对总激素的去除率越高;在相同的水力负荷条件下,去除率由高至低的湿地单元基质种类依次为麦饭石、陶粒、沸石、牡蛎壳.
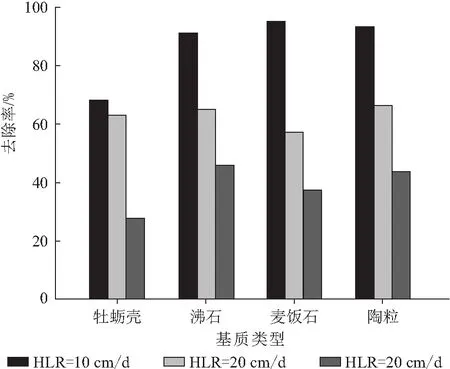
图5 中试人工湿地系统中不同水力负荷对激素的去除率
Figure 5 The removal rate of the total steroids in the mesocosm-scale constructed wetlands with different hydraulic loads
2.4 人工湿地系统中污染物的质量平衡核算


表9 中试人工湿地系统对激素和常规污染指标的去除通量Table 9 Removal of the mass loadings of steroids and conventional wastewater pollutants by the mesocosm-scale constructed wetlands
注:A为雄烯二酮;B为17α-勃地酮;C为17β-勃地酮;D为1,4-雄烯二酮;E为雄酮;F为羟孕酮;G为甲孕酮;H为黄体酮;I为睾丸素.Mh,d为激素的日去除通量;Mp,d为常规污染物的日去除通量.
2.5 人工湿地系统对激素的去除效果评价
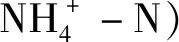
在湿地系统运行期间,3种水力负荷下进水中激素的总通量达到了22 776、45 552、68 328 μg,经湿地系统处理后,12个湿地单元出水的激素总通量范围:1 476~65 848 μg,其中,基质吸附了4.5~819 μg. 通过计算得到这12个湿地单元对激素的总去除率、基质吸附率(表10),结果表明:基质吸附的贡献很小.
在湿地单元的4种基质中,2种激素(1,4-雄烯二酮和雄烯二酮)被检出,说明基质吸附是湿地系统对激素(特别是1,4-雄烯二酮和雄烯二酮)的去除途径之一. 鉴于激素物质在湿地系统中通过水解、光催化降以及蒸腾作用去除的效果微乎其微. 另外,对所有检出的激素物质进行质量平衡核算的结果显示,基质吸附量只占湿地系统对污染物去除量的很小一部分(图10). 因此,我们认为湿地系统对激素物质的去除主要依靠微生物的降解. 实际上,多数研究[29-32]表明:污水处理对于激素的去除主要依靠微生物降解,微生物群落越丰富,代谢能力越强,去除效果也越强.
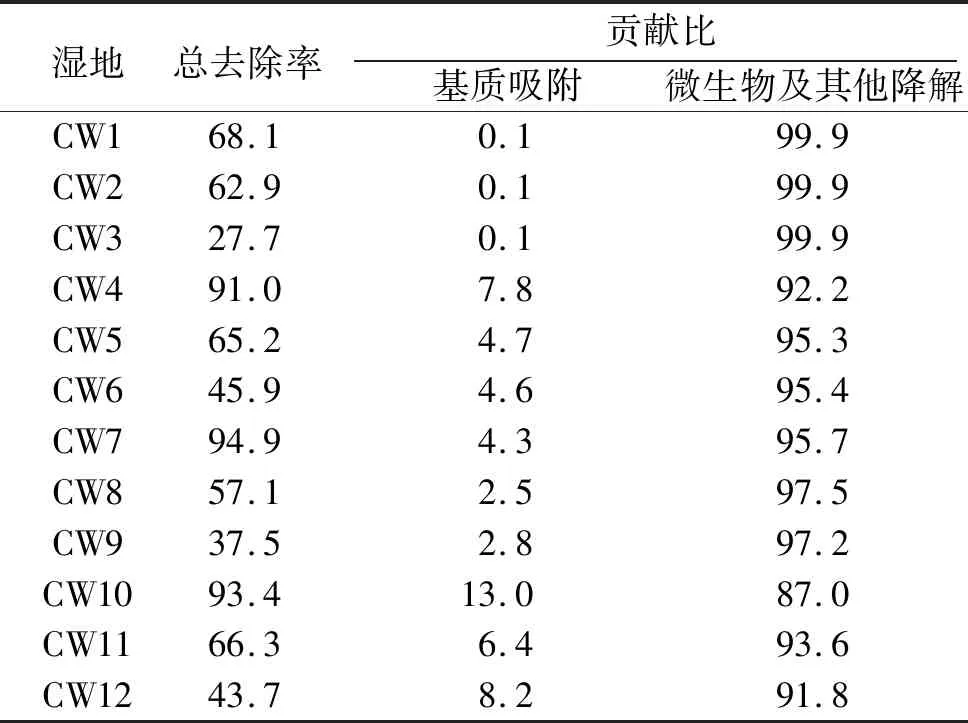
表10 人工湿地系统在运行期间通过不同途径对激素的总去除率的贡献比Table 10 The mass removal percentages of steroids with different mechanisms in the mesocosm-scale constructed wetlands during the operation period%
3 结论